一种简单、极快的植物叶片DNA提取方法
2018-12-05,,,,
, , , ,
(1.宁夏农林科学院 农业生物技术研究中心, 宁夏 银川 750002;2.北方民族大学 生物科学与工程学院, 宁夏 银川750021;3.宁夏农林科学院 枸杞工程技术研究所, 宁夏 银川 750002)
DNA是分子生物学研究的主要对象之一,在植物分子生物学和遗传育种中,基因组DNA的质量好坏是影响其成败的关键因素。人们经常需要提取高质量的植物DNA,用于构建基因文库、基因组Sourthern 分析、酶切、克隆和测序等分子生物学实验。根据植物的研究对象、研究目的和研究成本等不同,提取基因组DNA 所应用的方法也不同。其中,随着作物分子辅助育种的广泛应用与推广,基因型鉴定是最主要的工作,基因组DNA的提取则是最繁重、最耗时的工作之一。目前提取基因组DNA的方法有: 1) CTAB提取法。此方法多用于禾本科植物基因组DNA的提取,是1987年Doyle最先应用[1],后来应用改进的CTAB法,用特定吸附作用的螯合树脂在特定条件下,吸附、纯化DNA; 2) PVP提取法。此方法主要应用于林木类植物DNA的提取,1997年Kim 最先应用此方法提取果树和针叶类林木中高质量的DNA[2]; 3) SDS提取法。此方法适用于多种植物DNA的提取。 4) 尿素提取法。此方法适用于一般植物和真核微生物DNA的提取,1990年Dudler最先应用此方法[3-5]。这些方法均用到离心机、提取步骤繁杂、配制化学试剂种类众多、提取过程刺激味大,缺乏高效的、快速、环保的提取植物基因DNA的方法。
本研究针对以上基因组DNA提取方法存在的不足进行改进,用时大约90 s即可完成植物叶片基因组DNA的提取,且完全可以满足PCR反应的基因型鉴定[6]、基因克隆和测序等需要。
1 材料与方法
1.1 植物材料
选取4 mg水稻新鲜、幼嫩叶片为试验材料。
1.2 主要试剂
植物细胞裂解液(裂解液中SDS质量百分比浓度为0.06%、 EDTA的浓度为25 mmol/L、NaCl的浓度为250 mmol/L、Tris-base 200 mmol/L, pH=8.0);DNA漂洗液(Tris-base的浓度为10 mmol/L、Tween-20质量百分比浓度为0.15%);2×Mixture PCR扩增试剂盒购自北京擎天生物科技有限公司;DNA Marker DL 2000,质粒提取试剂盒、胶回收试剂盒、DH 5 α感受态均为北京天根生化科技有限公司产品;Peasy-T载体为北京全式金生物公司产品,其它试剂为分析纯;测序工作由北京擎天生物科技有限公司用ABI 3730测序仪完成。
1.3 引物序列与合成
针对水稻Actin基因设计上下游引物Actin_FPrimer,Actin_RPrimer,预计扩增大小为459 bp。针对水稻BADH2第三外显子片段,扩增片段预计大小为431 bp。
Actin_FPrimer:TGCTATGTACGTCGCCATCCA,
Actin_RPrimer:AATGAGTAACCACGCTCCGTC,
E 3_FP: GGCATATGCGAGCATTTTAT,
E 3_RP:TAGTACCATGCTTGGGTC。
以上引物由上海捷瑞生物公司合成,用去离子水将各引物稀释到10μM工作浓度。
1.4 植物叶片DNA提取
植物叶片DNA按以下步骤提取。
1) 水稻叶片提取材料4 mg,装入圆底EP管中,加1粒直径4 mm的钢珠,将管子浸入液氮中冷却,待彻底冷却后(2~3 min),快速用振荡研磨仪(频率25次/s,时间30 s)将植物组织打碎。
2) 加入植物细胞裂解液300μL,上下颠倒5~6次,溶液变浑浊,室温下放置待用,即得到植物材料DNA的粗提液。若无液氮,可先用小剪刀将叶片尽可能剪碎装入1.5 mL 尖底EP管中,然后加入500μL 植物细胞裂解液振荡破碎组织。
3) 将干净脱脂棉签浸入步骤二中的DNA的粗提液3 s,将浸润的棉签迅速在DNA 漂洗液中轻轻漂洗3次,然后再将其在100μL 去离子水(ddH2O)或TE彻底洗脱3~5次,洗脱过的ddH2O即DNA溶液,可用于下游的分子生物学实验。
1.5 PCR检测
为了验证所提DNA是否满足PCR扩增,选取水稻肌动蛋白基因Actin设计的上述引物,预计扩增大小为459 bp。按照以下PCR反应体系配置反应液20μL:2×Mixture,10μL;Actin-FPrimer,1μL;Actin-BPrimer,1μL:上述DNA溶液2μL;ddH2O 6μL。反应程序为:预变性95 ℃,5 min;循环30个,95 ℃,30 s;55 ℃,30 s;72 ℃,30 s;最后延伸72 ℃,10 min。PCR产物上样量为10μL,电压120 V,4 CM/V;恒压电泳30~50 min。
1.6 DNA灵敏度检测
为了检测其灵敏度,对所提DNA溶液进行了梯度稀释。首先吸取2μL DNA溶液至8μL 去离子水中,再从稀释溶液中吸取2~8μL 去离子水,依次稀释到107。以上述依次稀释溶液为模板进行PCR扩增。
1.7 DNA测序验证
为了检测此方法所提DNA是否满足克隆、测序的需要,用E 3_FP,E 3_RP引物对水稻OsBADH2基因的片段进行扩增,预计扩增大小为431 bp,用胶回收试剂盒将其回收,然后连接Peasy-T载体,转化DH 5 α感受态大肠杆菌,挑取阳性克隆进行测序分析。胶回收步骤、连接体系、转化方法和质粒提取均按试剂盒说明书进行。
2 结果与分析
2.1 植物叶片DNA提取
依据以上的提取方法,得到DNA粗提液效果见图1。圆底EP管中,溶液呈翠绿色,植物组匀浆彻底,表明使用液氮效果较好。所得DNA溶液为Ⅰ。无液氮提取效果见图2。此方法得到的DNA粗提溶液较前法较淡,一些叶片组织明显未被破碎。但通过延长破碎时间改善组织破碎效果。所得到DNA溶液为Ⅱ。

图1 液氮研磨效果

图2 无液氮研磨效果
2.2 PCR产物凝胶电泳结果
液氮研磨法和无液氮研磨法2种提取方法,分别用水稻Actin基因的上述引物进行了PCR,其产物的凝胶电泳分别见图3和图4。两图中均有459 bp条带扩增,说明2种方法所提DNA溶液满足基因扩增的需要。
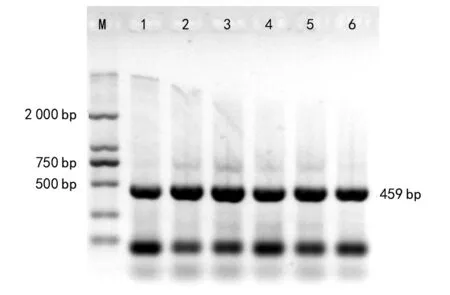
图3 液氮研磨法PCR扩增
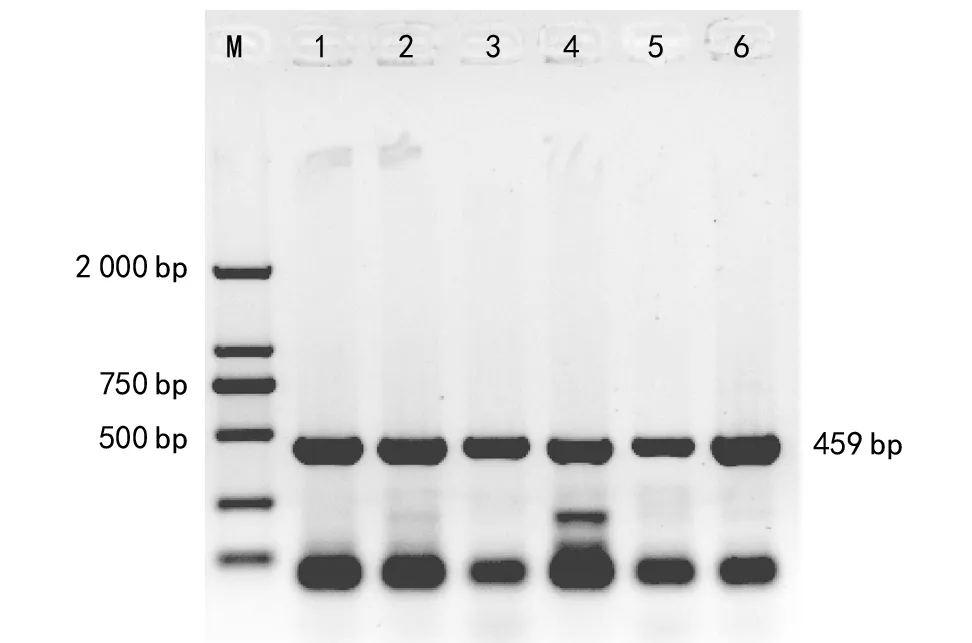
图4 无液氮研磨法PCR扩增
2.3 DNA溶液的灵敏度检测
以液氮方法提取的DNA溶液梯度稀释后作为模板,以水稻Actin基因设计的引物进行扩增,PCR产物凝胶电泳见图5,从左到右稀释倍数依次递增。图中结果表明,此方法提取的DNA溶液1 000万倍稀释,依然可以进行目的基因的PCR扩增。

图5 DNA溶液灵敏度验证
2.4 目标基因的测序分析
以E 3_FP,E 3_RP引物对水稻OsBADH2基因的片段扩增结果见图6,扩增片段大小为431 bp;阳性克隆质粒的测序结果见图7。测序峰图清晰,经比对完全与参考序列一致,此方法所提DNA完全满足基因克隆、测序的需要。

图6 OsBADH2 PCR 扩增

图7 BADH2测序图
3 结 论
本研究以水稻幼苗叶片为试验材料,通过棉签等吸附材料直接提取DNA,建立了一种简便、快速的DNA提取方法,大大加快了分子标记辅助育种中基因型鉴定等繁锁工作。同时,该方法对其它植物,如花生[28],铁皮石斛[29]、青稞[30]、燕麦[31]、南瓜[32]等叶片DNA提取有参考价值。
4 讨 论
由于植物特有的细胞壁及胞内物质,很难轻易从植物中分离高产量和高质量的DNA[6]。在选取材料时,应尽可能的挑取处于生长旺盛期的幼嫩组织。这时组织中蛋白质、多糖及酚类化合物都很少,并且由于细胞多数处于分裂旺盛期,DNA的产量也会很高,几乎所有的实验手册都推荐以幼嫩组织作为提取基因组DNA的首选材料[8-10]。叶片是十分理想的材料,叶片中维管组织含量少,提取效果较好。本试验中,选用4 mg新鲜、幼嫩水稻叶片为材料。通过组织破碎,发现叶片量不是越多越好,材料量适合,组织破碎均匀。圆底EP管较尖底EP管效果好,钢珠在破碎仪作用下,更能够在狭小的空间中将叶片组织破碎。漂洗液中Tween 20的作用主要是清洗杂质。SDS是离子型表面活性剂,能溶解细胞膜上的脂质与蛋白质,从而破坏细胞膜结构;且能解聚细胞中的核蛋白,使蛋白质变性而沉淀下来。增大提取缓冲液中SDS的含量,有助于去除糖类和酚类物质[11-14]。本实验中,没有使用RNAase I去除DNA溶液中的RNA,这对基于PCR的基因型鉴定没有影响。本试验中的棉签可以用滤纸等具有吸附作用的材料代替,作者用少量Whatman G/A 玻璃纤维滤纸固定在牙签头上,使用本方法提取步骤同样获得可以直接用于PCR扩增的DNA。对于提取其他植物叶片组织或者其它组织DNA及其下游基因克隆等分子生物学操作,同样可以借鉴本方法[15-27]。
