一种源于枯草芽孢杆菌的新型甘露糖-6-磷酸异构酶的基因克隆与表达
2018-12-04王笑,徐铮,李莎,徐虹
王 笑,徐 铮,李 莎,徐 虹
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.南京工业大学 材料化学工程国家重点实验室,江苏 南京 210009)
稀少糖泛指自然界中难以寻觅、需通过人工合成才能获取的糖类;其中,稀少单糖占绝大多数,包括D-塔格糖、D-阿洛酮糖及D-阿洛糖等。各类稀少单糖作为低热量甜味剂、抗氧化剂、糖苷酶抑制剂以及核苷类似物药物,在食品、保健品和医药等领域得到广泛的应用[1-3]。近年来,糖基异构酶越来越多地应用于稀少单糖的工业化生产[4-8],其中,很多酶不仅可以催化糖磷酸化,也可以转化单糖制备稀少糖,被应用于多种稀少单糖的生产。例如,甘露糖-6-磷酸异构酶(MPI)既能够转化甘露糖-6-磷酸为果糖-6-磷酸,又能够催化L-核酮糖为L-核糖[9-10]。L-核糖是一种新兴的医药中间体,主要用于制备抗乙肝药替比夫定(Sebivo);随着替比夫定的应用规模扩大和销量进一步提升,L-核糖的需求量日益扩大。目前,仅能够通过化学法制备L-核糖,此法产率较低、步骤繁琐。因此,开发一种生物制备L-核糖的技术十分必要。
在本研究中,笔者将一种来自枯草芽孢杆菌B.subtilisstr.168的甘露糖-6-磷酸异构酶基因(BSMPI-2)在大肠杆菌BL21(DE3)中表达,考察其底物特异性以及对于L-核糖和L-核酮糖的异构能力,以期为L-核糖的生物制备提供借鉴。
1 材料和方法
1.1 菌株与质粒
大肠杆菌(Escherichiacoli)菌株DH5α、BL21(DE3)、枯草芽孢杆菌(Bacillussubtilisstr.168)、表达质粒pET-28a(+),保存于南京工业大学食品与轻工学院。
1.2 表达载体的构建与基因表达
依据GenBank上报道的B.subtilis的BSMPI-2编码核酸序列设计PCR扩增引物。上游引物:5′-CCGGAATTCATGTCAACAGTAAGTACAAAAC-3′(划线部分为EcoRⅠ位点),下游引物:5′-C-C-G-C-T-C-G-A-G-T-T-A-T-T-T-A-A-T-T-A-T-T-A-C-G-T-A-T-T-C-C-A-3′(划线部分为XhoⅠ 位点)。枯草芽孢杆菌B.subtilisstr.168在32 ℃、220 r/min条件下培养过夜,利用Axygen的基因组提取试剂盒,按说明书提取细菌基因组DNA作为PCR扩增BSMPI-2基因的模板。扩增程序:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,循环35次,72 ℃ 10 min结束;将PCR产物通过琼脂糖凝胶电泳验证。
对pET-28a(+)用限制性内切酶EcoRⅠ/XhoⅠ双酶切、将扩增后的BSMPI-2基因与线性化的质粒同源重组后获得BSMPI-2基因的重组质粒pET-28a(+)-BSMPI-2。将该质粒转入大肠杆菌DH5α,在卡那霉素(Kan)抗性平板上挑取阳性转化子,通过菌液PCR鉴定pET-28a(+)-BSMPI-2是否正确转化。验证正确后,从大肠杆菌DH5α中提取正确连接的重组质粒pET-28a(+)-BSMPI-2。将重组质粒pET-28a(+)-BSMPI-2转入表达宿主大肠杆菌BL21(DE3),挑取转化子于10 mL的LB培养基中(含25 μg/mL卡那霉素),培养12 h,以2%接种量转接于400 mL的LB培养基(含25 μg/mL卡那霉素)的带挡板1 000 mL锥形瓶内,在37℃、200 r/min振荡培养至OD600为0.6~0.8时加入IPTG至终浓度为1.0 mmol/L,20 ℃诱导培养24 h后,取1 mL菌液进行破碎和离心处理后,进行SDS-PAGE电泳分析。
1.3 重组蛋白纯化
用含10%(体积分数)甘油的pH 8.0、50 mmol/L Tris-HCl 缓冲液重新悬浮诱导表达后的重组工程菌。对细胞悬浮液进行裂解,在低温条件下以12 000g离心裂解液30 min。将得到的粗酶液上清载入Ni-NTA亲和层析树脂,树脂载样前用10%甘油、50 mmol/L Tris-HCl(pH 8.0)和500 mmol/L NaCl平衡,紧接着用10%甘油、50 mmol/L Tris-HCl(pH 8.0)、500 mmol/L NaCl和50 mmol/L咪唑洗去杂蛋白,至OD280趋于稳定,用10% 甘油、50 mmol/L Tris-HCl(pH 8.0)、500 mmol/L NaCl和500 mmol/L 咪唑洗脱目的蛋白,最后所得的纯酶液经HiPrep 26/10 除盐柱(GE Healthcare Corp.)处理除去咪唑盐,最终得到异源表达的重组蛋白BSMPI-2。
1.4 重组蛋白活力测定
MPI对于L-核酮糖的催化最终趋于反应平衡,且该异构反应是可逆的。鉴于L-核酮糖纯品价格昂贵且不易获得,故以MPI对L-核糖的催化活力为标准,测定重组蛋白的酶活力。
测定原理:酮糖在H2SO4的催化下能与咔唑进行反应,两者之间缩合生成化合物颜色介于紫色和红色之间,显色程度与酮糖的含量成线性关系。所以可以利用紫外分光光度计测定在530 nm处的吸光值,计算得到BSMPI-2的活力。
咔唑显色法反应体系:在5 mL离心管中,先后加入500 μL 糖液、100 μL 15 g/L半胱氨酸溶液、3 mL 70%H2SO4以及100 μL 0.12%咔唑酒精溶液,并迅速混合均匀,60 ℃水浴反应10 min,于530 nm波长处测定吸光度。
2 结果与讨论
2.1 BSMPI-2基因的克隆及序列分析
用引物进行PCR扩增,电泳检测PCR扩增产物,结果见图1。
由图1可知:扩增得到大小为950 bp的DNA片段,与预期大小相符。回收片段,克隆送至公司测序,测序结果与NCBI上发表的序列比对,同源性为100%,因此,本研究克隆的BSMPI-2基因的氨基酸序列与GenBank公布的序列(登录号:AF324506)完全相同。然而,前人从未对此甘露糖-6-磷酸异构酶进行研究,仅报道了一级序列。

图1 重组质粒pET-28a(+)-BSMPI-2的PCR电泳图Fig.1 PCR analysis of BSMPI-2 gene from recombinant plasmid

图2 重组蛋白BSMPI-2的SDS-PAGE电泳Fig.2 SDS-PAGE analysis of recombinant protein of BSMPI-2
2.2 BSMPI-2在大肠杆菌的诱导表达
含pET-28a(+)-BSMPI-2的BL21(DE3)菌株经IPTG诱导,破碎细胞,分离纯化酶蛋白,通过SDS-PAGE检测,结果见图2。
由图2可知:分离纯化得到大小约为3.54×104的BSMPI-2重组蛋白表达条带,且条带很清晰,大小与预期结果相符,表明实现了BSMPI-2基因在大肠杆菌中的正确表达。
2.3 最适反应温度的测定
在不同温度下,利用纯化所得的BSMPI-2催化L-核糖进行反应,判断温度对BSMPI-2催化活力的影响,结果见图3。
由图3可知:BSMPI-2的最适反应温度为60 ℃,定义此时的酶活为100%。当温度为20 ℃时,BSMPI-2的相对酶活为(21±0.5)%,在温度达到60 ℃之前,BSMPI-2的酶活随着温度的升高而增加。当温度高于70 ℃时,酶活丧失得十分迅速。因此,BSMPI-2的最适反应温度为60 ℃。

图3 温度对BSMPI-2酶活的影响Fig.3 Effect of temperature on BSMPI-2 activity
2.4 最适pH的测定
以纯酶BSMPI-2为研究对象,在pH 4~11的范围内研究pH对BSMPI-2酶活的影响,结果如图4所示。

图4 pH对BSMPI-2酶活的影响Fig.4 Effect of pH on BSMPI-2 activity
由图4可知:BSMPI-2酶促反应最适pH为8.0左右,此时酶活最高。pH为4.0~6.0时,BSMPI-2酶活相对低下,说明BSMPI-2不适合在酸性条件下进行催化反应。随着pH的增加,酶活逐渐提高。当pH超过8.0,酶活逐渐降低,pH为9.0时,BSMPI-2依然保持着64%的相对酶活,该酶在碱性条件下仍可保持催化活力。
2.5 金属离子及EDTA对BSMPI-2酶活的影响
考察在终浓度1 mmol/L条件下金属离子对BSMPI-2酶活力的影响,结果如表1所示。
由从表1可以看出:不同二价金属离子对BSMPI-2酶活的影响差异较大,其中Cu2+、Ca2+、Ba2+和Mg2+对酶有一定的抑制作用,Co2+、Mn2+和Ni2+可以提高BSMPI-2的活力,Co2+对酶活的促进最大,相对酶活提升到对照组的225%。
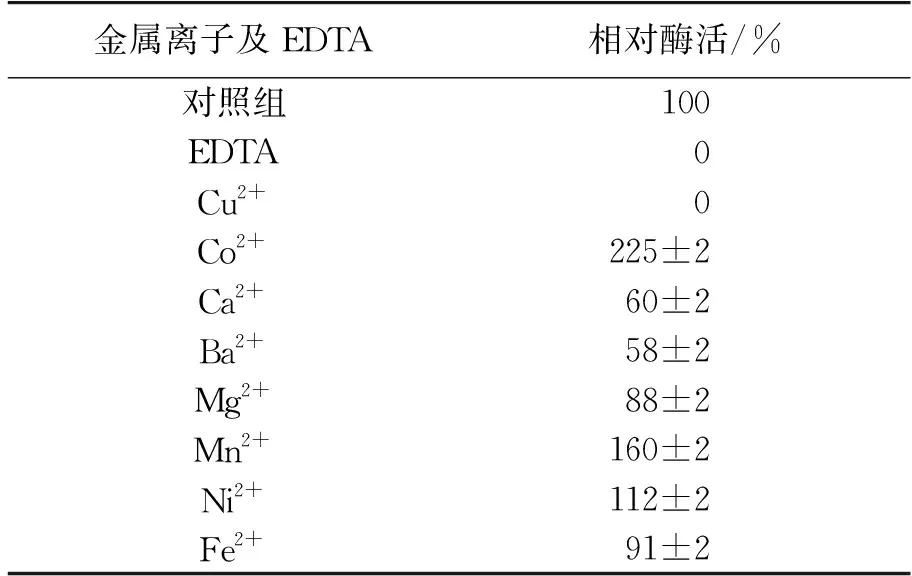
表1 金属离子及EDTA对BSMPI-2的影响
在已知Co2+能够提高BSMPI-2催化活力的情况下,为了在生产中利用这一特点来提高L-核糖的产率,进一步测定不同浓度Co2+对BSMPI-2的影响,结果如图5所示。
由图5可知:当Co2+浓度为0.5 mmol/L时,BSMPI-2的催化活力得到最大的提高,而随着Co2+浓度的升高,BSMPI-2的催化活力反而呈下降趋势。因此,在利用BSMPI-2生产核糖的过程中,加入0.5 mmol/L的Co2+可以使BSMPI-2的催化活力提高到(251±2)%。
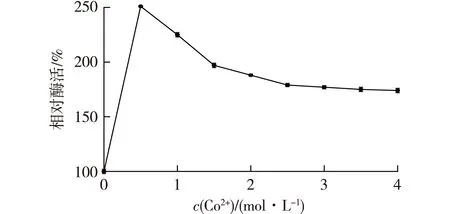
图5 BSMPI-2的最适Co2+浓度Fig.5 Optimum concentration of cobalt ion for BSMPI-2
2.6 BSMPI-2的热稳定性
在不同温度下,对BSMPI-2进行不同时间的热处理,使用热处理之后的酶液反应,考察BSMPI-2的热稳定性,结果如图6所示。
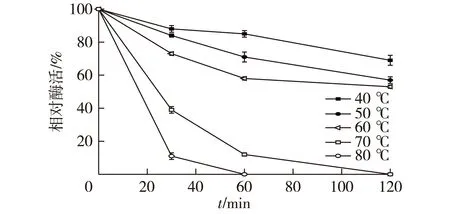
图6 BSMPI-2的热稳定性Fig.6 Thermostability of BSMPI-2
由图6可知:在温度高于60 ℃时,酶活迅速丧失,而在最适反应温度60 ℃以下时,酶活力半衰期为2 h。
2.7 BSMPI-2的底物特异性
BSMPI-2在催化功能上属于典型的醛-酮糖异构酶,考察BSMPI-2对各类醛酮糖的异构作用,结果见表2。
由表2可知:作为已报道的天然底物,BSMPI-2对L-核糖具有最强的催化能力,相对其他醛糖,包括D-葡萄糖、D-木糖、D-半乳糖、D-甘露糖和L-阿拉伯糖,作为底物时的酶活力则非常低,说明这类醛糖都不能被BSMPI-2催化,BSMPI-2的底物谱并不宽泛。
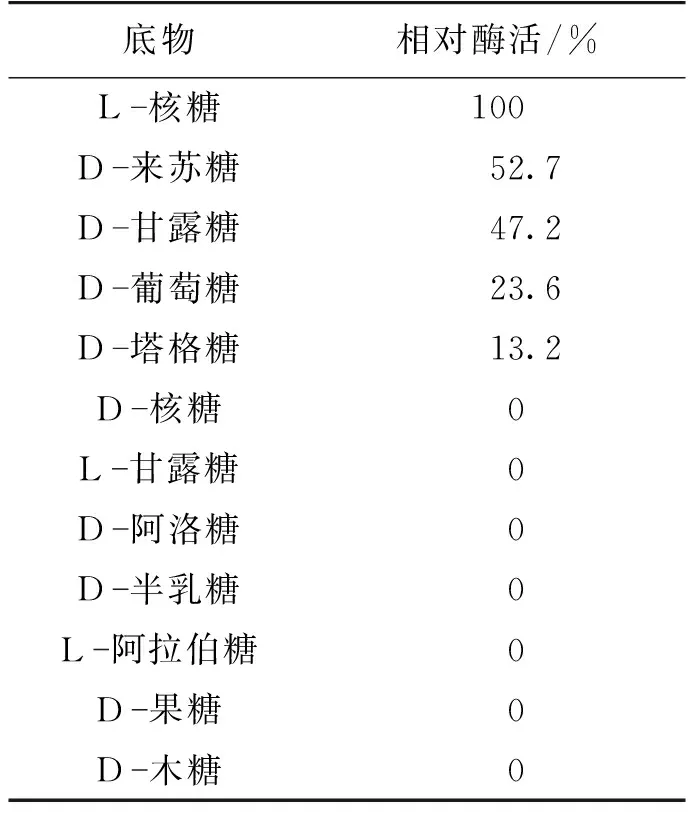
表2 BSMPI-2底物特异性
2.8 BSMPI-2对L-核糖的催化
BSMPI-2以醛糖为底物时,对L-核糖表现出最高的比酶活。因此,在10 mmol/L的底物浓度下,使用BSMPI-2对L-核糖进行生物转化,结果见图7。
由图7可知:转化3 h后,L-核糖以29%的转化率转化为L-核酮糖,最终趋于71∶ 29的反应平衡,意味着这是一种可逆的异构反应。所以文献报道L-核糖具有高酶活的MPI,也可以催化L-核酮糖生成L-核糖[11-13],而与已报道的催化L-核酮糖生产L-核糖的MPI相比,良好的热稳定性及更高的最适反应温度,使得BSMPI-2可以在更高的温度下进行催化反应,具有更高的催化效率。

图7 BSMPI-2对L-核糖的生物催化Fig.7 Biocatalysis of L-ribose by BSMPI-2
3 结论
通过挖掘一种来自B.subtilisstr.168的新型甘露糖-6-磷酸异构酶——BSMPI-2,开展了基因克隆、外源表达、酶纯化和酶学性质表征工作,获得如下结论。
1)B.subtilisstr.168来源的BSMPI-2的最适催化温度和最适催化pH分别为60 ℃和8.0,在高温下有着较长的半衰期,添加0.5 mmol/L的Co2+,对BSMPI-2的活力有着显著促进作用。
2) BSMPI-2的底物专一性较强,仅能催化L-核糖,对其他醛糖如D-木糖、D-半乳糖、D-甘露糖和L-阿拉伯糖均无催化活力,在pH 8.0、60 ℃、添加0.5 mmol/L Co2+条件下,以L-核糖为底物,催化2 h后,将29%的L-核糖异构为L-核酮糖。
3)利用BSMPI-2对L-核糖和L-核酮糖的催化反应平衡,可以实现一条生物催化制备L-核糖的新型路线,与其他应用于L-核糖生物催化的MPI相比,本研究中的MPI有着较好的催化温度和热稳定性,为高效的生物催化产L-核糖提供了新思路。
