正十六烷对节杆菌发酵产环磷酸腺苷的影响
2018-12-04牛欢青陈晓春朱晨杰应汉杰
杨 威,牛欢青,陈晓春,陈 勇,朱晨杰,柳 东,庄 伟,应汉杰
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室 江苏先进生物与化学制造协同创新中心,江苏 南京 211800)
在好氧发酵过程中,从气相到液相的氧传递是影响微生物生长和代谢物生成的重要因素。O2在培养基中的可溶性非常低,不足的O2供应限制了好氧生物合成过程。氧载体是一种在水相中不混溶的辅助液体,这些液体比水具有更高的O2溶解性,对微生物无毒性,同时还能起到消泡作用[1]。氧载体越来越多地被用于解决发酵过程中溶氧(DO)水平的限制问题,与增加搅拌速度、通气量或者分压等方法相比,其具有无需额外能源消耗的优势。目前,常用的氧载体有碳氟化合物、碳氢化合物和各种油(如,合成硅油或植物油)。许多烷烃,包括正十二烷和正十六烷,作为氧载体能够有效地提高发酵产物的产量,例如:添加正十二烷能够提高小白链霉菌StreptomycesalbulusPD-1发酵生产ε-聚赖氨酸的能力[2],正十六烷作为氧载体能够改善Phaffiarhodozyma细胞生长以及类胡萝卜素生产[3]。
环磷酸腺苷 (cAMP) 具有多种生理、药理功能,且在许多生物过程中起到重要调控功能,因而被广泛研究。目前,已报道能用于生产cAMP 的微生物有Microbacterium、Corynebacteriummurisepticum、Brevibacteriumliquefaciens、Streptomycesantibioticus和Arthrobacter[4]。有关发酵法生产cAMP的研究主要集中在菌种筛选、培养基优化、代谢调控和发酵动力学等方面[5]。
笔者所在课题组在前期工作中筛选到1株能够利用葡萄糖生产cAMP的节杆菌Arthrobactersp.CGMCC 3584,同时研究发现,在发酵过程中DO是影响cAMP产量的重要因素之一。本实验中,笔者拟通过添加氧载体以提高发酵过程中氧传递效率,进而促进菌体生长和产物生成,进一步检测关键酶酶活以及胞内核苷酸水平的变化,以初步探究氧载体促进cAMP生成的原因。
1 材料与方法
1.1 材料
1.1.1 菌种
节杆菌Arthrobactersp.CGMCC 3584,南京工业大学应汉杰教授课题组筛选保藏。
1.1.2 培养基
培养基参照文献[5]配制。
1.2 方法
1.2.1 摇瓶发酵
将保藏的甘油菌接种于平板培养基活化,30 ℃培养48 h。平板培养基上的菌苔接种于种子培养基(500 mL摇瓶装液量为30 mL),30 ℃、280 r/min摇床培养24 h。将种子液按10%接种量转接发酵液(500 mL摇瓶装液量为40 mL),30 ℃、280 r/min摇床培养72 h,检测产物产量。
1.2.2 5 L发酵罐批次发酵
采用5 L搅拌式发酵罐(BioFlo 110型,New Brunswick Scientific公司)进行批次发酵,装液量为3 L,接种量10%(体积分数)。发酵条件参照文献[5],发酵液中的DO水平由DO探头检测。
1.2.3 氧载体的添加
考察不同氧载体的最适添加量时,在发酵初始阶段分别添加0.5%、1%、2%、3%、4%、5%和6%(体积分数)的氧载体(正癸烷、正十二烷、正十四烷和正十六烷),发酵72 h后检测菌体干质量(DCW)以及cAMP产量,结果中列出的是每种氧载体的最佳添加量下的检测值。考察正十六烷最适添加时间时,分别在发酵进行了0、12、24、36和48 h后加入2% (体积分数)正十六烷,而后在发酵进行了72 h后检测DCW以及cAMP产量。以不添加氧载体的发酵过程为对照组,每个摇瓶发酵实验重复3次。
在发酵罐中进行培养时,在发酵初始添加2%(体积分数)的正十六烷,而后检测相应发酵参数。以不添加氧载体的发酵过程为对照组,每个发酵罐批次发酵实验重复3次。
1.2.4 DCW、葡萄糖含量以及cAMP测定
DCW、葡萄糖含量以及cAMP测定方法参照文献[5]。
1.2.5 氧传递系数KLa的测定
在5 L 搅拌式发酵罐中(装液量为3 L),向培养基中分别添加0.5%、1%、2%、3%、4%、5%和6%(体积分数) 的正十六烷,进行氧传递系数KLa的测定。KLa采用Na2SO3flow-feeding method测定,参照文献[6]进行。以不添加氧载体的过程为对照组,每个实验重复3次。
1.2.6 酶活测定
在发酵罐中进行培养时,收集的细胞用Tris-HCl(pH 7.0)缓冲液冲洗2遍,缓冲液重悬后用JY92-Ⅱ型超声破仪(新芝生物科技有限公司)超声破碎,8 000g4 ℃离心10 min,上清液用于酶活测定。
磷酸果糖激酶(PFK),6-磷酸葡萄糖脱氢酶(G6PDH)和腺苷酸环化酶的酶活测定方法分别参照文献[4]。蛋白质检测用考马斯亮蓝法。以不添加氧载体的过程为对照组,每个实验重复3次。
1.2.9 胞内核苷酸水平的测定
在发酵罐中进行培养时,收集细胞用于胞内核苷酸水平的测定。胞内三磷酸腺苷(ATP)水平采用GloMaxR-Multi+Detection System (Promega公司)测定。胞内NADH和NAD+水平测定方法参照文献[7]进行。以不添加氧载体的过程为对照组,每个实验重复3次。
2 结果与讨论
2.1 氧载体的筛选结果
为了有效改善发酵体系中的溶氧水平,在发酵初始阶段添加了各种不同浓度的氧载体,以不添加氧载体为对照,发酵72 h后检测DCW和cAMP产量值。4种氧载体(正癸烷、正十二烷、正十四烷和正十六烷)在最适浓度下对发酵结果的影响如表1所示。由表1可知:添加2% (体积分数)正十六烷的效果最佳,DCW和cAMP的产量分别达到7.52 g/L和6.49 g/L,比对照分别提高了14.5%和15.2%(6.53 g/L和5.67 g/L)。

表1 添加不同氧载体摇瓶发酵72 h后的DCW和cAMP产量
进一步研究了正十六烷的最佳添加时间。在摇瓶发酵中,在不同时间(0、12、24、36和48 h)接种后加入2% (体积分数)正十六烷,发酵72 h后检测cAMP产量,结果如表2所示。由表2可知:在发酵的一开始(0 h)添加正十六烷效果最佳,DCW和cAMP的产量分别达到7.73 g/L和6.58 g/L。在Acetobactersuboxydans发酵产山梨糖[8]、P-h-a-f-f-i-ar-h-o-d-o-z-y-m-a产类胡萝卜素[3]及Saccharomycescerevisia产S-腺苷蛋氨酸[9]的研究中,观察到类似的实验结果。
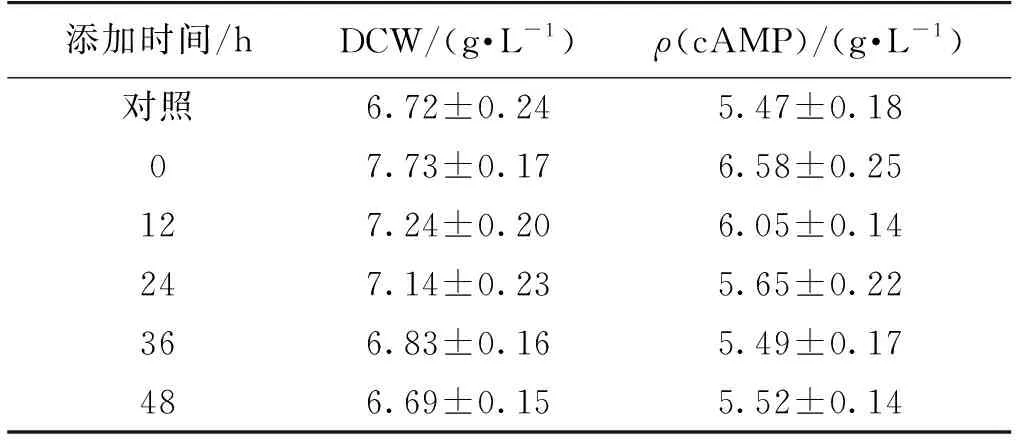
表2 不同时间添加2% (体积分数)正十六烷72 h后的DCW和cAMP产量
2.2 5 L发酵罐中正十六烷对cAMP生产的影响
在5 L发酵罐中进行节杆菌的批次发酵,在发酵初始添加2% (体积分数)的正十六烷,发酵过程曲线如图1所示。
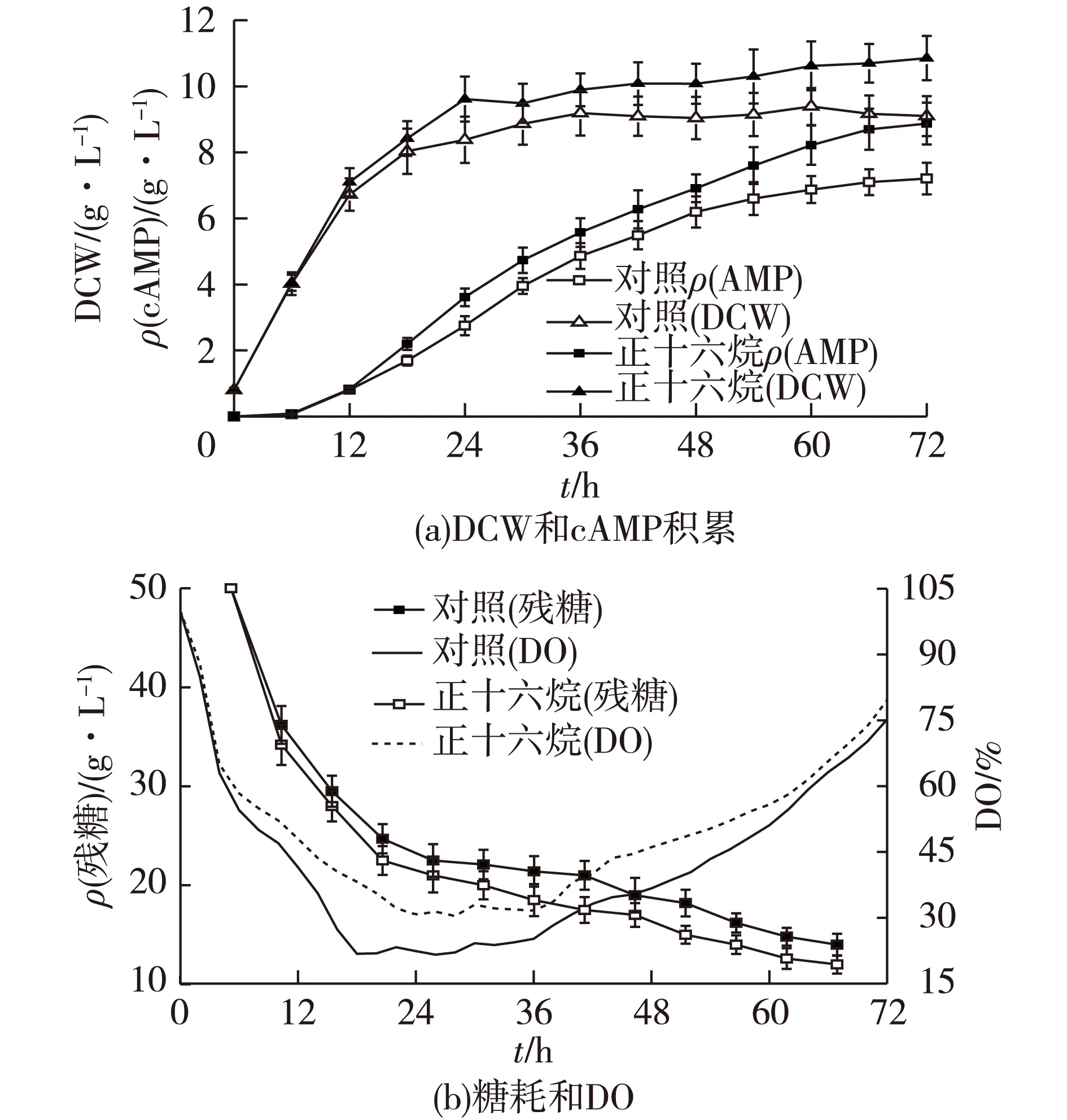
图1 5 L发酵罐中添加正十六烷对发酵的影响Fig.1 Effects of n-hexadecane on the fermentation in a 5-L bioreactor and the control
由图1可知:添加2% 的正十六烷后,糖耗速率、细胞生长速率和cAMP的积累均有一定的提高。发酵72 h后,DCW和cAMP的产量分别达到10.85 g/L和8.87 g/L,比对照分别提高了19.4%和23.2%(9.09 g/L和7.20 g/L)。同时,单位细胞cAMP产量从0.79 g/g增加到0.82 g/g(以1 g细胞干质量计),即合成能力提高了3.8%。在添加氧载体后,残糖质量浓度由14.0 g/L下降到12.0 g/L。发酵过程中,DO在指数生长期明显下降,到稳定期前期维持在一个较低水平,在添加氧载体后DO有一定提高,特别是在发酵18 h左右。
溶氧体积传递系数(KLa)值是发酵罐发酵中一个十分重要的参数。本实验中,在5 L发酵培养体系中,考察正十六烷添加量对KLa的影响,结果如图2所示。
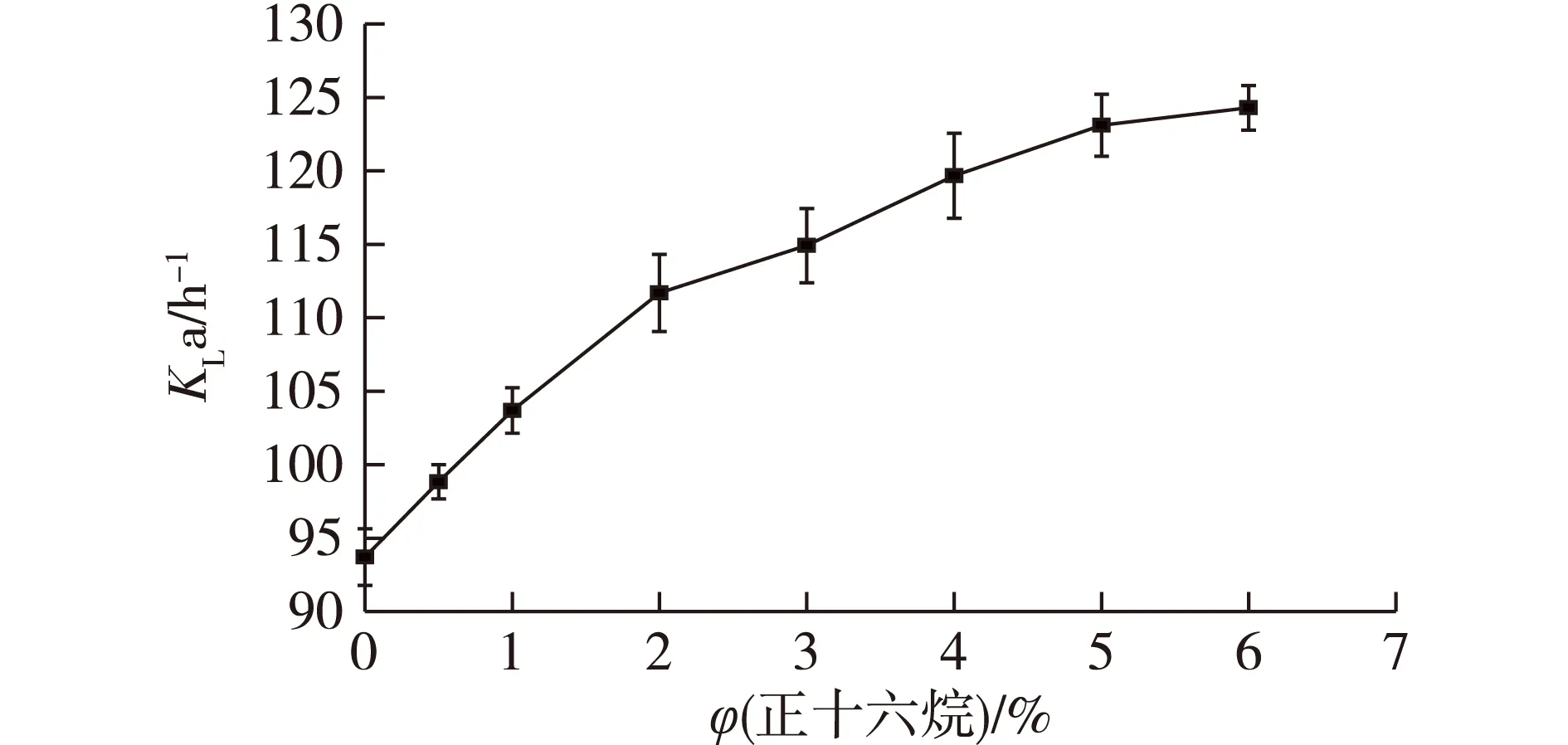
图2 添加正十六烷的体积分数对KLa的影响Fig.2 Effect of n-hexadecane volume fraction on KLa
由图2可知:当正十六烷的添加量由0.5%上升至2%时,KLa与添加浓度的关系几乎呈线性;当正十六烷的添加量再增大时,KLa的增加减缓,到6%时慢慢趋于平衡。同时可以发现,当发酵体系中添加2%的正十六烷,KLa比对照提高了19.2%。因为在好氧发酵过程中,低供氧速率一般会使菌体的生长受到O2的限制。在水溶液中O2的溶解度通常低于10 mg/L,而在正十六烷中,温度为22~30 ℃时,O2的溶解度能达到190~340 mg/L。因此,在烃-水分散体系中的O2溶解度明显高于水中[10]。当在培养基中加入更多的有机溶剂后,体系的氧吸收能力增加,如含有27% (体积分数)正十六烷时,氧传递速率比预测提高了58.5%[11]。Li等[9]研究发现:在培养基中添加不同比例的正十六烷时,KLa先随着正十六烷添加浓度的增加而增加,在体积分数为4%时达到最高值,而后降低。这是由于低浓度的正十六烷对细胞没有毒性,并且能够提高O2供应,进而促进细胞生长和产物生成,而高浓度的正十六烷会对细胞的生长造成影响。
2.3 添加正十六烷对关键酶酶活和胞内核苷酸水平的影响
磷酸果糖激酶(PFK)、6-磷酸-葡萄糖脱氢酶(G6PDH)和腺苷酸环化酶(AC)分别是糖酵解途径、磷酸戊糖途径以及cAMP合成途径的关键酶[12]。为进一步了解氧载体对胞内微环境的影响,考察分批发酵中添加正十六烷对cAMP合成途径中关键酶的酶活以及胞内核苷酸水平的影响,结果如表3所示。
由表3可知:这3个关键酶的比酶活均在发酵24 h后达到最高值,且添加2% (体积分数)的正十六烷对酶活影响不大。在Aspergillusniger[13]和Saccharomycescerevisiae[9]添加氧载体的培养过程中均观察到类似的现象。
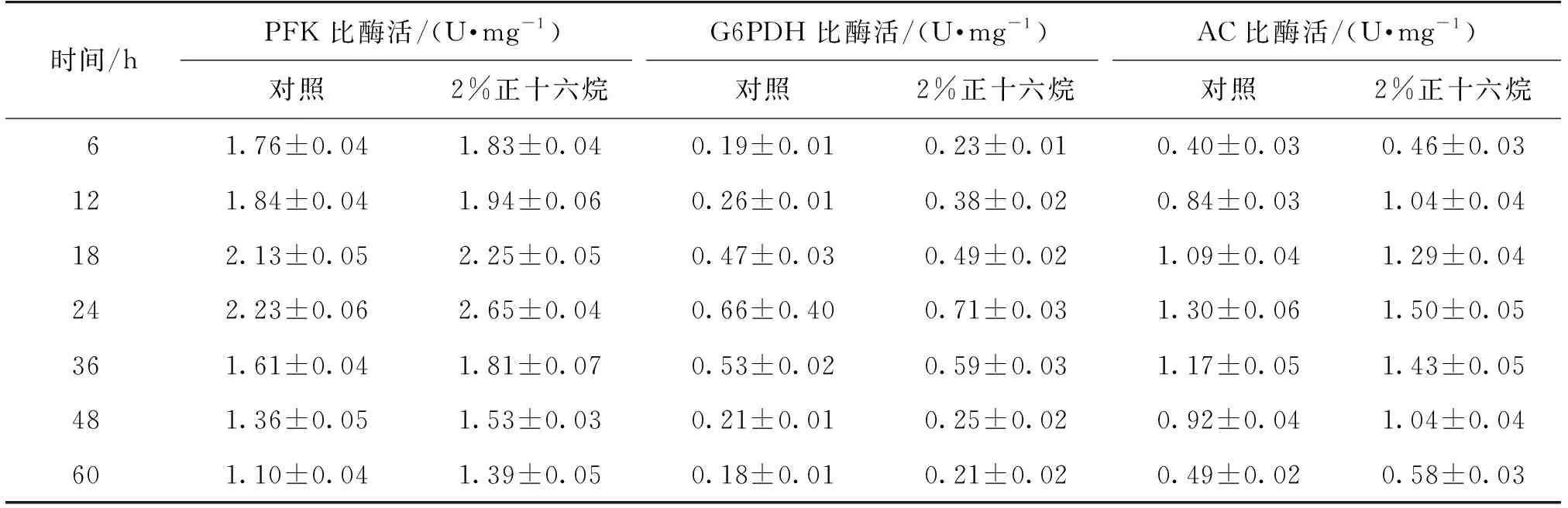
表3 添加2%正十六烷对关键酶比酶活的影响
最后,考察正十六烷对胞内核苷酸水平的影响,结果见图3。
由图3可知:胞内NADH和NAD+水平随着发酵进程的延长而减少,且在好氧条件下,NAD(H)水平主要以氧化态NAD形式存在。
与对照相比,添加正十六烷条件下,NADH/NAD+的比率更低。NADH/NAD+比率反映了胞内氧化还原状态,其受到外部电子受体的可用性和性质的影响。溶氧水平能够影响胞内NADH/NAD+的比率,在高溶氧水平下,NADH含量以及NADH/NAD+比率相应降低[14]。笔者推测正十六烷的添加改善了发酵液中的溶氧水平,因而胞内氧化还原状态发生改变,进而降低了NADH/NAD+比率。
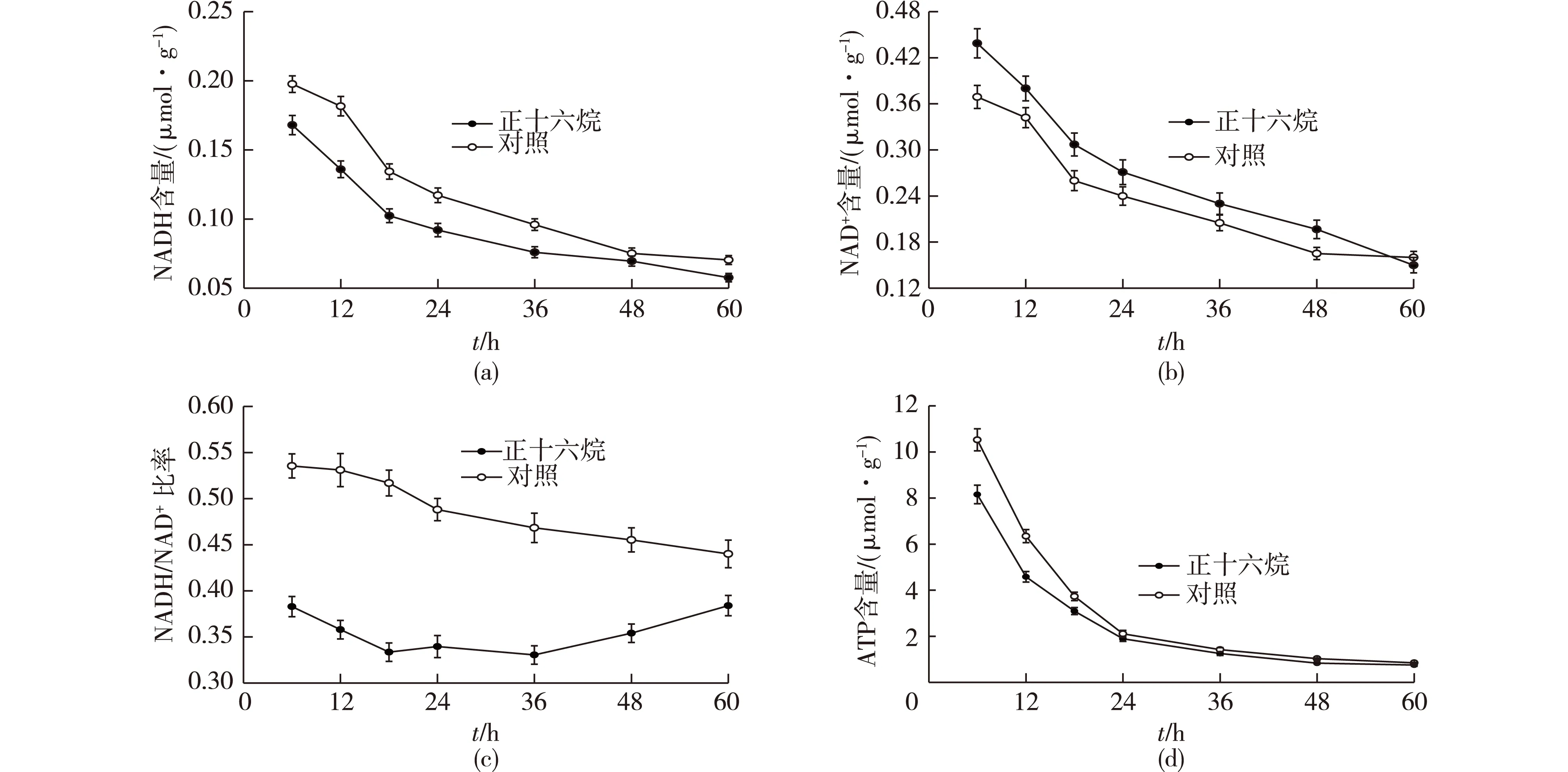
图3 添加正十六烷对胞内核苷酸水平的影响Fig.3 Comparison of the intracellular nucleotide levels in the cells cultured for different time with 2% n-hexadecane and the control
但是与对照相比,胞内的ATP含量在指数生长期快速降低,同时添加正十六烷使得胞内ATP含量降低。这是因为ATP为酶反应提供能量,并在代谢网络中作为底物、产物、激活剂或者抑制剂,参与调节众多生物反应过程[15]。研究表明,在酿酒酵母中,糖酵解通量与胞内ATP含量呈负相关性[16],在大肠杆菌中,低的胞内ATP/ADP 比率可促进糖酵解途径的通量[17]。在本研究中,ATP不仅是胞内维持细胞生长和活力的主要能量物质,也是cAMP合成途径中的重要底物。因此,添加正十六烷后,胞内ATP含量的降低可能与更高的糖耗速率以及cAMP生成速率相关。
液态烷烃作为氧载体能够有效促进细胞生长和产物合成[2,9],本研究首次提出利用添加正十六烷的方法提高节杆菌发酵产cAMP产量的方法,同时测定了cAMP合成过程中的关键酶活性以及节杆菌胞内核苷酸水平,初步阐述了正十六烷促进cAMP合成的生理机制。
3 结论
在节杆菌发酵产cAMP的过程中,4种氧载体的添加对cAMP的生成都有促进作用,其中,发酵初期添加2% (体积分数)正十六烷的效果最佳。在5 L 发酵罐中进行批次补料发酵时,添加2%正十六烷后,DCW和cAMP的产量分别达到10.85 g/L和8.87 g/L,比对照分别提高了19.4%和23.2%。同时,正十六烷的添加改变了细胞的胞内核苷酸水平,胞内NADH/NAD+比率以及胞内ATP水平均有一定程度降低。研究表明,在发酵体系中添加适当的氧载体能够改善氧供应,促进好氧菌的细胞生长以及产物积累。
