肾周巨大去分化脂肪肉瘤1例报告
2018-12-04朱遵伟徐烈雨周杰熊焕腾曾涛王金根
朱遵伟,徐烈雨,周杰,熊焕腾,曾涛,王金根
(江西省人民医院,南昌330006)
腹膜后肿瘤发病率低,占全身肿瘤的0.07%~0.20%,组织来源主要包括脂肪、结缔组织、肌肉、血管神经和淋巴组织等,患者预后较差[1]。脂肪肉瘤是最常见的腹膜后恶性软组织肿瘤,发病率约2.5/100万,人群高发年龄为40~60岁,其中腹膜后去分化脂肪肉瘤(DDLS)约占脂肪肉瘤的10%,属于高度恶性类型,术后复发率高、预后差[2]。我们于2017年8月收治了1例肾周巨大DDLS患者,成功施行右肾及肿瘤联合切除术。现将该病例的诊断、及治疗情况报告如下,为该病的诊断与治疗提供借鉴。
1 病例报告
1.1 临床资料 患者老年男性,62岁,因“体检发现右肾占位2月余”入院。患者无明显腰腹部疼痛,无尿频、尿急、尿痛、血尿等症状。入院后行双肾盆腔CT检查示:右肾实质不规则软组织肿块影,大小约13.0 cm×11.0 cm×8.3 cm,密度不均匀、边界不清,其内可见坏死及脂肪密度影,增强扫描示肿块呈明显不均匀强化,考虑右肾周巨大占位,见图1。实验室检查无明显异常。术前参考肿瘤体积大、增强呈明显强化、肿块内坏死等,考虑肿瘤来自肾周间叶组织恶性肿瘤的可能性大,但其中可见脂肪密度影,不排除外生性血管平滑肌脂肪瘤(AML)可能。患者一般情况可,无远处转移及其他手术禁忌证,故拟行经腰入路右肾肿瘤根治性切除术。
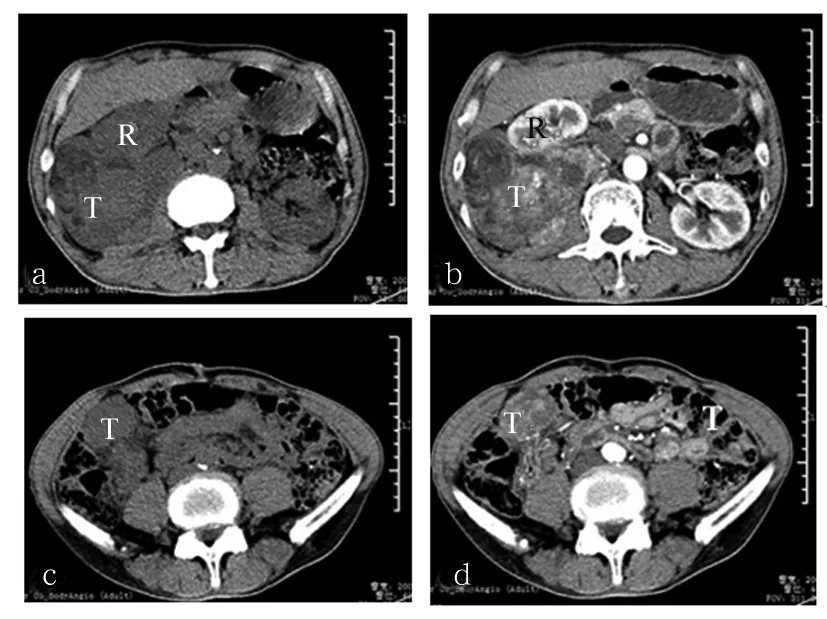
注:a、b示DDLS(T)压迫肾脏(R),但无肾实质缺损,肿瘤内可见坏死及脂肪密度影;b示增强后DDLS呈不均匀强化;c、d示肿瘤下极呈球形,临近回盲部腹膜。
图11例肾周DDLS患者肾脏CT表现
1.2 手术治疗经过 给予对症治疗后,在全麻下行经腰入路右肾肿瘤根治性切除术。术中见腹膜后肿瘤完全包裹右肾实质,体积巨大,肿瘤下方与腹腔内容物及腹膜粘连明显,遂行右肾及肿瘤联合切除术。予以分离阻断肾血管后,将全部肿瘤及右肾组织取出,术中切开肿瘤标本可见脂肪样组织。取肿瘤组织常规送病理。
1.3 术后病理结果 术后右肾肿瘤组织病理示肾周DDLS。病理显示:肿瘤组织呈肉瘤样包裹肾实质,大小约13.6 cm×12.0 cm,无明显包膜;切面呈灰白色,部分区域可见坏死,质软至韧,伴有象皮感,肿瘤下极包块呈圆形侵犯盲肠部腹膜。HE染色示肾周DDLS,其中去分化成分为多形性未分化肉瘤,高分化成分为高分化脂肪肉瘤,肿瘤侵犯肾脏被膜。免疫组化结果示:肿瘤标本周期素依赖性激酶4(CKD4)、p16阳性,Ki67阳性率30%,小鼠双微体蛋白2(MDM2)、CD34、CD68、脉络膜黑色素瘤(Melanoma)、S-100、平滑肌肌动蛋白(SMA)均阴性。根据病理免疫组化结果,术后明确诊断为右肾DDLS。
1.4 术后随访情况 患者术后未接受放化疗。术后随访6个月,肿瘤无复发或转移,患者肝肾功能等正常,一般情况良好。
2 讨论
DDLS最早由Evans在1979年提出,主要指高分化脂肪肉瘤移行为非脂肪源性梭形细胞或多形性肉瘤的混合型肿瘤,常发生于腹膜后,也可见于四肢、躯干和阴囊等部位[1]。目前关于其去分化机制研究尚未明确,大多数DDLS(90%)是原发瘤随着病程进展而发生去分化。该肿瘤好发于老年人,发病高峰为60~70岁,男女发病无性别差异[1,3]。DDLS多呈隐匿性生长,肿瘤质地软韧,表现为无痛性肿块,肿瘤体积进展可压迫胃肠道引起食欲不振、恶心、呕吐、腹痛、腹胀等症状,甚至压迫肾及输尿管引起肾积水,晚期可见体质量下降等恶病质表现,偶可因肿瘤破裂导致急腹症或休克等[3]。
随着影像学检查的不断发展,其对DDLS确诊具有重要临床意义,腹部超声可以确定肿瘤的部位、大小、囊实性、血管及其与邻近脏器的关系,CT则可进一步显示肿瘤的范围、边界,甚至其内液化、坏死、脂肪及钙化等改变,同时可指导制定手术方案。另外,少数学者曾提出超声引导下细针穿刺以提高诊断正确率,但笔者认为其可能造成肿瘤种植转移。本例术前综合考虑肿瘤体积及影像学表现,考虑肿瘤来源于右肾肾周间叶组织恶性肿瘤可能性大,但其中可见脂肪密度影,不排除外生性AML可能,故予以行手术治疗并经术后病理检查确诊。
在鉴别诊断方面,由于DDLS多位于肾周,故需要与肾脏肿瘤相鉴别。由于DDLS富含脂肪样组织,故与肾细胞癌鉴别难度不大。但同为脂肪样肿瘤,容易与体积较大的AML在影像学上混淆,两者临床鉴别诊断难度较大,因此DDLS需要与AML鉴别诊断。AML是肾脏常见的良性肿瘤,典型影像学检查可见肿瘤内脂肪影,但当AML表现为外生性生长时,也表现为与DDLS相同的肾周较大含脂性肿块,影像学鉴别较困难。而且,AML与DDLS的治疗方法截然不同,对于无症状的AML可密切随访,而肿块体积巨大有破裂出血倾向者可行肾动脉栓塞或肾部切术,术后预后良好[4];DDLS由于恶性程度高,预后差,则首选肿瘤全切辅助放化疗或靶向及免疫治疗等[5]。因此,术前针对DDLS和外生性AML的鉴别诊断就显得尤为重要。CT检查分辨率高、图像清晰,能反映腹膜后肿瘤的边界、范围以及坏死、囊性及钙化等病变,同时能准确分析肿瘤周围脏器和血管压迫移位等情况,可以作为腹膜后脂肪样肿瘤组织的首选诊断方法,也有助于术前评估及制定手术方案[6,7]。影像学上CT针对两者的鉴别诊断主要包括以下几个方面:①肾实质缺损:由于外生性AML起源于肾实质,因此既往研究报道78%~100%[8~10]的外生性AML可见肾实质缺损;而DDLS起源于腹膜后脂肪,虽与肾包膜紧贴,压迫推移但一般不侵犯肾脏,因此常无此征象[9,10],少数DDLS可因肿瘤侵犯肾实质、邻近囊肿及皮质瘢痕化等因素出现肾实质缺损[11]。②肿瘤与血管的关系:由于起源不同,AML常可见肿块内血管扩张、肾动脉分支供血及血管穿过肾实质三个征象[8~10],部分可见典型血管桥接征象[10,12],相反这些征象在DDLS中极少见到。③肿瘤内出血:Woo等[10]和Wang等[8]相继报道28%~50%的AML可见肿瘤内出血,但脂肪肉瘤中未见1例;同时与脂肪肉瘤比较,AML患者年龄轻,且肿瘤体积较小;另外,Woo等[10]报道脂肪肉瘤发生钙化和肿瘤内非脂肪成分结节概率(31%)较AML(7%)高,且钙化多提示预后不良。在本例中,CT显示右肾无肾实质缺损及血管征象符合上述表现,验证了上述鉴别方法的可适用性,但肿块无钙化表现。因此,肿瘤钙化这一鉴别征象仍需进一步研究考证。
DDLS的病理学特征与其他脂肪瘤、肉瘤及非肿瘤性脂肪组织不同。DDLS肿瘤组织中MDM2和CDK4表达阳性,阳性率为75%~95%[13,14],提示该两项指标具有重要的鉴别诊断价值。研究发现,DDLS中多数存在染色体12q13~15区域的异常扩增,该染色体区域则主要包括MDM2、HMGA2、CDK4等肿瘤基因[14,15],MDM2及HMGA2基因异常扩增能通过影响p53基因进而诱导肿瘤形成,同时CDK4则可以通过抑制RB1基因促进DDLS肿瘤发生及进展。Ricciotti等[14]对47例DDLS患者进行预后分析,发现DDLS中CDK4和MDM2基因扩增水平与患者预后明显相关,认为MDM2及CDK4表达升高提示患者预后较差。因此,今后对该两个位点的靶向治疗可能成为DDLS临床研究新的方向,以改善患者长期预后。本例患者中,CDK4阳性、MDM2阴性,可能与病例数量少有关。因此,后续研究可能需要进一步提高样本数量来分析DDLS中蛋白表达情况差异。
肾周DDLS临床治疗首选外科手术切除,由于瘤体体积巨大且与周围解剖关系复杂,故实际临床中较难实现手术切除病缘阴性。早期研究认为,腹膜后肿瘤术后复发率与切缘阳性无关[16]。但随着对该肿瘤研究的深入,部分学者建议扩大手术范围,联合切除毗邻脏器,如肾、结肠、腹部等[5,17,18]。本例中,由于肿瘤侵犯肾周筋膜,术中见肿瘤及肾脏粘连紧密,肿瘤侵犯肾周筋膜,无法成功施行解剖分离,故予以行右肾及肿瘤联合切除,术后病理亦证实肿瘤侵犯肾周筋膜。
虽然2012版美国国立综合癌症网络(NCCN)指南推荐脂肪肉瘤术前可先行放化疗、降低肿瘤分期后再行手术治疗,但关于其术前及术后放化疗临床获益仍存在争议。研究报道,腹膜后DDLS术前应用放疗患者总体生存率无明显改善[18];同时,另有部分研究认为腹膜后脂肪肉瘤的术后放化疗有助于控制术后复发和肿瘤进展,但多数患者无法获得明显生存获益。DDLS预后主要与解剖部位、病理分型及治疗方法相关,其术后复发率高,一旦患者术后发生复发或远处转移,多数学者仍倾向于再次行手术切除,以延长生命、缓解临床症状。本例中,患者术后未接受放化疗,随访6个月患者并未发生肿瘤复发或转移,表明针对此例DDLS,行根治性肾脏及肿瘤切除术效果可。当然,本研究随访时间较短且为单个病例报告,治疗远期效果及预后随访需进一步研究探讨。
通过对本例肾周巨大DDLS的诊治,我们认为在诊断、治疗方面有几点需值得注意:①DDLS术前影像学可通过肾实质缺损、肿瘤血管征象等与外生性AML鉴别诊断,但部分不典型DDLS病例仍需进一步研究探讨。②DDLS遗传及病理学特点主要包括12q13~15区域异常扩增及该位置MDM2与CDK4表达增高,该两者可以作为诊断及预后指标,甚至未来可作为DDLS靶向治疗的靶标。③肾周DDLS首选治疗方法是手术切除,但是否需要行联合脏器切除目前仍无定论,手术过程中需根据肿瘤及其周围器官侵犯情况等决定;我们认为联合脏器切除能提高肿瘤完全切除的可能,应当值得推广。
