抑制miR-630表达对宫颈癌细胞紫杉醇敏感性的影响及机制
2018-12-04丁鑫王乾印马亮亮
丁鑫,王乾印,马亮亮
(青海红十字医院,西宁810000)
宫颈癌是女性生殖系统中最常见的恶性肿瘤。有统计数据表明,全世界每年确诊宫颈癌的人数达50万,死亡者更是高达15万,严重威胁女性健康[1]。目前,综合手术和放疗为主、化疗为辅的治疗措施是宫颈癌的主要治疗方案[2]。紫杉醇(PTX)是临床应用较广泛的宫颈癌化疗药物,但长期用药使宫颈癌细胞对PTX的敏感性降低导致耐药[3]。肿瘤耐药性产生与细胞凋亡异常有关,凋亡蛋白酶活化因子(APAF-1)、蛋白聚腺苷二磷酸核糖聚合酶(PARP)、Caspase1、Caspase3均为凋亡相关蛋白。因此,探究肿瘤细胞对PTX的耐药机制并提高其敏感性是临床化疗亟待解决的重要问题。微小RNA(miRNAs)是非编码RNA的一种,由18~25个核苷酸组成,通过与靶基因的3′非翻译区(UTR)结合调控基因表达[4]。研究发现,miRNAs异常表达与恶性肿瘤密切相关[5],并且miRNAs可通过调节相关靶蛋白的表达影响肿瘤细胞的抗药性[6,7]。有研究表明,在卵巢癌细胞中miRNA-630(miR-630)表达量明显上调[8],抑制其表达能够增加卵巢癌细胞对化疗药物的敏感性[9]。2016年1月~2017年12月,我们通过抑制miR-630在宫颈癌细胞中的表达,观察是否会对宫颈癌细胞PTX敏感性产生影响,并探讨其机制。现报告如下。
1 材料与方法
1.1 细胞株及主要试剂 宫颈癌PTX耐药细胞株HeLa-PTX,购于中国科学院上海生命科学研究院细胞库;PTX购于美国Sigma公司。胎牛血清(FBS)、RPMI-1640培养基及青霉素/链霉素(P/S),均购于美国Gibco公司;miR-630小干扰RNA(siRNA)质粒、对照空载质粒,均购于上海吉凯基因化学技术有限公司;四甲基偶氮唑盐(MTT),购于美国Ameresco公司;细胞凋亡试剂盒,购于上海碧云天公司。
1.2 实验方法
1.2.1 细胞培养与分组转染 将HeLa-PTX细胞置于5% CO2的37 ℃细胞培养箱中,用含有10% FBS和1% P/S的RPMI-1640培养基培养、传代。将HeLa-PTX细胞分为3组,抑制组和空载组根据Lipofectamine RNAi MAX试剂(Invitrogen公司)转染说明书分别转染miR-630 siRNA质粒、对照空载质粒30 nmol/L,空白对照组不转染,48 h后收集细胞。
1.2.2 细胞PTX敏感性观察 采用MTT法。将各组细胞传代接种于96孔培养板(8×103/孔),24 h后加入终浓度为0、3、30、60、120、250、500、1 000 nmol/L的PTX,每个浓度设3个复孔。作用24 h后,根据MTT试剂盒说明书操作,在酶标仪上检测各孔在490 nm的吸光度,测算细胞存活率。重复3次实验。细胞存活率(%)=实验组吸光度/对照组吸光度×100%;使用SPSS统计软件的概率单位法(PROBIT)确定半数抑制浓度(IC50),以此判断细胞对PTX的敏感性。
1.2.3 细胞miR-630和APAF-1 mRNA检测 采用实时荧光定量PCR法。根据总RNA TRIzol试剂盒(Bioline公司)操作说明提取各组细胞的总RNA,并根据说明书提供的PCR系统将RNA逆转成cDNA;引物序列由上海捷锐公司合成,使用Master Mix(Applied Biosystems公司)检测相关基因的相对表达水平。APAF-1引物序列上游为5′-TGGAATGTCTCAAACGGTGA-3′,下游为5′-AAGCATTTTGCCATCTGGAG-3′;内参β-actin引物序列上游为5′-TGACGTGGACATCCGCAAAG-3′,下游为5′-CTGGAAGGTGGACAGCGAGG-3′。miR-630引物序列上游为5′-GCGGCAGACACCACCAC-3′,下游为5′-GGCCGCTGCTATCGCTACTGAG;内参U6引物序列上游为5′-CTCGCTTCGGCAGCACA-3′,下游为5′-AACGCTTCACGAATTTGCGT-3′;采用2-ΔΔCt方法表示APAF-1 mRNA和miR-630相对表达量。
1.2.4 细胞凋亡率测算 采用流式细胞术Annexin V/PI双标法。将各组细胞种于6孔板,根据FITC膜联蛋白V凋亡检测试剂盒(BD Biosciences公司)说明书检测凋亡细胞,并用BD FACS Diva6.2软件分析细胞凋亡率。重复3次。
1.2.5 细胞PARP、Caspase1、Caspase3检测 采用Western blotting法。用冰冷的RIPA缓冲液(Thermo公司)裂解细胞。离心机降温至4 ℃,以13 000r/min离心40 min;吸出上清液中的蛋白质,并用10% SDS-PAGE分离。将蛋白质转移到聚偏二氟乙烯(PVDF)膜(Millipore公司),用5%脱脂乳-TBST在室温封闭30 min。一抗4 ℃孵育过夜后,与HRP标记的山羊抗兔二抗在室温孵育1 h。根据 Western BrightTMECL蛋白质印迹检测试剂盒(Advansta公司)说明书配制显色液显色。采用Bio-Rad公司图像分析软件,以目的蛋白与对应内参蛋白显色条带累积光密度比值表示目的蛋白的相对表达量。
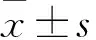
2 结果
2.1 各组细胞PTX IC50比较 抑制组、空载组、空白对照组PTX IC50分别为(35.61±2.87)、(142.57±3.63)、(144.31±2.42)nmol/L,抑制组PTX IC50低于NC组(t=-40.035,P=0.000)和空白对照组(t=-50.151,P=0.000)。
2.2 各组细胞miR-630和APAF-1 mRNA表达比较 与空载组及空白对照组比较,抑制组miR-630表达量降低(P=0.000),而APAF-1 mRNA表达量增加(P=0.000)。见表1。

表1 各组细胞miR-630和APAF-1 mRNA相对表达量比较
注:与抑制组比较,*P<0.05。
2.3 各组细胞凋亡率比较 抑制组、空载组、空白对照组细胞凋亡率分别为19.60%±2.56%、10.20%±1.08%、8.00%±1.53%,抑制组细胞凋亡率高于空载组(t=7.565,P=0.000)和空白对照组(t=8.697,P=0.000)。
2.4 各组细胞PARP、Caspase1、Caspase3相对表达量比较 与空载组及空白对照组比较,抑制组PARP、Caspase1、Caspase3相对表达量增加(P均=0.000)。见表2。

表2 各组细胞PARP、Caspase1、Caspase3相对表达量比较
注:与抑制组比较,*P<0.05。
3 讨论
宫颈癌是女性最常见的恶性肿瘤之一,严重威胁女性健康,宫颈癌的治疗方案一直备受瞩目。晚期宫颈癌患者出现对化疗药物耐受,是导致病死率增加的主要原因。因此,探究宫颈癌细胞对化疗药物耐受的作用机制,提高化疗药物敏感性具有重要的临床意义。
PTX是一种新型抗微管类药物,在恶性肿瘤化疗中应用广泛。PTX通过与β微管蛋白N端的氨基酸结合,破坏氨基酸的平衡,促进微管蛋白聚合,稳定微管,抑制细胞有丝分裂,阻断细胞周期,并诱导细胞凋亡[10]。有研究报道,miRNAs作为癌基因或抑癌基因参与癌症的发生发展,甚至能影响癌细胞对化疗药物的耐受性[11,12]。近年来,miR-630是肿瘤研究领域的热门miRNAs之一[13]。研究显示,miR-630高表达的肾细胞癌患者生存率降低[14],miR-630高表达胃癌患者的预后更差[15];Nam等[8]发现,卵巢癌细胞中miR-630表达明显上调,抑制miR-630表达能增加卵巢癌细胞对化疗药物的敏感性[9]。本研究采用siRNA技术抑制HeLa-PTX细胞中miR-630表达后,宫颈癌细胞对PTX的敏感性增加。PARP是一种关键的DNA修复酶,参与DNA损伤应答,并能调控细胞凋亡,维持基因组稳定[16]。在帕金森小鼠模型中,Caspase1表达水平显著增加[17]。王宇锋等[18]研究表明,诱导细胞凋亡能上调Bax、Caspase3和PARP1蛋白表达。本研究中,抑制HeLa-PTX细胞中miR-630表达,可使PARP、Caspase1、Caspase3基因表达均增强,细胞凋亡率升高。由此推测,抑制miR-630表达可促进HeLa-PTX细胞凋亡,从而提高宫颈癌细胞对PTX的敏感性。Zou等[19]研究也证实,降低miR-630表达可抑制细胞增殖、侵袭并增强卵巢癌化疗敏感性。
研究发现,细胞凋亡减少是肿瘤耐药性产生的基础,APAF-1蛋白是线粒体凋亡途径中的关键蛋白酶,线粒体介导的内源性凋亡通路是细胞凋亡的主要形式,APAF-1是细胞凋亡的核心组成部分[20]。研究表明,在化疗不敏感的肿瘤细胞中,APAF-1表达缺失或低表达[21];而增加APAF-1表达,可增强肿瘤细胞的化疗敏感性[22]。研究发现,APAF-1在HeLa-PTX细胞中表达水平低于HeLa细胞,提示APAF-1表达降低可能与宫颈癌细胞耐药性有关。本研究在抑制HeLa-PTX细胞miR-630表达后,细胞内APAF-1基因表达增加,提示miR-630和APAF-1基因表达之间存在相关性。miRNAs通过参与调节基因表达,在细胞多种生理病理过程中发挥关键作用。本研究推测,miR-630可能直接或间接地参与了APAF-1基因调控,可为miR-630与宫颈癌化疗敏感性的研究提供新思路,但具体调节机制还有待进一步研究。
综上所述,在宫颈癌耐药细胞株(HeLa-PTX)中miR-630呈高表达状态、APAF-1呈低表达状态,抑制miR-630表达可诱导细胞凋亡以及促凋亡蛋白表达,而降低APAF-1基因表达。这提示抑制miR-630表达能增强宫颈癌细胞对PTX的敏感性,可能是通过调节APAF-1基因表达实现的,miR-630具有作为逆转宫颈癌耐药靶标的潜能。
