双孢蘑菇发酵液还原糖和总糖的含量测定*
2018-12-01曾志恒施肖堃戴建清
曾志恒,曾 辉,2,程 翊,杨 雷,施肖堃,戴建清**
(1.福建省农业科学院食用菌研究所,特色食用菌繁育与栽培国家地方联合工程研究中心,福建 福州 350014;2.吉林农业大学食药用菌教育部工程研究中心,吉林 长春 130018)
近年来,食用菌工厂化生产发展迅速,液体菌种被广泛地应用于工厂化生产金针菇(Flammulina velutiper)、杏鲍菇(Pleurotus eryngit)等食用菌[1-2]。液体菌种具有培养时间短、发菌快、菌龄整齐一致、接种方便等优点,有利于食用菌规模化、工厂化生产。国内外食用菌研发机构和生产企业加大了对液体菌种的投入和研发力度[3]。2013年,曾志恒等[4]对双孢蘑菇液体菌种进行研究,将液体菌种作为原种扩繁生产栽培种取得良好的效果。液体培养基中的碳源是供给菌丝体代谢活动能量的营养物质,用作代谢活动能量的碳源物质主要为糖类,其中以蔗糖和葡萄糖为主[5]。菌丝体的生长与糖代谢有密切关系。因此,通过测定发酵过程中培养液的还原糖和总糖含量变化,可了解菌丝体的生长情况。据文献[6]报道,有关总糖和还原糖含量的测定方法有多种,分为分光光度法、气相色谱法、液相色谱法、旋光法等。其中,3,5-二硝基水杨酸(DNS) 比色法因具有准确性高、重现性好等特点被广泛采用。在双孢蘑菇发酵液糖含量的测定中,未见使用DNS法测定还原糖和总糖含量的报道。本研究采用DNS法测定双孢蘑菇发酵培养液还原糖和总糖含量,确保了试验的精确度,以期获得可靠的数据,为双孢蘑菇液体菌种的生产实践提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
供试菌株为双孢蘑菇 (Agaricus bisporus)As2796。
1.1.2 液体培养基配方
液体培养基配方参考文献[7]。
1.1.3 主要仪器
UV-1300紫外分光光度计,上海美析仪器有限公司;SH420石墨消解仪,济南海能仪器股份有限公司;HH-4恒温水浴锅,常州凯航仪器有限公司。
1.1.4 试剂
无水葡萄糖、浓盐酸、氢氧化钠等,分析纯,购自西陇化工股份有限公司。
葡萄糖标准液1.0 mg·mL-1,配制方法参照参考文献[8]。
DNS试剂,配制方法参照参考文献[9]中DNS试剂1。
1%酚酞指示剂:称取酚酞1.0 g,溶于95%乙醇,并用95%乙醇稀释至100 mL。
1.2 试验方法
1.2.1 检测波长的确定
精密吸取1.0 mg·mL-1葡萄糖标准溶液和去离子水各1.0 mL,分别加入到25 mL容量瓶中,补水至2.5 mL,各加入DNS试剂2.5 mL,混合均匀后,沸水浴加热5 min,迅速流水冷却,加水定容至25 mL,将葡萄糖显色液,去离子水(空白),DNS试剂,去离子水(空白),葡萄糖显色液,DNS试剂(空白)3组溶液,分别在波长为450 nm~600 nm范围内测定吸光度值。
1.2.2 显示剂用量的确定
精密吸取1 mL葡萄糖标准溶液,分别加入到10个25 mL容量瓶中,补水至2.5 mL,分别加入0、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL、3.5 mL、4.0 mL、4.5 mL、5.0 mL DNS试剂,混合均匀后,沸水浴加热5 min,迅速流水冷却,定容至25 mL,在540 nm波长下测定吸光度值。
1.2.3 加热时间的确定
精密吸取1 mL葡萄糖标准液,分别加入到10个25 mL容量瓶中,补水至2.5 mL,各加入2.5 mL DNS试剂,混合均匀后,分别在沸水浴中加热1 min、2 min、3 min、4 min、5 min、6 min、7 min、10 min、15 min、20 min,迅速流水冷却,定容至25 mL,在540 nm波长下测定吸光度值。
1.2.4 标准曲线的制作
精密吸取葡萄糖标准溶液0、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL、1.8 mL,分别置于25 mL容量瓶中,补水至2.5 mL,加入DNS试剂2.5 mL,混合均匀后,沸水浴加热5 min,迅速流水冷却,定容至25 mL,在540 nm波长下测定吸光度值。空白调零,以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.5 双孢蘑菇液体摇瓶培养
双孢蘑菇As2796菌种活化和液体摇瓶培养方法参考文献[7]。
1.2.6 发酵液还原糖供试样品
双孢蘑菇经摇瓶发酵培养10 d,将不同三角瓶中发酵液和菌丝体,分别经冷冻高速离心机(8 000 r·min-)1离心10 min,收集上清液,即得发酵液还原糖供试样品,4℃保藏、备用。
1.2.7 发酵液总糖供试样品
发酵液总糖供试样品的制备参照王鹏亭等[8]方法进行改良。用移液管精密吸取发酵液5 mL,置于25 mL容量瓶中,加入5 mL的6 mol·L-1HCl溶液,封口,于消解仪中100℃加热30 min,流水冷却至室温,加1滴酚酞指示剂,用6 mol·L-1NaOH溶液滴定至溶液初呈淡红色,加水定容至25 mL,摇匀,即得发酵液总糖供试样品。
1.2.8 样品测定
(1) 还原糖含量的测定
精密移取步骤1.2.6所制备的还原糖供试样品1.0 mL,于25 mL容量瓶中,定容至25 mL。然后精密移取稀释后还原糖供试样品溶液2.5 mL于25mL容量瓶中,加入DNS试剂2.5 mL,混匀后沸水浴加热5 min,流水冷却,定容至25 mL,以去离子水为空白,于540 nm处测定吸光度值,根据标准曲线,计算发酵液中还原糖的质量。
(2) 总糖含量的测定
精密移取步骤1.2.7所制备的还原糖供试样品5.0 mL,于50 mL容量瓶中,定容至50 mL。再精密移取稀释后总糖供试样品溶液1.0 mL于25 mL容量瓶中,补水至2.5 mL,加入DNS试剂2.5 mL,混匀后沸水浴加热5 min,流水冷却,定容至25 mL,以去离子水为空白,于540 nm处测定吸光度值,根据标准曲线,计算发酵液中总糖的质量。
2 结果与分析
2.1 测定波长的选择
根据文献[9]报道,DNS法测定波长有490 nm、520 nm、540 nm等,考虑到显色剂、紫外分光光度计相关因素的影响,为了进一步确定本研究DNS法在测定还原糖含量中的最佳波长,在波长为450 nm~600 nm范围内进行扫描,结果如图1所示。

图1 葡萄糖溶液吸收光谱Fig.1 Absorption spectrum of glucose solution
由图1可知,葡萄糖显色液-DNS试剂(空白)曲线最大吸收峰处的波长为490 nm,为了提高检测的灵敏度,通常选取最大吸收峰处的波长进行测定,但从DNS试剂-水(空白)曲线可知,在490 nm波长下DNS也具有一定的吸光度值。在试验过程中,空白和待测液中DNS的添加量相同,但显色后部分DNS会与待测液中的还原糖发生反应,使得测量吸光度值时,待测液中DNS含量小于空白中DNS含量,在490 nm下对测定结果造成干扰。同时,参考葡萄糖显色液-水(空白)曲线,可知干扰现象在波长小于540 nm的情况下一直很显著。故将540 nm作为本试验确定的检测波长。
2.2 DNS试剂用量对吸光度值的影响
在不影响吸光度值的前提下取最小体积DNS试剂为最佳用量,取不同体积的DNS试剂进行试验,结果如图2所示。
图2 不同DNS试剂用量的吸光度值测定Fig.2 Absorption value determination with different DNS dosage
从图2可以看出,当DNS试剂用量大于2.5 mL,吸光度值基本保持不变。因此将2.5 mL作为本试验DNS试剂用量。
2.3 加热时间对吸光度值的影响
葡萄糖标准液与DNS试剂分别按照不同时间在沸水浴中加热,结果见图3。
图3 不同沸水浴加热时间的吸光度值测定Fig.3 Absorption value determination with different boiling water bath time
由图3可知,随着沸水浴加热时间的延长,吸光度值逐渐变大,但在5 min之后吸光度值趋于稳定,说明DNS与还原糖的显色反应基本完成。因此,确定5 min为最佳沸水浴加热时间。
2.4 标准曲线
以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线,如图4所示。
图4中的标准曲线表明,在测定范围内的葡萄糖含量与相应的吸光度值之间呈良好的线性关系,显色灵敏、稳定,其回归方程为:y=0.276x-0.0043,R2=0.9994。
2.5 方法学考察
图4 葡萄糖标准曲线Fig.4 Standard curve of glucose
2.5.1 精确度试验
分别取同一锥形瓶内的发酵液还原糖、总糖供试样品溶液,按照样品测试方法连续测定6次,记录吸光度值,其吸光度值如表1所示。
表1 精确度试验结果Tab.1 Results of precision test
从表1可以看出,还原糖和总糖的相对标准偏差RSD分别为0.509%和0.684%,说明分光光度计精确度良好。
2.5.2 稳定性试验
分别取同一锥形瓶内的发酵液还原糖、总糖供试样品溶液,按样品测定方法测定,显色反应完成后每隔10 min测定1次,结果见表2。
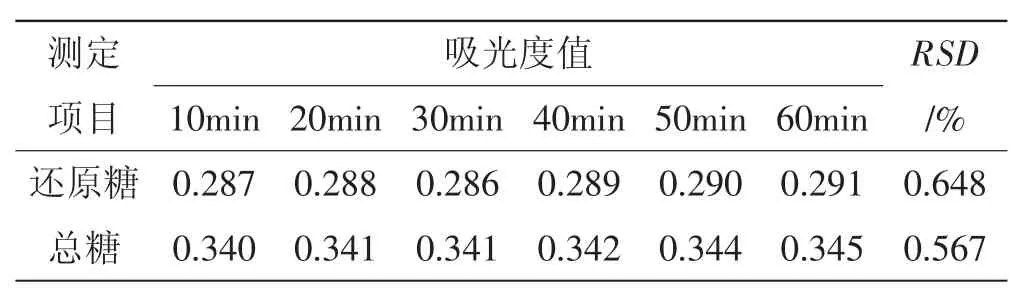
表2 稳定性试验结果Tab.2 Results of stability test
由表2可知,还原糖和总糖供试样品在0~1 h内吸光度值波动较小,其相对标准偏差RSD分别为0.648%和0.567%,说明发酵液还原糖、总糖供试样品溶液经显色反应后在1 h内都是稳定的。
2.5.3 加样回收率试验
3批次双孢蘑菇发酵液按供试样品溶液制备方法制备还原糖、总糖供试样品溶液,精确加入无水葡萄糖对照品,按样品测定方法分别测定各组样品溶液加样前后还原糖和总糖吸光度值,根据葡萄糖标准曲线,计算还原糖和总糖的含量、回收率,试验结果见表3。回收率(P)公式为:
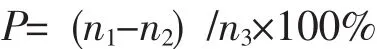
式中:n1表示实测量;n2表示样品量;n3表示加样量。
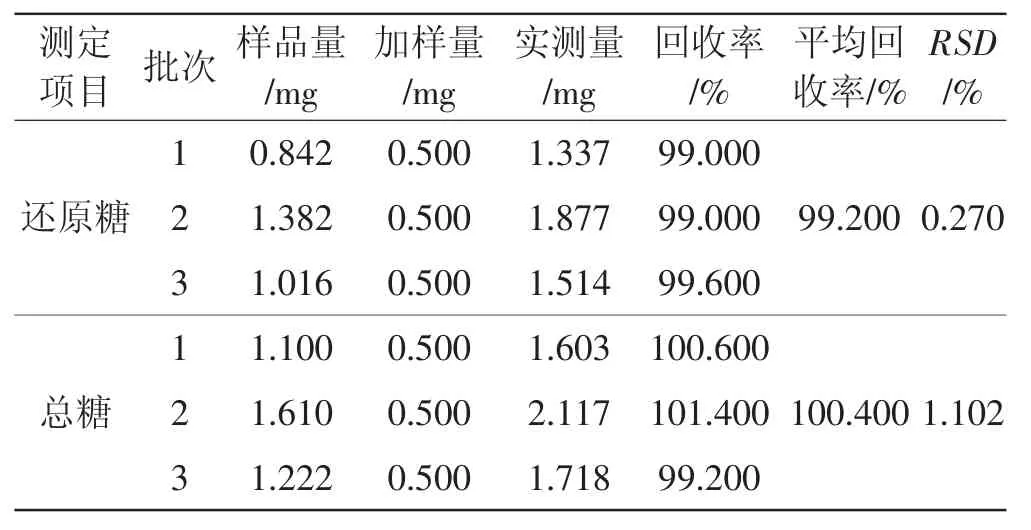
表3 样品加样回收率试验结果Tab.3 Results of recovery test(n=3)
由表3可知,还原糖、总糖供试样品溶液的平均加样回收率分别为99.2%和100.4%,其RSD分别为0.270%和1.102%。这表明该方法中还原糖、总糖的回收性良好。
2.5.4 发酵液总糖和还原糖含量的测定
取3批次双孢蘑菇发酵液,采用已建立的样品测定方法,测定还原糖和总糖含量,根据葡萄糖标准曲线、还原糖样品稀释10倍和总糖样品稀释50倍,分别计算发酵液中还原糖和总糖含量,具体结果见表4。

表4 发酵液还原糖和总糖测定结果Tab.4 Results of determination of reducing sugar and total sugar content in fermentation broth
由表4可知,3批次的双孢蘑菇发酵液还原糖含量范围 8.42 mg·mL-1~13.82 mg·mL-1,总糖含量范围55.00 mg·mL-1~80.50 mg·mL-1。
3 讨论
本研究首次建立DNS法同时测定双孢蘑菇发酵培养液还原糖和总糖含量,然而在还原糖含量的测定过程中,最佳波长的确定可能受到仪器性能、灵敏度、试验样品和DNS显色剂等多种因素的影响[6]。本研究通过试验验证在碱性条件下DNS被还原糖还原生成的氨基化合物在490 nm波长下虽具有最大吸光度值,但在此波长下DNS也具有一定的吸光度值,对测定结果干扰严重,这与赵凯等[9]结论相似。通过研究DNS法测定双孢蘑菇发酵培养液还原糖和总糖含量的影响因素,确定DNS试剂用量为2.5 mL,沸水浴加热时间为5 min,检测波长为540 nm。该方法具有方便快捷、准确、低成本等优点,可准确测定双孢蘑菇发酵培养过程中发酵液还原糖和总糖含量变化,为液体菌种的生产实践提供数据支撑。
