皱瘤海鞘抗人肺癌A549细胞组分的分离纯化及化学成分分析
2018-11-29毛楷林余作挺周海龙
毛楷林,林 芳,徐 腾,余作挺,周海龙*
(海南大学热带农林学院,海南 海口 570228)
肿瘤是人类健康的头号杀手之一,调查表明每个人一生中患癌症的机率为22%[1]。多年来研究人员对肿瘤开展了广泛的研究,但其病因尚未完全确定。而现有的肿瘤治疗方法多有较大的副作用,因此寻找新型药物以及新的药物靶点是现阶段研究人员的主要工作之一。在众多肿瘤中,肺癌是最常见恶性肿瘤之一,尤其在工业化程度较高的地区,空气污染情况严峻,肺癌发病率呈现逐年上升趋势。据世界卫生组织国际癌症研究署估计,2008年全球约有161万新发肺癌病例,死亡138万 例,居恶性肿瘤之首[2]。而在我国,肺癌发病率及死亡率也居首位,并且呈现逐年上升趋势[3-4]。
海鞘是一种脊索动物,广泛分布于各大海域,品种繁多、形状各异,并且在韩国、日本等国被作为一种风味食物。皱瘤海鞘是中国南海的优势种,繁殖高峰期间密度可达到2 225 个/m3[5]。近年来对于海洋天然产物的大量研究表明,海鞘体内存在大量的具有多种生物活性的天然物质,这些物质显示出多种多样的生物活性,例如抗肿瘤、抗菌、抗病毒、抗氧化、抗炎症、抑制血管生成等[6-8],其中尤其以抗肿瘤活性最为突出[9-11],目前有几种成分已经通过或正在进行临床实验,2015年美国食品药品监督管理局批准在美国上市的抗肿瘤药物曲贝替定(Trabectedin)就是从加勒比海鞘(Ecteinascidia turbinata)体内提取得到[12],用于不能手术切除或特定的晚期软组织肉瘤的治疗。皱瘤海鞘由被囊及内脏团两部分组成,被囊较为坚韧且具有韧性,能够抵御环境的变化;内脏团呈现橙红色,柔软且富含水分。以往多将海鞘作为一个整体来研究,而本课题组前期的结果表明,海鞘被囊与内脏团提取物的生物活性差异很大,所含的物质成分也迥然不同[13],因此本实验将海鞘分为被囊及内脏团两个部分进行研究。
海鞘目前被认为是一种污损生物,不但不具有经济价值,还与水产养殖动物竞争养分,对水产养殖造成损失。因此,通过对皱瘤海鞘进行系统的开发研究,生产出具有高附加值以及广阔市场前景的产品,可以极大地减少海鞘资源的浪费,同时增加水产养殖户的收入。本实验通过现代提取及纯化技术对皱瘤海鞘不同部位进行提取,得到具有较高抗肿瘤活性的皱瘤海鞘组分,为进一步开发海鞘功能产品提供理论依据。
1 材料与方法
1.1 材料与试剂
皱瘤海鞘于2016年9月采自海南省陵水县黎安镇港口,根据《中国海洋生物图集》(第七册)对其种类鉴定为皱瘤海鞘(Styela plicata)。人肺癌A549细胞由海南大学热带农林学院分子药理学实验室提供。
DMEM培养基、胎牛血清、0.25%胰酶-乙二胺四乙酸、青霉素链霉素混合液 美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;四氮甲唑蓝(thiazolyl blue,MTT) 美国Amersco公司;Annexin V-FITC/PI细胞凋亡检测试剂盒 杭州联科生物技术股份有限公司;柱层析硅胶、薄层层析硅胶板青岛海洋化工厂;其他有机溶剂(均为分析纯) 西陇化工股份有限公司。
1.2 仪器与设备
R210旋转蒸发仪 瑞士Buchi公司;Multiskan FC酶标仪、HEPA class 100 CO2培养箱 美国Thermo Scientific公司;H1850R低温高速离心机 湖南湘仪实验室仪器开发有限公司;SCIENTZ-10N多歧管普通型冷冻干燥机 宁波新芝冻干设备股份有限公司;FACS-CANTO II型流式细胞仪 美国BD公司;CKX41倒置显微镜 日本Olympus公司;DM6000荧光显微镜德国LEICA公司。
1.3 方法
1.3.1 样品前处理
将皱瘤海鞘样品用自来水洗净,去除表面附着物,剪开被囊取出内脏团,将被囊与内脏团分别于冷冻干燥机中冻干72 h后放入粉碎机中粉碎至40 目,粉碎过程中控制温度不超过50 ℃。
1.3.2 甲醇提取物的制备
分别称取皱瘤海鞘被囊粉与内脏团粉各15 g于250 mL锥形瓶中,加入150 mL甲醇,放入搅拌子,将锥形瓶放于磁力搅拌器上室温搅拌48 h。用0.45 μm有机系滤膜过滤,将上清液收集于另一玻璃瓶中。向滤渣中再次加入100 mL甲醇,同法处理2 次。合并3 次提取液。用旋转蒸发仪于40 ℃下减压蒸发至浸膏质量不再变化,将被囊浸膏和内脏团浸膏分别收集至5 mL离心管中,放入4 ℃冰箱备用。
1.3.3 硅胶柱层析分离
在43 cm×3 cm的层析柱内加入100 g柱层析硅胶,采用湿法装柱,之后将2 g左右的海鞘被囊甲醇提取物(tunic methanol extract,TME)或内脏团甲醇提取物(visceral methanol extract,VME)与硅胶填料拌匀上柱,按照如下顺序洗脱:100%(体积分数,下同)正己烷;75%正己烷-二氯甲烷溶液;50%正己烷-二氯甲烷溶液;25%正己烷-二氯甲烷溶液;100%二氯甲烷;75%二氯甲烷-甲醇溶液,50%二氯甲烷-甲醇溶液,25%二氯甲烷-甲醇溶液;100%甲醇。每份洗脱液300 mL,在洗脱过程中用薄层色谱检测是否已经洗脱完全,如果未洗脱完全,仍然可以继续洗脱。将薄层色谱检测为成分相同的洗脱液合并,40 ℃减压浓缩至干,称质量。
1.3.4 肿瘤细胞培养
A549细胞加入含有质量分数10%胎牛血清、1%双抗的DMEM培养基中,放置于37 ℃、5%二氧化碳的细胞培养箱中培养,每周传代2 次,取对数生长期的细胞进行实验,传代次数不超过15 次。
1.3.5 MTT法检测细胞相对存活率
用移液器将细胞悬液加入表面处理过的96 孔细胞培养板中,每孔100 μL。细胞贴壁后去除培养液,加入样品溶液,放入培养箱48 h。向样品溶液中加入20 μL MTT溶液(5 mg/mL,用磷酸盐缓冲液(phosphate buffered saline,PBS)配制),放入细胞培养箱孵育4 h。倒去液体,每孔加入150 μL DMSO,在室温、避光条件下轻柔振荡培养板1 h。用酶标仪测定490 nm波长处OD值。实验设A549细胞阴性对照组、阳性药物对照组以及调零组。阳性药物对照为5-氟尿嘧啶(5-fluorouracil,5-FU),质量浓度20 μg/mL;阴性对照加入与最大供试药物相同质量浓度的DMSO(药物溶剂),细胞数量与其他孔相同;调零孔加入相同体积的DMEM培养基(无细胞)。实验组样品每个质量浓度(0(空白组)、25、50、75、100、200、300、400 μg/mL)设5 个平行孔。96 孔板进行实验前在边缘孔都加入100 μL的无菌PBS,防止产生边缘效应。细胞相对存活率按式(1)计算。
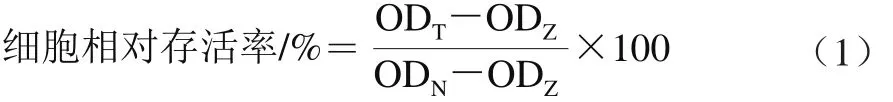
式中:ODT为样品孔OD值;ODZ为调零孔OD值;ODN为阴性对照孔OD值。
1.3.6 半数抑制浓度的测定
用无血清细胞培养基配制质量浓度从低到高的6 种样品溶液(31.25、62.50、125.00、250.00、500.00、1 000.00 μg/mL),并设阴性对照组(加入与样品溶液最大质量浓度相同的DMSO(药物溶剂),细胞数量与其他孔相同),孵育细胞24 h,用1.3.5节MTT法检测细胞活力,并用GraphPad prism 6.0软件计算半数抑制浓度。
1.3.7 倒置相差显微镜观察细胞形态
将A549细胞置于6 孔细胞培养板中培养,加入不同质量浓度(80、160、320 μg/mL)的样品溶液,同1.3.6节设置阴性对照组,培养48 h后将培养板置于倒置相差显微镜下观察细胞形态。
1.3.8 细胞凋亡观察与分析
细胞经过样品(质量浓度0(空白组)、80、160、320 μg/mL)处理48 h后,使用Annexin V-FITC/PI双染细胞凋亡检测试剂盒检测A549细胞的凋亡。首先用不含乙二胺四乙酸的细胞消化液消化处于对数生长期的A549细胞,收集(1×106)~(3×106)个细胞,用预冷的PBS离心洗涤两次,弃上清液。加入500 μL凋亡阳性质控液重悬,置于冰上孵育30 min。用预冷PBS离心洗涤,弃上清液。加入适量4 ℃预冷的结合缓冲液重悬,并加入数量相同且未经处理的活细胞与之混合。加入4 ℃预冷结合缓冲液补充至1.5 mL,等分成3 管,其中一管为空白对照,另两管为单染管。单染管分别加入5 μL Annexin V-FITC或10 μL PI,室温避光孵育5 min。在流式细胞仪上,用空白管调节前向散射光、侧向散射光和荧光通道的电压,并在此电压条件下用单染管调节荧光通道的补偿。离心收集(1×105)~(5×105)个细胞,取500 μL结合缓冲液重悬细胞。每管加入5 μL Annexin V-FITC和10 μL PI。轻柔漩涡混匀后,室温避光孵育5 min。在流式细胞仪上,通过FITC检测通道检测Annexin V-FITC,激发波长Ex=488 nm,发射波长Em=530 nm;通过PE检测通道检测PI。同时,滴加20 μL用Annexin V-FITC/PI双染的细胞悬液于凹槽载玻片上,并用盖玻片盖住细胞,在荧光显微镜(200×)下观察肿瘤细胞的形态变化和染色结果。
1.3.9 GC-MS检测高活性组分的化学成分
1.3.9.1 GC条件
色谱柱:Hp-5ms毛细管柱(30 mm×0.25 mm,0.25 μm);升温程序:前进样口吹扫流速3 mL/min,起始柱温80 ℃,保持2 min,以6 ℃/min的升温速率升至300 ℃,保持20 min;进样口温度250 ℃;载气(He)流速1 mL/min;进样量1.0 μL,分流进样,分流比:5∶1。
1.3.9.2 MS条件
电子轰击离子源;电子能量70 eV;接口温度250 ℃;传输线温度260 ℃;离子源温度250 ℃;扫描范围m/z 20~450。质谱检测结果利用MS数据系统(NIST 2008)检索匹配对应的化合物,每种化合物的相对含量由仪器软件得出。
1.4 数据统计分析
使用SPSS 20软件处理数据,MTT检验数据来自5 次平行实验。结果用±s表示,用单因素方差分析进行统计分析,采用最小差异显著法进行显著性比较,以P<0.05表示差异显著。
2 结果与分析
2.1 皱瘤海鞘TME和VME对A549细胞增殖的影响
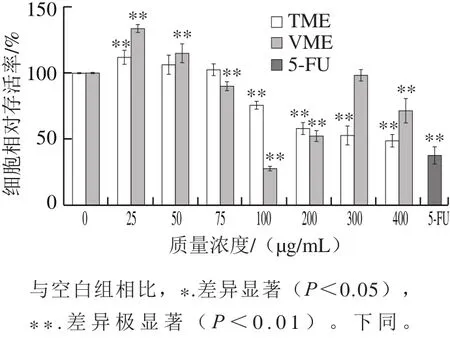
图1 皱瘤海鞘甲醇提取物对A549细胞增殖的影响Fig.1 Effects of methanol extracts from Styela plicata on the proliferation of A549 cells
不同质量浓度的皱瘤海鞘TME和VME作用于A549细胞后,对细胞的存活率均具有一定影响。由图1可知,TME以及VME在低质量浓度(25~75 μg/mL)条件下孵育,对于细胞的增殖没有抑制作用;随着提取物质量浓度的增大,细胞相对存活率均明显下降。100 μg/mL VME处理细胞48 h后,细胞相对存活率仅为27.85%,低于阳性药物对照组(37.80%)。而随着VME质量浓度继续增加,细胞相对存活率没有继续下降,反而有升高趋势,表明100 μg/mL是VME抑制A549细胞的最佳质量浓度。TME在100~400 μg/mL范围内,随着质量浓度的增大,细胞相对存活率降低,最低达到48.75%,表明TME抑制A549细胞相对增殖具有剂量-效应关系。
2.2 皱瘤海鞘TCEF和VCEF对A549细胞增殖的影响
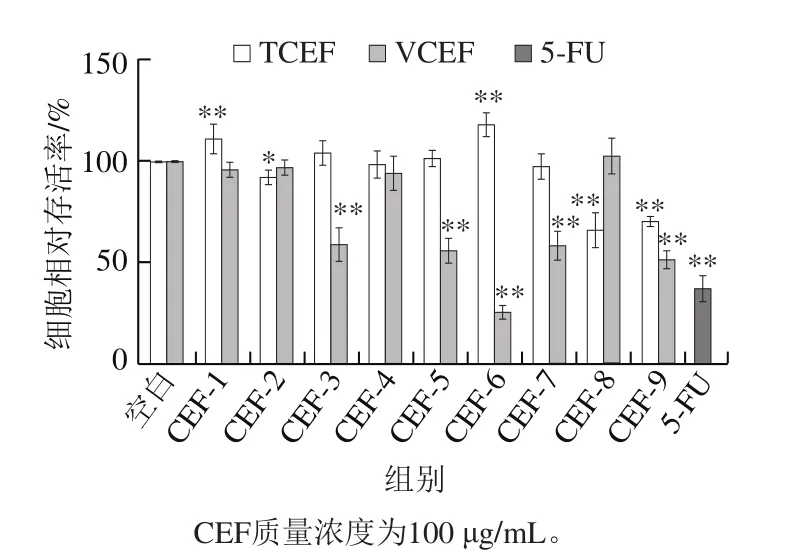
图2 皱瘤海鞘甲醇提取物硅胶柱层析组分对A549细胞增殖的影响Fig.2 Effects of different silica column chromatographic fractions from the methanol extracts on the proliferation of A549 cells
由图2可知,被囊柱层析组分(column eluted fractions from tunic extract,TCEF)及内脏团柱层析组分( column eluted fractions from visceral extract,VCEF)作用于A549细胞后,对细胞相对存活率具有一定影响。用100 μg/mL TCEF-1~7孵育A549细胞后,对细胞相对存活率没有明显抑制作用,而TCEF-8、9对细胞有显著抑制作用,孵育48 h后细胞相对存活率分别为66.57%及71.26%。从整体水平上看,VCEF对于A549细胞的抑制作用明显强于TCEF,其中,VCEF-3、5、6、7、9对于A549细胞的相对抑制率都在40.00%以上,尤其是VCEF-6作用于细胞48 h后,细胞相对存活率仅为25.75%,抑制作用强于阳性药物对照组(37.80%)。
2.3 VCEF-6处理对A549细胞半数抑制浓度的影响

图3 VCEF-6抑制A549细胞增殖的半数抑制浓度曲线Fig.3 Half inhibition concentration curve of VCEF-6 on the proliferation of A549 cells
由图3可知,VCEF-6对于A549细胞的抑制具有明显的剂量-效应关系,24 h半数抑制浓度为168.7 μg/mL,表明VCEF-6具有较强的抑制A549细胞活性。
2.4 细胞形态学观察结果

图4 倒置相差显微镜对A549细胞观察结果(×200)Fig.4 Morphological changes of A549 cells under an inverted phase contrast microscope (× 200)
如图4所示,阴性对照组的A549细胞生长良好,细胞形态规则,边缘清晰平整并且排列紧密。VCEF-6作用48 h后,细胞增殖明显受到抑制,细胞密度比阴性对照组减小,80 μg/mL VCEF-6处理组A549细胞出现膜皱缩,形态不规则;160 μg/mL VCEF-6处理组细胞轮廓模糊,贴壁性下降;320 μg/mL VCEF-6处理组细胞空泡化严重,细胞皱缩程度也急剧增加,与阴性对照组正常细胞有明显区别,同时在培养基中出现许多悬浮的死细胞。
2.5 细胞凋亡观察与分析结果
细胞凋亡是细胞为了维持内环境的稳定,由细胞内基因控制其发生的有序的、自主的死亡。诱导肿瘤细胞凋亡是目前所有癌症治疗手段中最有效的手段之一,而凋亡敏感性的丧失是细胞由正常状态转变为癌化状态的主要标志之一。何雅军等[14]的研究表明,Annexin V-FITC/PI双标记染色法能够准确地反映细胞凋亡的过程,可作为检测早期细胞凋亡的方法。本实验以Annexin V-FITC/PI双染料对VCEF-6处理的A549细胞进行染色,通过流式细胞仪及荧光显微镜对染色的肿瘤细胞进行细胞凋亡观察与分析。显微镜观察发现大部分被VCEF-6处理的细胞与Annexin V-FITC/PI染料结合后,呈现绿色和红色,表现出典型的凋亡特征。而未被VCEF-6处理的细胞几乎没有与Annexin V-FITC/PI染料结合。随着VCEF-6质量浓度的增大,早期凋亡与晚期凋亡的细胞数量也发生变化。80 μg/mL及160 μg/mL质量浓度下被FITC染色的细胞相对较多,表明在这两个质量浓度下早期凋亡细胞所占例比较高。而当VCEF-6质量浓度增大到320 μg/mL时,被PI染色的细胞相对增多,表明在该质量浓度下晚期凋亡细胞占比较多(图5C)。通过流式细胞仪检测结果发现,随着VCEF-6质量浓度的增大,能与Annexin V-FITC/PI结合的被V C E F-6处理的A 5 4 9细胞也增多(图5A)。VCEF-6质量浓度从0 μg/mL时增大至320 μg/mL时,A549细胞的总凋亡率(早期凋亡率(Q2象限)与晚期凋亡率(Q4象限)之和)从13.30%增加到30.27%(图5B),表明VCEF-6具有促进肿瘤细胞凋亡的作用。
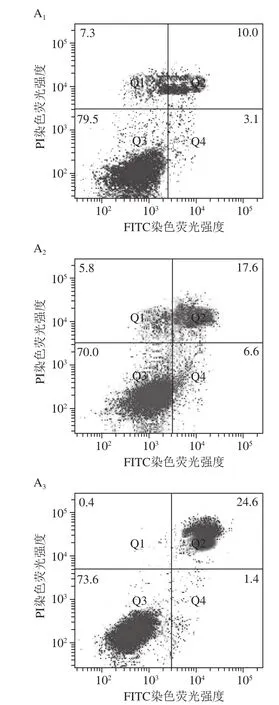
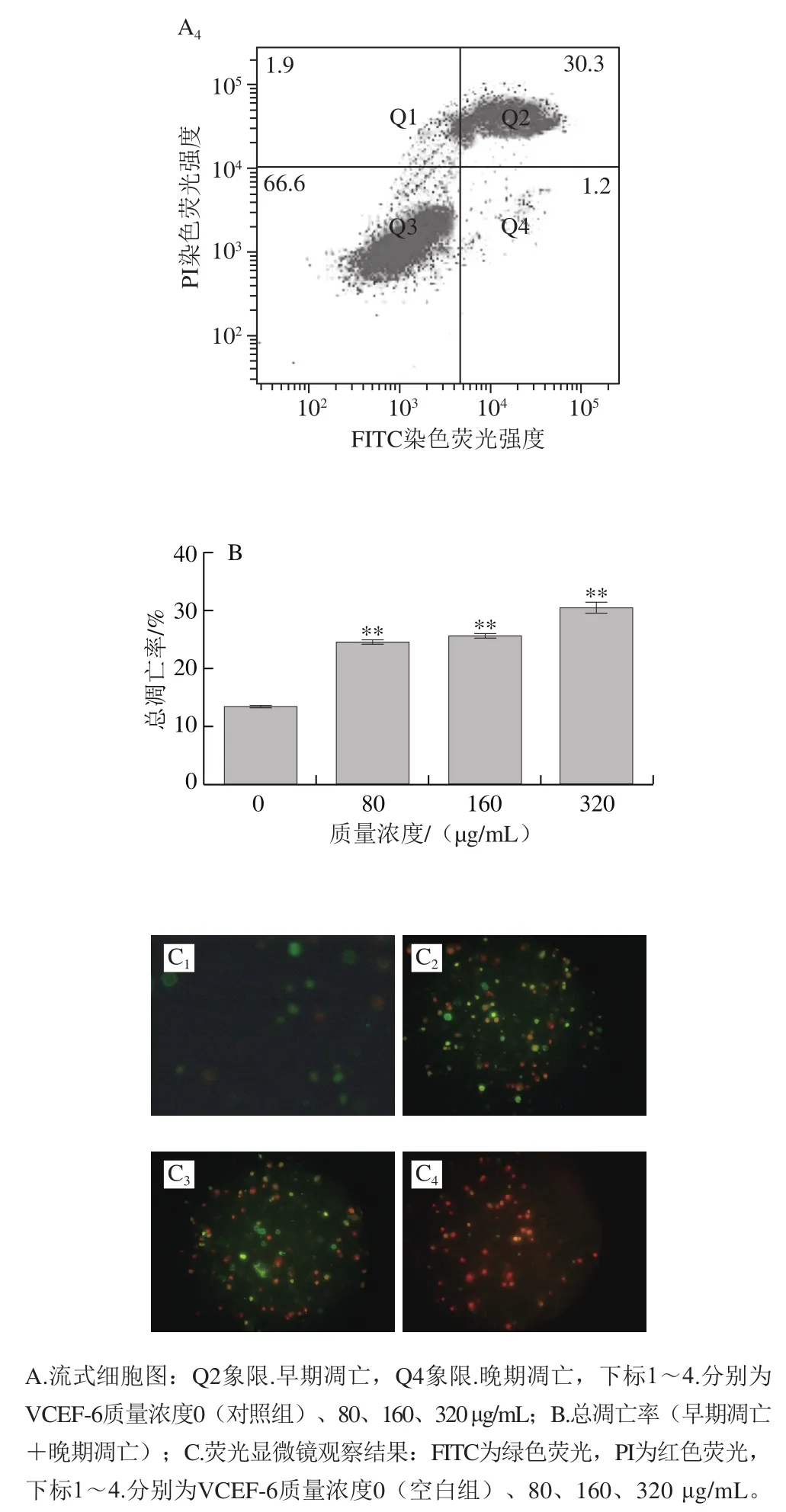
图5 VCEF-6质量浓度对A549细胞凋亡的影响Fig.5 A549 cell apoptosis induced by different concentrations of VCEF-6
2.6 VCEF-6的化学成分分析

图6 VCEF-6的GC-MS总离子流图谱Fig.6 Total ion current chromatogram from GC-MS analysis of VCEF-6

表1 VCEF-6化合物成分分析Table1 Chemical composition analysis of VCEF-6
经过MS数据系统检索(NIST 2008)以及人工谱图解析确定出VCEF-6的化学成分,结果见图6、表1。从VCEF-6中共检测并鉴别出22 种组分,包括烷烃类6 种、甾醇类6 种、脂肪酸酯类6 种、芳香族化合物4 种。其中相对含量大于1%的有胆甾醇(34.46%)、麦角甾-5,22-二烯-3-醇(3.82%)、链甾醇(2.00%)、豆甾-5,24(28)-二烯-3-醇(1.98%)、穿贝海绵甾醇(1.94%)、十六酸甲酯(1.90%)、豆甾醇(1.44%)、硬脂酸甲酯(1.43%)。
3 讨 论
近年来,海鞘在抗肿瘤天然产物的研究中脱颖而出,在首先进入临床阶段的6 个海洋来源的抗肿瘤药物中,3 个来源于海鞘,此外还有大批候选化合物也正在研究中。Liberio等[15]从143 种海鞘提取物中鉴定出一种双吲哚生物碱eusynstyelamide B,对于乳腺癌细胞MDA-MB-231的半数抑制浓度仅为5 μmol/L。Palanisamy等[16]利用高效液相色谱法分离出皱瘤海鞘甲醇提取物的不同组分,并分别检测其对肿瘤HeLa细胞的抑制活性,其中SP-50组分抑制肿瘤细胞生长最为明显,半数抑制浓度仅为33 μmol/L;值得注意的是,SP-50对于人正常细胞BJ-EHLT没有显著的毒性,表明该组分对于肿瘤细胞的抑制具有选择性,亟待进行深入研究。2012年,一种来源于Ciona savignyi海鞘的抗肿瘤多肽CS5931被分离出来,其对于HeLa、A549细胞的半数抑制浓度分别为18.132 mg/mL和105.732 mg/mL,进一步的研究表明,该多肽是通过线粒体介导通路诱导肿瘤细胞凋亡[17]。Cheng Linyou等[18]从Ciona intestinalis L.海鞘中提取得到的一种小分子水溶性化合物CI431,对肿瘤细胞有极强的抑制活性,对于A549、HeLa细胞的半数抑制浓度分别为39.472 μg/mL和30.417 μg/mL。罗宁等[19]研究了皱瘤海鞘乙醇提取物对肿瘤细胞的抑制作用,对于MCF-7以及HuH-7细胞的半数抑制浓度分别为1 695.785 μg/mL和1 763.665 μg/mL。在前人的研究基础上,本研究选取南海海鞘优势物种皱瘤海鞘为研究对象,分别探讨其被囊及内脏团两部分对于A549细胞的生长抑制作用,并进一步将甲醇提取物按照极性分为9 个组分,最后筛选出对于A549细胞生长抑制作用最强的组分VCEF-6,其24 h半数抑制浓度仅为168.7 μg/mL。与发达国家相比,我国的海洋药物研究起步较晚,而我国拥有300万 km2的海洋国土面积,海洋生物资源丰富;因此,开展海洋天然活性产物的研究迫在眉睫。
研究表明从海鞘体内分离得到的活性产物大部分是来源于与其共附生的微生物[20]。Tianero等[21]在对32 种不同海鞘共附生微生物以及代谢产物的研究中发现,不同种类的海鞘的共附生微生物具有极大的多样性,并且具有物种特异性以及地理位置特异性。其中,具有地理位置特异性的代谢产物主要包括一些脂类,而具有物种特异性的代谢产物主要囊括了多种次级代谢产物。本研究中提取得到的皱瘤海鞘抗肿瘤组分VCEF-6是由海鞘本体产生还是共附生微生物产生,有待于进一步研究。
细胞凋亡是细胞为了维持内环境稳定,由基因控制的细胞自主有序的死亡。与细胞凋亡不同,细胞坏死为被动过程,而凋亡是主动过程。大量研究表明,细胞凋亡与肿瘤等许多疾病的发生密切相关,目前,许多抗肿瘤药物作用的主要机制之一是诱导肿瘤细胞凋亡[22-24]。在细胞凋亡研究中,流式细胞术是一种定量的技术手段,能够较为精确地测定出凋亡细胞占所测定总细胞的比例。钱叶等[25]利用流式细胞术研究了松乳菇多糖对肿瘤细胞凋亡的影响,结果表明在质量浓度为12.5~50.0 μg/mL范围内,松乳菇多糖显著诱导A549细胞的凋亡,并呈现出剂量依赖关系。赵敬等[26]使用流式细胞仪研究了姜黄素对HeLa细胞凋亡的调控作用,发现随着姜黄素质量浓度的增大,大量的HeLa细胞被阻滞在S期,表明姜黄素可能是通过将细胞阻滞在S期,使其不能进入下一增殖周期来抑制肿瘤细胞的生长。本实验采用Annexin V-FITC/PI双染细胞凋亡试剂盒经流式细胞仪检测VCEF-6诱导A549细胞的凋亡情况,结果显示,与空白组相比,不同质量浓度VCEF-6处理组的A549细胞均出现一定程度的凋亡,且随着VCEF-6质量浓度的增加,凋亡率明显升高。这说明VCEF-6对A549细胞的凋亡具有明显的诱导作用,且呈剂量-效应关系。
本研究在筛选出对A549细胞抑制活性最强的皱瘤海鞘醇提物组分(VCEF-6)的基础上,采用GC-MS法分析该组分的化学成分,从中鉴别出22 种化学成分,包括甾醇类6 种、烷烃类6 种、脂肪酸酯类6 种、芳香族化合物4 种。参考相关文献,发现VCEF-6的化学成分中已报道的具有抗肿瘤活性的化合物为豆甾醇[27-28]和麦角甾醇[29],因此,推测甾醇类组分为VCEF-6发挥抗肿瘤活性的重要物质基础。此外,VCEF-6能够发挥抑制肿瘤细胞生长的活性,其机制可能与中药及其方剂多组分、多靶点的整合作用相似。中药由活性物质群构成,并且按照一定比例组合,活性物质群通过多靶点、多途径经整合发挥作用[30]。VCEF-6的多组分是如何发挥肿瘤细胞生长抑制作用以及作用于哪些靶点,有待进一步研究。
4 结 论
本实验以甲醇为溶剂提取得到皱瘤海鞘被囊及内脏团的醇提物,并用MTT法检测不同质量浓度醇提物对A549细胞的生长抑制作用,结果表明在较低质量浓度(25~75 μg/mL)下,被囊及内脏团醇提物对A549细胞生长没有抑制作用,当质量浓度增大到100 μg/mL以上时,其对于A549细胞表现出明显抑制作用。采用硅胶柱层析的方法将皱瘤海鞘醇提物根据极性分离纯化为9 个不同组分,并分别检测其抗肿瘤活性,发现有8 个组分对A549细胞具有明显的生长抑制作用,其中活性最强的组分为VCEF-6,对于A549细胞的半数抑制浓度为168.7 μg/mL。进一步利用流式细胞术以及荧光显微镜观察表明,VCEF-6强烈抑制肿瘤细胞生长与其能够诱导细胞凋亡有关。最后,使用GC-MS技术分析VCEF-6的化学成分,利用计算机谱库检索结合人工分析鉴定出22 种化合物,其中含量较高的有胆甾醇(34.46%)、麦角甾-5,22-二烯-3-醇(3.82%)、链甾醇(2.00%)、豆甾-5,24(28)-二烯-3-醇(1.98%)、穿贝海绵甾醇(1.94%)、十六酸甲酯(1.90%)、豆甾醇(1.44%)、硬脂酸甲酯(1.43%)。
