石斛多糖的研究进展
2018-11-29周思静刘桂君杨素玲乔宇琛顾海科
周思静,刘桂君,*,周 敏,杨素玲,乔宇琛,王 平,顾海科
(1.北京市辐射中心,北京 100015;2.农业农村部国际交流服务中心,北京 100125)
石斛为兰科一大属,最早可见《神农本草经》中记载[1],据统计在我国有两大类74 种石斛[2],《中华人民共和国药典》(2015版)收录了铁皮石斛、金钗石斛、鼓槌石斛、流苏石斛4 种石斛[3]。石斛具有“主伤中,除痹,下气,补五脏虚劳赢瘦,强阴,久服厚肠胃,轻身延年”之功效[1]。现代药理研究表明石斛具有增强免疫力、抗氧化、抗肿瘤、保肝、抗疲劳等多种功能活性[4]。石斛多糖作为石斛的重要功能活性物质,其多糖成分的含量与石斛的种类、生长环境等相关。20世纪80年代,研究者开始对石斛进行研究,相继对石斛多糖的提取纯化、结构解析及功能活性等开展研究,并取得了一定的成果。本文对近年来石斛多糖的提取纯化、结构解析及功能活性进行总结,以期为石斛多糖的进一步开发提供一定的参考价值。
1 石斛多糖的提取与纯化
1.1 石斛多糖的提取
石斛粗多糖的提取是多糖提取纯化研究的第一步,石斛粗多糖的提取一般按照图1流程进行。首先将石斛原料进行干燥、粉碎处理,用乙醇等有机溶剂进行脱脂、脱色,然后采用适宜的提取方法对多糖进行初步分离提取,将上述提取液进行浓缩后,加乙醇等溶剂反复进行沉淀、离心,除蛋白、干燥处理即可得到粗多糖。
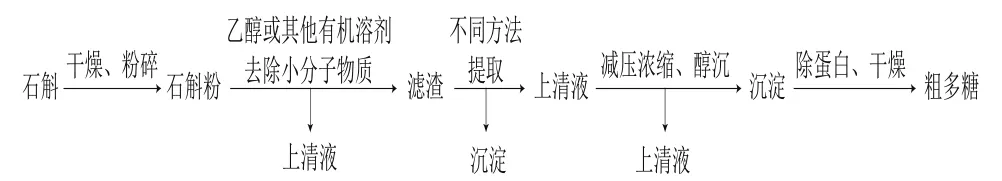
图1 石斛多糖提取流程图Fig.1 Flow chart for extracting polysaccharides from Dendrobium plants
水提醇沉法是目前最常用的提取石斛多糖方法,如《中华人民共和国国药典》中规定“铁皮石斛中多糖的含量不得低于25%”所采用的提取方法即为水提醇沉法[3]。黄晓君等[5]对热水浸提铁皮石斛多糖的工艺进行优化研究,得到其最佳工艺条件为水料比30∶1、提取温度90 ℃、提取时间2 h,在此条件下,多糖得率可达到30.56%,中性糖含量为78.21%。此外,随着一些新的提取技术的发展,一些新方法如超声波辅助法[6]、微波辅助法[7]、酶解辅助法[8]以及将两种或多种提取方法联用等也应用于石斛多糖的提取中。刘艳艳等[6]研究超声波辅助提取霍山石斛多糖各因素对多糖得率的影响,得到最优工艺条件为液料比30∶1、浸提温度81 ℃、浸提时间120 min、超声功率423 W、超声时间8 min,在此条件下多糖的平均得率为19.96 mg/g。Zhang Yi等[9]优化超声波辅助聚乙二醇提取金钗石斛多糖工艺,最高提取率可达(15.23±0.57)%。陈盛余等[7]采用微波辅助提取铁皮石斛多糖,多糖的提取率可达到9.77%。采用超声波和微波辅助提取可显著缩短提取时间,但多糖经过超声或微波处理后其糖键可能会发生断裂等不利影响[10]。张晓敏等[8]采用纤维素酶酶法提取金钗石斛多糖,在料液比1∶50、缓冲液pH 5.0、提取时间170 min、酶用量4 500 U/g、酶解温度55 ℃的条件下,金钗石斛多糖的提取率为7.71%。酶法提取多糖虽可提高提取率且提取条件也比较温和,但采用纤维素酶会降解O-乙酰-β-D-1,4-葡甘露聚糖,在铁皮石斛、霍山石斛及细茎石斛中均发现有此类多糖[10]。此外,罗傲雪等[11]比较了回流提取、改进回流提取、超声波提取与超声辅助热回流提取法对石斛多糖含量测定的影响,结果发现4 种提取方法所测得的多糖含量分别为(13.47±0.63)%、(15.69±0.74)%、(11.87±0.54)%、(16.29±0.41)%。
经提取获得的石斛粗多糖一般都含有蛋白质,因蛋白质所带的电荷在吸附大量杂质的同时也会吸附多糖,给多糖的进一步分级分离带来困难,因此需经过除蛋白处理。目前除蛋白的方法有Sevag法、三氟三氯乙烷法、三氯乙酸法、酶法、鞣酸法等[12],在石斛多糖中常用的为Sevag法。何铁光等[13]对铁皮石斛粗多糖Sevag法除蛋白过程进行了研究,结果表明:氯仿/正丁醇体积比为1.0∶0.4,样品/氯仿与正丁醇体积比为1∶0.35,萃取时间5 min时脱蛋白效果最佳。王琳炜等[14]以霍山铁皮石斛为原料,比较了Sevag法、酶法(胰蛋白酶)、酶法-Sevag法对多糖脱蛋白效果及多糖损失率的影响,结果发现采用Sevag法耗费试剂,且多糖损失率大(32.72%),酶法蛋白脱除率低(71.88%),酶法-Sevag法联用蛋白脱除率高(81.58%),且多糖的损失率低(15.63%)。
1.2 多糖的纯化
纯化是将多糖混合物分离为均一多糖的过程,是石斛多糖分离提取的关键步骤,其结果的好坏对后续研究具有重要的影响。目前石斛多糖的纯化最常采用二乙胺基乙基(diethyl-amino-ethyl,DEAE)-纤维素离子交换色谱和凝胶色谱法联用的方法。针对不同的多糖,需根据其分子的大小和所带基团的性质等,选择适合的凝胶色谱柱进行纯化处理。经过纯化后的多糖均要进行纯度的鉴定,高效凝胶渗透色谱法(high performence gel permeation chromatography,HPGPC)是鉴定纯度和测定多糖分子质量较为精确的一种方法。
王世林等[15]对铁皮石斛采用水提醇沉法,获得3 种粗多糖,经DEAE-葡聚糖凝胶(Sephadex)A-50和Sephadex G-200进行纯化处理,获得精制多糖I、II、III。Zha Xueqiang等[16]采用水提醇沉、DEAE-纤维素离子交换色谱、Sephadex G-25从霍山石斛中分离得到5 种多糖组分(HPS-1、HPS-2、HPS-3、HPS-4和HPS-5),对其组分H P S-1又进一步采用丙烯葡聚糖凝胶(Sephacryl)S200、Sephadex G75、Sephadex G100分离纯化,共计获得8 种霍山石斛多糖组分。王军辉等[17]采用DEAE-纤维素柱、Sephacryl S-200、Sephadex G-100从金钗石斛粗多糖中分离得到7 种多糖组分(DNP-W1B、DNP-W1A、DNP-W2、DNP-W3、DNP-W4、DNP-W5和DNP-W3)。此外,鲍素华等[18]对铁皮石斛粗多糖采用不同体积分数的乙醇进行分级分离得到3 种多糖组分(DSP3、DSP2、DSP1)。
2 石斛多糖结构的研究
石斛多糖是结构复杂的生物大分子,对其进行结构解析是一项繁琐的过程,一般包括多糖分子质量、单糖残基的连接位置及顺序、糖苷键的构型等一级结构的解析,同时也包括多糖分子空间构象、多糖分子之间空间上的相互作用等高级结构的解析。对于多糖结构的解析除了应用现代各种光谱技术外,还需要结合一些化学的方法,才能较为全面地对多糖结构进行解析。
2.1 铁皮石斛多糖结构的研究进展
王世林等[15]对分离到的石斛多糖组分I、II、III采用红外光谱(infrared spectrum,IR)、1H核磁共振(nuclear magnetic resonance,NMR)谱、13C NMR、凝胶过滤柱层析法、过碘酸氧化和Smith降解产物分析等方法,推断该多糖分子质量分别为1 000、500 kDa和120 kDa,是一类O-乙酰β型葡甘露聚糖,单糖组分为甘露糖(mannose,Man)、葡萄糖(glucose,Glc)及微量的阿拉伯糖(arabinose,Arab)和木糖(xylose,Xyl),其主链主要由(1→3)-β-D-甘露吡喃糖基和(1→4)-β-D-葡萄吡喃糖基构成,支链可能由(1→4)-β-D-葡萄糖基和其他戊糖基组成,并连接在主链葡萄糖基的2-、3-或6-位上。Hua Yunfen等[19]对从铁皮石斛茎中分离得到的中性多糖DOP-1-A1组分的结构特征进行分析,该多糖为2-O-乙酰基葡甘露聚糖,分子质量为128 kDa,单糖组成n(Man)∶ n (Glc)∶ n(Arab)为40.2∶8.4∶1.0,主链由(1→4)-β-D-Manp、(1→4)-β-D-Glcp组成,支链由(1→3)-β-D-Manp、(1→3)-β-D-Glcp组成。何铁光等[20]对从铁皮石斛原球茎中提取分离的两种新型多糖组分DCPP1a-1、DCPP3c-1的结构进行了解析:DCPP1a-1的分子质量为189 kDa,单糖组成为甘露糖和葡萄糖按物质的量7.0∶1.0组成,含有α-吡喃糖苷键,其中1→6糖苷键占4.0%,1→2或1→4糖苷键占52.1%,1→3糖苷键占44.9%;DCPP3c-1的分子质量为72.4 kDa,单糖组成为甘露糖、鼠李糖(rhamnose,Rha)、半乳糖醛酸(galacturonic acid,GalA)、葡萄糖、半乳糖(galactose,Gal)和阿拉伯糖,其物质的量之比为1.1∶1.0∶1.0∶23.3∶3.8∶1.0;高碘酸氧化分析认为DCPP3c-1中1→6键连接的残基占14.0%,1→2或1→4键连接的残基占40.7%,1→3键连接的残基占45.3%[21]。Luo Qiulian等[22]对多糖组分DOPB1结构进行了分析,测定其分子质量为8.5 kDa,单糖组成为甘露糖、葡萄糖、阿拉伯糖及微量的半乳糖醛酸,其物质的量之比为6.2∶2.3∶2.1∶0.1,高碘酸盐氧化结合Smith降解反应及1D、2DNMR分析认为该多糖主链是由(1→4)-β-D-Manp和(1→4)-β-D-Glcp组成,属于(1→4)-β-D-葡甘露聚糖,此外对其他4 种多糖组分(DOPB2、DOPB3、DOPB4、DOPB5)的一级结构也进行了解析[23]。He Taobin等[24]对从铁皮石斛中分离的多糖DOP-1-1的结构分析,该多糖是分子质量为178 kDa、单糖组成为甘露糖和葡萄糖(5.9∶1.0,n/n)的一类O-乙酰-β-D型葡甘露聚糖。
通过文献分析可知:对于目前分离出的铁皮石斛多糖组分,其单糖组成主要由葡萄糖和甘露糖组成,此外还含有阿拉伯糖、半乳糖醛酸、木糖、鼠李糖、半乳糖等。不同之处在于所组成单糖的物质的量之比、支链的糖基组成、连接位置及O-乙酰基团的取代位置等。此外,在多糖构型判断上有些研究通过IR分析进行推测,而目前文献报道较多的是采用IR技术结合NMR技术进行判断。
2.2 霍山石斛多糖结构的研究进展
Zha Xueqiang等[16]最早开始对霍山石斛多糖结构进行解析,对分离纯化到的多糖HPS-1B23的结构进行解析,认为该多糖单糖组成为葡萄糖、甘露糖和半乳糖,其物质的量之比为31∶10∶8,该多糖的分子质量为22 kDa,其多糖分子主链是由(1→6)-α-D-Glcp、(1→4)-α-D-Glcp、(1→6)-α-D-Manp组成,其中α-D-Galp和乙酰基分别以支链形式连在(1→6)-α-D-Manp和(1→6)-α-D-Glcp的C-3位上。Hsieh等[25]对从霍山石斛叶和茎的黏液中分离的多糖组分B结构解析发现:该多糖分子质量为9.7 kDa,单糖组成n(Man)∶n(Glc)为3.8∶1.0,主链由(1→4)-β-D-Glcp和(1→4)-β-D-Manp构成,O-乙酰基团通过2位和3位连接在(1→4)-β-D-Manp上,未发现支链糖残基。Tian Changcheng[26]、Li Xiaolong[27]等在Zha Xueqiang等[16]研究的基础上对霍山石斛原球茎中分离的多糖组分DHP1A和DHPD2的结构组成进行分析,DHP1A的分子质量为6.7 kDa,单糖组成n(Man)∶n(Glc)∶n(Gal)为2.5∶16.0∶1.0,主链由(1→4)-α-D-Glcp、(1→6)-α-D-Glcp和(1→4)-β-D-Manp组成,支链由β-D-Glcp构成;DHPD2分子质量为8.09×106Da,其单糖主要由半乳糖、葡萄糖和阿拉伯糖按物质的量之比0.9∶0.7∶0.2组成,主链主要由(1→5)-α-L-Araf、(1→6)-α-D-Glcp、(1→6)-β-D-Glcp、(1→4)-β-D-Glcp、(1→3,6)-β-D-Galp和(1→6)-β-D-Glap构成,支链由α-D-Xylp、β-D-Manp组成。Pan Lihua等[28]对分子质量为73 kDa、单糖组成n(葡萄糖)∶n(木糖)∶n(半乳糖)为1.1∶1.0∶0.5的霍山石斛多糖DHP-W2采用甲基化、2DNMR的全相关谱、异核单量子相关和异核多键相关对多糖的结构进行解析,得出该多糖主链由(1→4)-β-D-Glcp、(1→6)-β-D-Glcp和(1,4,6)-β-D-Glcp构成,支链由1,2,4-α-D-Xylp、1,4-α-D-Xylp、1-α-D-Xylp、1-α-D-Galp和1-α-D-GalpA组成。Li Fan等[29]对从霍山石斛类原球茎中分离得到的多糖组分DHP-4A的结构进行研究,发现该多糖分子质量为232 kDa,单糖组成n(Glc)∶n(Arab)∶n(Man)∶n(Rha)为 13.8∶3.0∶6.1∶2.1,主链由(1→6)-β-D-Glcp、(1→6)-β-D-Manp和(1→3,6)-β- -Manp组成,支链由(1→3)-α-L-Araf、(1→2)-α-L-Rhap和(1→4)-β-D-Manp构成,通过1→6-Manp的C-3位连接在主链上。由上述文献可知从霍山石斛中分离出的多糖,其单糖组成有葡萄糖、甘露糖、半乳糖、阿拉伯糖、鼠李糖、木糖,其多糖主链主要由(1→4)/(1→6)-Glcp、(1→4)/(1→6)-Manp及(1→4)/(1→6)/(1,4,6)-Glcp组成,但其分子质量、单糖组成、连接位置及顺序等均存在着不同,这种情况可能是霍山石斛生长环境、提取纯化等的不同引起的。
2.3 金钗石斛多糖结构的研究进展
王军辉等[17]对从金钗石斛中分离出的7 种多糖组分(DNP-W1A、DNP-W1B、DNP-W2、DNP-W3、DNP-W4、DNP-W5和DNP-W6)采用化学方法和波谱分析法进行结构解析。其中DNP-W1B是半乳阿拉伯葡萄聚糖,分子质量为770 kDa,单糖组成n(Glc)∶n(Arab)∶n(Gal)为6.2∶3.1∶0.9,主链由(1→4)-β-Glcp和(1→6)-β-Glcp组成,支链由α-D-Galp和(1→3)-α-L-Araf构成;DNP-W2是半乳甘露葡萄糖聚糖,分子质量为18 kDa,单糖组成n(Glc)∶n(Man)∶n(Gal)为6.1∶2.9∶2.0,主链由(1→4)-β-D-Glcp、(1→6)-β-D-Glcp和(1→4)-β-D-Manp构成,支链由α-D-Galp构成,其中(1→4)-β-D-Manp的2位被乙酰基团取代[30]。DNP-W3组分分子质量为710 kDa,单糖组成n(Gal)∶n(Rha)∶n(Arab)为3.1∶1.1∶1.0,主链由(1→3)-β-D-Galp构成,支链由(1→4)-α-L-Rhap和β-L-A r a p构成[31]。D N P-W 4分子质量为5.0×1 02k D a,单糖组成n(M a n)∶n(Glc)∶n(Gal)∶n(Xyl)∶n(Rha)∶n(GalA)为1.0∶4.9∶2.5∶0.5∶1.0∶0.9,主链由(1→4)-β-D-Glcp、(1→6)-β-D-Glcp、(1→6)-β-D-Galp组成,支链由β-D-Manp、(1→6)-β-D-Manp、(1→3)-β-D-Glcp、β-D-Glcp、(1→4)-α-D-GalAp、(1→2)-α-L-Rhap及Xylp组成,支链通过Galp的3位、Glcp的4位和6位连接在主链上[32]。组分D N P-W 5为一种果胶类杂多糖,分子质量为4 6 0 k D a,单糖组成n(Man)∶n(Glc)∶n(Gal)∶n(Xyl)∶n(Rha)∶n(GalA)为3.1∶8.1∶8.2∶0.6∶4.2∶3.9,其主链由(1→4)-α-D-GalAp、(1→2)-α-L-Rhap构成,支链由半乳糖、葡萄糖、甘露糖及木糖残基构成[33]。此外对分离得到的DNP-W1A、DNP-W6的结构也进行了解析[34]。
2.4 细茎石斛多糖结构研究进展
陈云龙等[35]对从细茎石斛茎中分离的多糖组分DMP1a-1通过采用高碘酸氧化、HPGPC、薄层色谱分析、气相色谱(gas chromatography,GC)、GC-质谱(mass spectrum,MS)联用、IR、NMR等方法进行结构分析,认为该多糖分子质量为28 kDa,单糖组成n(Glc)∶n(Man)为1.0∶4.8,主链由(1→4)-β-D-Manp和(1→4)-β-D-Glcp构成,支链由α/β-D-Glcp构成,其中部分(1→4)-β-D-Manp的3位被乙酰基团取代,DMP1a-1为β-D-吡喃型葡萄甘露聚糖。徐程等[36]在陈云龙等[35]研究的基础上对分子质量为6 kDa的多糖组分DMP2a-1的结构进行解析,该多糖的单糖组成为葡萄糖和甘露糖,其物质的量之比为12.6∶1.0,主链由(1→4)-α-D-Glcp构成,支链由β-D-Manp和β-D-Glcp构成。此外,陈璋辉等[37]分析了从细茎石斛中分离纯化的酸性多糖DMP4a-1的结构,DMP4a-1平均相对分子质量为3 049,主要由葡萄糖、甘露糖、鼠李糖、阿拉伯糖和半乳糖组成,其分子物质的量之比为2.9∶2.9∶1.8∶1.3∶1.0,高碘酸氧化反应测定该糖链结构中存在1→4、1→3及l→6糖苷键,且物质的量之比为1.2∶2.4∶1,IR分析该多糖为一种β-D-吡喃杂多糖。该研究在多糖构型的确定上只通过IR分析,未采用NMR分析技术。
2.5 其他石斛多糖结构研究进展
此外对从其他石斛中分离的多糖的结构也有一些研究,如Li Qiang等[38]对从密花石斛中分离的杂多糖DDP-1-D的结构进行解析,分子质量大小9.44 kDa,单糖组成n(Glc)∶n(Man)为3.0∶1.0,主链由(1→4)-α-D-Glcp、(1→6)-α-D-Glcp 、(1→2)-α-D-Manp、(1→4)-β-D-Manp构成。Luo Aoxue等[39]对从迭鞘石斛中分离的多糖DDP的结构解析为:分子质量484.7 kDa,单糖组成n(Arab)∶n(Xyl)∶n(Man)∶n(Glc)∶n(Gal)为1.0∶2.7∶8.9∶34.2∶10.2,存在α-D-Galp-(1→、α-D-Manp-(1→、→4,6)-α-D-Glcp-(1→、→4)-α-D-Glcp-(1→糖残基。Sun Yandong等[40]对从鼓槌石斛分离出的多糖组分DCPP-I-a进行结构分析,该多糖分子质量为122 kDa,单糖组成n(Xyl)∶n(Glc)∶n(Gal)为1.4∶6.9∶12.8。
3 石斛多糖的功能活性
石斛多糖同其他多糖(如香菇多糖等)一样,也具有多种功能活性,目前对石斛多糖功能活性的研究主要集中在抗氧化、免疫调节、抗肿瘤、降血糖等方面。
3.1 抗氧化
王爽等[41]研究石斛多糖的抗氧化效果,结果显示,石斛多糖具有清除羟自由基和超氧阴离子自由基的作用,可显著提高小鼠血清和肝组织中超氧化物歧化酶、谷胱甘肽过氧化物酶活力,降低丙二醛含量。查学强等[42]对比霍山石斛和铁皮石斛多糖的体外抗氧化效果,结果表明两种石斛多糖具有较好的抗氧化活性,但两种石斛多糖的抗氧化效果差异显著,其中霍山石斛多糖的抗氧化活性明显强于铁皮石斛。王再花等[43]比较铁皮石斛、大苞鞘石斛和金钗石斛3 种石斛茎段粗多糖、精多糖(除去了蛋白的多糖)和多糖组分的抗氧化效果,结果表明随着多糖纯度和质量浓度的提高,抗氧化效果均显著增强,在1.2 g/L时效果最佳,铁皮石斛多糖组分(DOPP-I)、大苞鞘石斛多糖组分(DWPP-I)和金钗石斛多糖组分(DNPP-I)对DPPH自由基的清除率均在75%以上,对羟自由基的清除率在84%以上,且显著优于VC,但3 种多糖组分间差异不显著;3 种石斛多糖对超氧自由基的清除能力显著低于VC,但DWPP-I的清除能力显著高于DOPP-I和DNPP-I。何铁光等[20]通过测定其清除氧自由基和抗脂质过氧化能力,分别证实了铁皮石斛多糖粗品及纯品DCPP1a-1和DCPP3c-1均具有抗氧化活性。推测石斛多糖抗氧化的机理是通过清除活性氧自由基,致使氧化损伤程度减轻。此外,鲍素华等[18]的研究结果表明,不同分子质量铁皮石斛多糖均有抗氧化作用,且抗氧化能力与其分子质量大小有关,在其研究中分子质量小于35.3 kDa或大于74.4 kDa铁皮石斛多糖的生物活性高。郝杰等[44]在对不同分子质量霍山石斛多糖抗氧化效果的研究中发现,不同相对分子质量的多糖在不同抗氧化体系中抗氧化活性差异显著。Tian Changcheng等[26]实验证实低分子质量(6.70 kDa)霍山石斛多糖组分DHP1A具有抗氧化活性。已有研究表明石斛多糖均具有较显著的抗氧化效果,其抗氧化效果的大小与石斛的种类、多糖的纯度、分子质量的大小等因素相关。
3.2 免疫调节
李胜立等[45]通过研究霍山石斛类原球茎对小鼠免疫调节活性的有效部位及其毒理安全性评价,认为其具有免疫调节活性的有效部位为石斛多糖,且该多糖无毒、无致突变作用。宋美芳等[46]的实验结果表明,石斛多糖均能够协同刀豆蛋白刺激T淋巴细胞的增殖,并可以提高淋巴细胞中的白细胞介素(interleukin,IL)-2及干扰素-γ的活性;同时在动物实验中,高剂量石斛多糖均能增加绵羊红细胞致小鼠足跖肿胀程度和脾脏指数。因此石斛多糖具有增强免疫的作用,其作用机制与增强T淋巴细胞免疫和体液免疫相关。陈璋辉等[37]通过体外实验证实细茎石斛多糖DMP4a-1可明显刺激巨噬细胞分泌肿瘤坏死因子-α,促进脾淋巴细胞增殖,具有免疫增强功能。陈程等[47]对不同发育阶段的霍山石斛多糖组分(其单糖组成具有差异)的体外免疫活性实验表明,不同发育阶段霍山石斛多糖的免疫活性无显著性差异。He Taobin[24]、Li Fan[29]等通过实验证实铁皮石斛多糖DOP-1-1、霍山石斛多糖组分DHP-4A均具有免疫活性。童微等[48]通过探索铁皮石斛多糖化学修饰与免疫活性之间的关系,发现硫酸化和脱乙酰化修饰可提高铁皮石斛多糖的免疫活性,而羧甲基化修饰则会降低其免疫活性,表明不是所有的官能团接枝改性都会增强其免疫活性。此外,球花石斛多糖也被证实具有免疫活性[49],迭鞘石斛中性多糖DDP1-1也具有免疫活性[50]。由此可以看出不同种类的石斛多糖均具有免疫活性,其免疫活性的作用机制可能与T淋巴细胞、巨噬细胞等有关。
3.3 抗肿瘤作用
石斛多糖可通过活化淋巴细胞、激活巨噬细胞、激活自然杀伤细胞/淋巴因子激活杀伤细胞(lymphokine activated killer cells,LAK)等调节机体的免疫能力,从而发挥抗肿瘤作用。如蔡体育等[51]采用从31 例癌症病人(鼻咽癌19 人,恶性淋巴瘤、何杰金氏病共12 人)的外周血分离出的淋巴细胞,通过进行E-玫瑰花环形成(erythrocyte rosette forming cell,E-RFC)实验,观察石斛多糖对T淋巴细胞活性的影响,结果显示,石斛多糖处理组E-RFC的形成率为69.87%,显著高于对照组(52.35%),与胸腺组的结果(69.60%)相近,实验结果表明,石斛多糖能显著提高癌症病人外周淋巴细胞E-RFC的形成率。罗傲雪等[52]研究结果表明,迭鞘石斛多糖可能通过增强机体抗氧化的能力,从而提高免疫功能来对抗肿瘤的侵袭;其次,石斛多糖可通过抑制肿瘤细胞的生长而起到抗肿瘤作用。鲍丽娟等[53]比较了4 种石斛(霍山石斛、铁皮石斛、金钗石斛和马鞭石斛)水提物对人宫颈癌细胞株HeLaS3和肝癌HepG2细胞的体外抑制作用,结果表明4 种石斛水提物对HeLaS3细胞和HepG2细胞均有不同程度的细胞毒性作用,且在所选浓度范围内对剂量和时间有依赖性;4 种石斛水提物对HeLaS3细胞的半致死抑制浓度(the half maximal inhibitory concentration,IC50)分别是11.63、17.71、15.11 mg/mL和5.89 mg/mL,对HepG2细胞的IC50分别是10.40、22.95、3.80 mg/mL和17.76 mg/mL;激光扫描共聚焦显微观察HeLaS3和HepG2细胞,发现细胞正处于凋亡期,从而从形态学验证了其抑瘤作用。何铁光等[20]研究认为不同剂量(50、150、250 mg/kg)的铁皮石斛多糖能有效抑制接种了肝癌细胞(H22)的小鼠的体内成瘤能力,抑瘤率分别为28.6%、19.3%和15.7%;其中低剂量的抑瘤效果最好,并显著提高了胸腺和脾指数(P<0.05)。Wang Junhui等[54]进行金钗石斛多糖抗肿瘤研究,在小鼠体内Sarcoma 180肉瘤抑制实验中,水提粗多糖的抑制率为31.3%,粗多糖经过进一步纯化所分离的6 个组分(DNP-W1、DNP-W2、DNP-W3、DNP-W4、DNP-W5和DNP-W6)中,DNP-W1和DNP-W3组分具有较高的抑制率,可达65.3%与61.2%;在体外实验中,所有多糖组分都具有对人宫颈癌细胞株HL-60肿瘤细胞的抗增殖活性;此外,石斛多糖还可与其他抗癌剂或化疗药协同作用而起到抗肿瘤的效果。罗慧玲等[55]的研究结果显示DCP与rIL-2(重组IL2)联用可显著增强脐带血LAK(CB-LAK)和恶性肿瘤患者外周血LAK(PB-LAK)在体外对肿瘤细胞的杀伤活性(P<0.01及P<0.05),表明石斛多糖可作为生物反应调节剂用于LAK/rIL-2免疫治疗。因此,通过对石斛多糖的抗肿瘤药理活性的研究发现,石斛多糖的抗肿瘤主要是通过提高机体免疫能力、抑制肿瘤细胞的生长及与抗癌剂或化疗药协同增效等几种方式而起到抗肿瘤作用。
3.4 其他功能活性
石斛多糖除了具有提高免疫力、抗氧化、抗肿瘤的功能活性外,文献报道石斛多糖还具有降血糖[56]、保肝[57]、延缓白内障[58]、抗疲劳[59]及治疗慢性阻塞性肺疾病[60]等作用。如Pan Lihua等[56]比较了DHP、DNP、DOP及DNP 4 种石斛多糖对四氧嘧啶诱发的糖尿病小鼠模型的降血糖效果,研究发现:DHP、DOP、DNP 3 种多糖可显著降低糖尿病小鼠空腹血糖和糖化血清蛋白水平,同时提高血清胰岛素的水平;通过组织病理学实验发现DHP、DOP、DNP可修复或减缓胰岛的损伤,从而证实DHP、DOP、DNP具有降血糖的效果。Wang Xiaoyu等[57]通过代谢组学分析证实DHP对酒精性肝损伤具有预防干预效果。
4 结 语
随着石斛生理功效被越来越多的大众所认识,对石斛的研究也逐年增加,作为石斛中重要功能活性物质的石斛多糖的研究也取得了一定的进展。目前的研究主要集中在多糖的提取纯化、结构的鉴定及功能活性等方面。但在一些方面的研究还是相对较薄弱,如由于石斛品种比较多,目前开展的研究主要集中在铁皮石斛、霍山石斛、金钗石斛等少数几种石斛,对其他石斛的研究几乎很少甚至没有;对多糖的提取分离虽进行了较多研究,但对石斛多糖的工业化提取纯化工艺的研究相对较少;由于多糖高级结构的复杂性,对多糖高级结构的鉴定研究目前开展也不是很深入;对多糖结构与功能活性之间的关系研究也相对较少;此外,对于石斛多糖的生理功效方面,更多的毒理学实验及临床实验也需进一步开展。
