原花青素A2肠道菌群代谢物及其抗氧化活性
2018-11-29杨光美李桐云张玉莹杨瑞丽
杨光美,李桐云,张玉莹,杨瑞丽,李 武*
(1.海南大学食品学院,海南 海口 570228;2.广东省食品质量安全重点实验室,华南农业大学食品学院,广东 广州 510642)
原花青素是一类由儿茶素和(或)表儿茶素为单位聚合而成的多酚化合物,具有抗氧化[1]、抗炎[2]、降血糖[3]、降血脂[4]、抗动脉粥样硬化[5]等多种生物活性。原花青素根据其单体聚合度(degree of polymerization,DP)可以分为单体(DP=1)、寡聚体(DP=2~10)和多聚体(DP>10);根据其组成单位间连接的方式可以分为A型和B型原花青素。其中,以C4-C8或C4-C6键(B键)为连接方式的原花青素为B型;除C4-C8或C4-C6键外,还具有C2-O-C7或C2-O-C5键(A键)连接的原花青素为A型。A型原花青素的结构组成相对于B型更为复杂。其中,原花青素A2(procyanidins A2,PCA2)是由表儿茶素聚合而成的A型原花青素二聚体,目前报道的主要来源有荔枝果皮[6]、花生红衣[7]、鳄梨[8]及蔓越莓[9]等。
研究发现,人体摄入的多酚约95%不能被小肠直接吸收,而是进入结肠,经肠道菌群代谢分解为更易被人体吸收的酚酸等小分子物质[10]。蓝莓原花青素肠道菌群代谢物能够显著提高巨噬细胞三磷酸腺苷结合盒转运体A1的表达,降低肿瘤坏死因子-α和白细胞介素-6的分泌[11]。鞣花单宁具有显著的抗氧化和抗炎症活性,但是鞣花单宁的消化吸收率极低,而其肠道菌群代谢物尿石酸容易吸收,同时也具有显著的抗氧化和抗炎症活性[12];(-)-表没食子儿茶素没食子酸酯的肠道菌群代谢物也显示出比其原型更高的抗氧化活性[13]。Appeldoorn等[14]采用大鼠原位肠道灌流发现,PCA2的直接吸收率只有0.1%。原花青素肠道菌群代谢物可能在其生物活性作用过程中起着重要的作用[15]。因此,明确PCA2肠道菌群代谢物的组成与活性,可能对于阐明原花青素生物活性作用机制具有重要意义。Engemann等[16]的研究显示PCA2的猪肠道菌群代谢物主要为3-(4-羟苯基)丙酸和3-(3-羟苯基)丙酸;但是其代谢产物的活性分析鲜见报道。因此,本实验采用超高效液相色谱-四极杆-飞行时间串联质谱联用(ultra performance liquid chromatographyquadrupole-time-of-flight-tandem mass spectrometry,UPLC-Q-TOF-MS/MS)仪对PCA2肠道菌群代谢物的组成进行了分析,并比较了其代谢产物的抗氧化活性,结果可以为原花青素肠道菌群代谢物的组成与活性研究,以及原花青素的开发利用提供依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级SD雄性大鼠,购于广东省动物实验中心(许可证编号:SYXK(粤)2014-0136)。
新鲜荔枝(品种:怀枝,产期2016年),购于广州从化荔枝园;PCA2采用荔枝果皮为原料提取纯化获得,经高效液相色谱(high performance liquid chromatography,HPLC)检测其纯度为94.08%。
厌氧培养基 广州健阳生物技术有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS) 美国Sigma-Aldrich公司。
1.2 仪器与设备
LC-20A型HPLC仪 日本岛津公司;1290-6540 UPLC-MS联用仪 美国Agilent公司;YQY-1厌氧培养箱 上海跃进医疗器械有限公司;Multiskan Mk3型多功能酶标仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 PCA2体外肠道菌群代谢
参照Engemann等[16]的方法,将SD大鼠麻醉,解剖取盲肠、结肠内容物,无菌生理盐水稀释(1∶4,m/V),4 层无菌纱布过滤,体积比1∶9接种于厌氧培养基,以灭菌样品作为对照。5.4 mL肠道菌悬液加入0.6 mL 0.3 mg/mL PCA2,混合均匀后,迅速吸取1.0 mL加入灭菌离心管,37 ℃厌氧培养。在培养0、6、12 h和24 h时取样,-80 ℃保存待测。
1.3.2 肠道菌群代谢物HPLC分析
样品加入等体积乙酸乙酯萃取3 次,合并酯相,氮气吹干后用1.0 mL甲醇溶解,0.22 μm滤膜过滤后进行HPLC分析。
HPLC分析条件:LC-20A型HPLC系统,SPD-20A检测器;InertSustain C18色谱柱(250 mm×4.6 mm,5 μm)。柱温30 ℃,上样体积20 μL,流速0.8 mL/min。流动相A:体积分数0.2%甲酸溶液,流动相B:乙腈。梯度洗脱程序:0~10 min,5%~15% B;10~20 min,1 5%~2 5% B;2 0~4 0 m i n,25%~45% B;40~50 min,45%~80% B。检测波长:280 nm。
1.3.3 肠道菌群代谢物UPLC-TOF-MS/MS分析
MS条件:ESI负离子源模式,毛细管电压3 500 V,碎片电压150 V,雾化压力65 Psi,干燥气体温度325 ℃,离子范围m/z 100~1 100。
1.3.4 肠道菌群代谢物抗氧化活性测定
各时间点样品采用等体积的乙酸乙酯萃取3 次,合并酯相氮气干燥,采用下述方法进行抗氧化活性分析。
1.3.4.1 T-AOC测定
参照T-AOC试剂盒步骤进行。抗氧化物质可以将Fe3+还原成Fe2+,后者与啡啉类物质形成稳定的络合物,520 nm波长处比色确定其抗氧化能力。
1.3.4.2 DPPH自由基清除率的测定
DPPH自由基清除率参照李斌等[17]的方法,配制2.5 mmol/L DPPH的无水乙醇储备液,4 ℃避光保存备用。使用时再用无水乙醇稀释,制备0.15 mmol/L的DPPH工作液。50 μL适当稀释的待测样品加入等体积的DPPH工作液,微量振荡器混匀后,避光反应30 min。515 nm波长处测定样品OD值(ODi);以无水乙醇代替DPPH溶液,其OD值记为OD0;以无水乙醇代替样品,其OD值记为ODj。按下式计算DPPH自由基清除率。

1.3.4.3 清除ABTS+•能力的测定
参照周瑞等[18]的方法,将ABTS(7 mmol/L,5 mL)和过硫酸钾溶液(140 mmol/L,88 μL)混合,室温避光反应12 h,制备ABTS+•储备液。检测时,储备液调整为OD734nm为0.70±0.02的工作液。20 μL适当稀释的样品中加入200 μL ABTS+•工作液,振荡混匀30 s,734 nm 波长处测定其OD值(ODi)。以同等体积的试剂(OD0)、无水乙醇(ODj)为对照。按1.3.4.2节公式计算其清除率。
1.4 数据统计分析
2 结果与分析
2.1 PCA2的肠道菌群代谢

图1 PCA2质量浓度随时间变化曲线Fig.1 Degradation curve of PCA2 by rat intestinal microflora
由图1可知,培养前6 h PCA2被肠道菌群代谢较快,6 h时PCA2的含量降低77.28%;6 h后PCA2的代谢速率开始下降,在12 h和24 h PCA2的含量分别降低84.99%和90.07%。灭活菌群培养24 h PCA2含量无明显变化。
2.2 肠道菌群代谢物HPLC分析
从图2可见,PCA与肠道菌群共培养6 h后,有8 种主要新化合物生成。在培养12 h时,化合物3、4、8的含量明显增加,而化合物7没有被检测到。培养24 h时,新生成化合物相对含量与12 h时相比无显著变化。

图2 PCA2在不同代谢时间的HPLC图Fig.2 HPLC analysis of PCA2 at different incubation times with rat intestinal microbiota
2.3 肠道菌群代谢物UPLC-Q-TOF-MS/MS分析
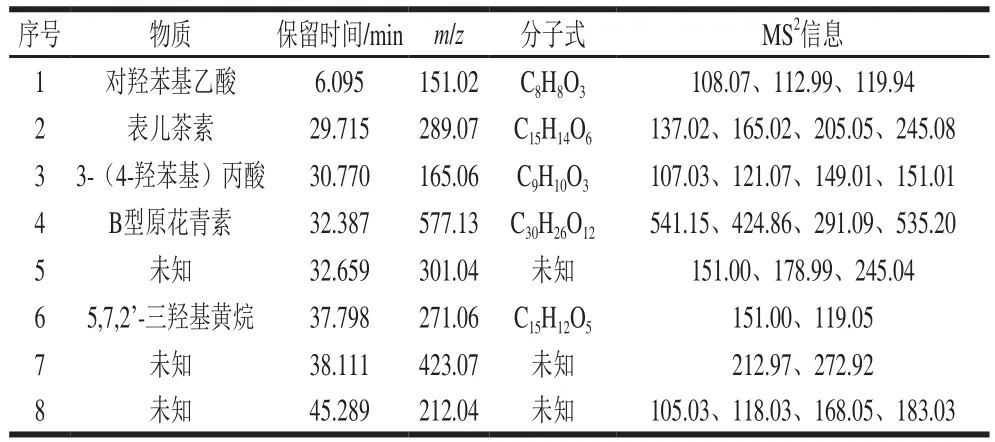
表 1 PCA2肠道菌群代谢物UPLC-Q-TOF-MS/MS结果Table1 PCA2 metabolites determined by UPLC-Q-TOF-MS/MS
经质谱数据库比对与分析的结果显示(表1),PCA2经肠道菌群代谢生成的化合物1的分子离子峰为151.02[M-H]-,主碎片峰分别为108.07、112.99、119.94,推断该化合物为对羟苯基乙酸。该化合物可能为PCA2中的C—O—C键断裂,产生B型原花青素中间产物,中间产物C—C键断裂,生成表儿茶素,表儿茶素A环裂解失去相对分子质量为44的[COO]-基团,同时发生β-氧化反应,生成分子离子峰为151.02[M-H]-的羟苯基乙酸化合物[19-20];van’t Slot等[21]的报道也显示,原花青素B2经肠道菌群代谢产生的151.02[M-H]-化合物为对羟苯基乙酸。
代谢物2的分子离子峰为289.07[M-H]-,碎片峰分别为137.02、165.02、205.05、245.08等。碎片峰137.02和165.02为表儿茶素C环1、3键断裂和1、2键断裂产生;碎片峰205.05为表儿茶素B环失去2个C2H2O基团产生;碎片峰245.08为表儿茶素A环失去[COO]-基团产生,推断该化合物为表儿茶素[22]。
代谢物3的分子离子峰为165.06[M-H]-,碎片峰分别为107.03、121.07、149.01、151.01等。其中,碎片峰149.01为该化合物失去氧原子产生,149.01[M-H]-为3-苯基丙酸的特征离子峰;碎片峰121.07为该化合物失去[COO]-基团产生,121.07[M-H]-为苯甲酸的特征离子峰。分子离子峰165.06[M-H]-为3-(4-羟苯基)丙酸的特征离子峰,碎片峰主要有121.07、107.05、151.01、138.02等[23-24]。文献显示,芒果和香蕉中的黄酮类和酚类物质经微生物代谢后生成3-(4-羟苯基)丙酸[25]。
代谢物峰4的分子离子峰为577.13[M-H]-,碎片峰分别为541.15、424.86、291.09、535.20等。该化合物相对于PCA2分子离子峰的m/z增加了2,由PCA2水解产生。碎片峰541.15为失去两分子H2O产生;碎片峰424.86为该化合物C环裂解发生逆狄尔斯-阿德尔(Retro Diels-Alder,RDA)反应失去C8H8O3的中性基团产生;碎片峰535.20为该化合物B环裂解失去C2H2O基团产生;291.09碎片峰为表儿茶素。577.20为B型原花青素二聚体的特征离子峰,常见的碎片峰有451.10、425.02、407.12和288.90[25]。推断PCA2经肠道菌群代谢,其C2—O—C7键发生断裂,生成B 型原花青素二聚体[26-27]。
代谢物6的分子离子峰为271.06[M-H]-,碎片峰分别为151.00、119.05。该化合物可能为PCA2 C2—O—C7键断裂生成表儿茶素,表儿茶素再失去一分子H2O产生。碎片峰151.00为该化合物A环断裂失去[COO]-基团,再失去一个苯环产生;碎片峰119.05为该化合物C环发生RDA反应,失去C8H8O3中性基团产生。质谱数据库比对与分析结果显示,该化合物是5,7,2’-三羟基黄烷。
代谢物峰5的分子离子峰为301.04[M-H]-,碎片峰分别为151.00、178.99、245.04。该分子离子峰为PCA2的C环发生RDA反应,失去相对分子质量为152的C8H8O3中性基团和一分子的苯环与[COO]-基团产生。代谢物峰7的分子离子峰为423.07[M-H]-,碎片峰分别为212.97、272.92等。分析为PCA2 C环发生RDA反应,失去C8H8O3中性基团产生。同时,HPLC的结果显示,该化合物在12 h和24 h消失(图2),推测该化合物作为中间产物降解生成其他物质。代谢物8的分子离子峰212.04[M-H]-,碎片峰分别为105.03、118.03、168.05、183.03等。其中,碎片峰168.05为失去[COO]-基团产生;推测该化合物为PCA2的C—O—C、C—C键断裂,生成表儿茶素单体中间产物,中间产物再失去一分子苯环产生。代谢产物5、7和8还有待进一步鉴定。
2.4 PCA2肠道菌群代谢物抗氧化活性
2.4.1 代谢产物的T-AOC

图3 PCA2肠道菌群代谢产物T-AOC的变化Fig.3 T-AOC of PCA2 before and after incubation with rat intestinal microbiota
如图3所示,随着培养时间的延长,PCA2肠道菌群代谢产物T-AOC呈现先增加后缓慢下降的趋势。6、12 h和24 h代谢产物的T-AOC均显著高于0 h(P<0.05),分别为0 h的2.01、1.96、1.71 倍;6 h与12 h代谢产物的T-AOC无显著差异;代谢24 h时,其产物T-AOC降低至6 h的84.53%。
2.4.2 DPPH自由基清除能力

图4 PCA2肠道菌群代谢产物DPPH自由基清除能力的变化Fig.4 DPPH radical scavenging capacity of PCA2 before and after incubation with rat intestinal microbiota
从图4可知,6、12 h和24 h代谢产物DPPH自由基清除能力均显著高于0 h(P<0.05),6 h DPPH自由基清除能力是0 h的2.16 倍,6、12、24 h代谢产物DPPH自由基清除能力无显著差异。
2.4.3 ABTS+•清除能力
从图5可知,随着代谢时间的延长,PCA2肠道菌群代谢物ABTS+•清除能力呈现先增强后下降的趋势。6、12、24 h代谢产物ABTS+•清除能力均显著高于0 h(P<0.05),分别为0 h的1.34、1.44、1.24 倍;代谢24 h时,其代谢产物ABTS+•清除能力分别降至6 h和12 h的92.35%和85.16%。

图5 PCA2肠道菌群代谢产物ABTS+·清除能力的变化Fig.5 ABTS+· scavenging capacity of PCA2 before and after incubation with rat intestinal microbiota
3 结 论
PCA2经肠道菌群体外代谢产生8 种新化合物,包括对羟苯基乙酸、表儿茶素、3-(4-羟苯基)丙酸、B型原花青素和5,7,2’-三羟基黄烷和3 种未知结构化合物。PCA2肠道菌群代谢产物的抗氧化能力显著高于PCA2,其中代谢6 h时,其T-AOC、DPPH自由基和ABTS+•清除能力分别提高了2.01、2.16、1.34 倍。肠道菌群代谢物可能在PCA2生物活性作用过程中发挥着重要的作用。
