辣木叶提取物的制备及抗氧化活性
2018-11-29赵谋明李巧琳林恋竹杨延清
赵谋明,李巧琳,林恋竹*,杨延清
(华南理工大学食品科学与工程学院,广东 广州 510640)
辣木(Moringa oleifera Lam.),原产于印度,是辣木科辣木属多年生热带落叶乔木,广泛种植于亚洲和非洲的热带和亚热带地区,在我国广东、广西、云南、福建、台湾等地引种栽培[1]。辣木作为一种新资源食品,具有环境适应性强、生长快速、营养丰富全面、生物活性多等优点[2-3],在印度传统医学中应用历史悠久,具有潜在的开发前景[4]。研究表明,辣木叶含有丰富的蛋白质(干叶粗蛋白质量分数27.0%~30.3%)[1-2],辣木叶中氨基酸种类丰富,共有19 种,以谷氨酸、天冬氨酸、苏氨酸、缬氨酸、丙氨酸含量较高[5]。同时,辣木叶富含多种矿物质、维生素、不饱和脂肪酸、糖苷及多酚类化合物、甾醇、生物碱等小分子活性物质[6-8]。辣木叶具有抗氧化[9]、抗菌[10]、抗病毒[11]、抗炎[12]、降血糖[13]、降血脂[14]、降血压[15-17]、抗肿瘤[18-19]、保护肝脏[20-21]、改善肾功能障碍[22]、抑制DNA氧化损伤[23]、调节肠道微生物[24]、抗溃疡[25]等多种生物活性。
在辣木资源的利用上,早期多集中在辣木传统的食用药用、饮水净化和作为植物蛋白饲料等方面,近年来开始注重辣木功能性成分的提取和保健食品的开发。然而,在辣木叶保健食品开发方面,目前国内仍处于以辣木叶粉、辣木叶汁、辣木叶蛋白为原料的简单产品添加阶段[1],缺乏对辣木叶精深加工技术的研究,限制了其高值化加工应用及市场推广。
本研究考察不同提取方法对辣木叶蛋白、糖类、多酚类物质提取率以及抗氧化剂溶出率的影响,以期获得蛋白、糖类、多酚含量高且抗氧化活性强的辣木叶提取物,为辣木叶高值化加工提供理论与方法的支持。
1 材料与方法
1.1 材料与试剂
辣木干叶 广东华谷辣木生物科技有限公司;Ns37071蛋白酶、木瓜蛋白酶、胰酶、复合蛋白酶 诺维信(中国)生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、水溶性VE(Trolox)、2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis(2-amidinopropane)dihydrochloride,AAPH)、荧光素钠、氯化硝基四氮唑蓝(nitroblue tetrazolium,NBT)、黄嘌呤、黄嘌呤氧化酶 美国Sigma公司;乙酸乙酯、无水乙醇、二甲基亚砜、浓硫酸(均为分析纯) 富宇化学有限公司;其他试剂均为分析纯。
1.2 仪器与设备
DFY-500型摇摆式高速中药粉碎机 温岭市林大机械有限公司;LDZX-50KBS型立式压力蒸汽灭菌锅 上海申安医疗器械厂;UH-150A型超声波清洗器 天津奥特赛恩斯仪器有限公司;THZ-82A型恒温振荡器 常州澳华仪器有限公司;RE-2000B型旋转蒸发仪 上海亚荣生化仪器厂;pH计 梅特勒-托利多仪器(上海)有限公司;KND-2C型定氮仪 上海纤检仪器有限公司;HSG-IIB-6型电热恒温水浴锅 上海仪表集团;UV-754型紫外-可见分光光度计 上海精密科学仪器有限公司;Varioskan Flash型酶标仪 美国Thermo公司。
1.3 方法
1.3.1 辣木叶提取物的制备
辣木干叶于60 ℃烘箱中烘2 h至恒质量,粉碎,得辣木干叶粉。按以下方法进行提取,所得提取液浓缩后定容至100 mL,4 ℃保存。
1.3.1.1 水/乙醇提取
高温水提取:称取辣木干叶粉(20 g),按料液比1∶10(m/V)加入去离子水,105 ℃高温下处理2 h,离心取上清液,残渣按上述方法提取2 次,合并上清液。
超声辅助水提取:称取辣木干叶粉(20 g),按料液比1∶10(m/V)加入去离子水,55 ℃、800 W超声提取40 min,离心取上清液,残渣按上述方法提取2 次,合并上清液。
超声辅助乙醇提取:称取辣木干叶粉(20 g),按料液比1∶10(m/V)加入体积分数80%乙醇溶液,55 ℃、800 W超声提取40 min,离心取上清液,残渣按上述方法提取2 次,合并上清液。
中温水提取:称取辣木干叶粉(20 g),按料液比1∶10(m/V)加入去离子水,55 ℃提取3 h,离心取上清液,残渣按上述方法提取2 次,合并上清液。
1.3.1.2 酶法提取
称取辣木干叶粉(20 g),按料液比1∶10(m/V)加入去离子水,调节pH值,55 ℃孵育30 min。按3 000 U/g蛋白分别加入Ns37071蛋白酶、木瓜蛋白酶、胰酶、复合蛋白酶,55 ℃酶解8 h,95 ℃、15 min高温灭酶,离心取上清液。
1.3.1.3 酶法耦合乙醇提取
称取辣木干叶粉(20 g),按料液比1∶10(m/V)加入去离子水,调节pH值,55 ℃孵育30 min。按3 000 U/g蛋白分别加入Ns37071蛋白酶、木瓜蛋白酶、胰酶、复合蛋白酶,55 ℃酶解8 h,加入乙醇调节至乙醇体积分数为30%,回流提取30 min,离心取上清液。
1.3.1.4 酶解提取后残渣超声辅助乙醇提取
取1.3.1.2节酶法提取后余下的辣木叶渣,按料液比1∶10(m/V)加入体积分数80%乙醇溶液,55 ℃、800 W超声提取40 min,离心取上清液。
1.3.2 辣木叶提取物的分级萃取
取1.3.1节所得辣木干叶提取物5 mL,等体积加入乙酸乙酯,萃取3 次,合并乙酸乙酯相,旋转蒸发至干,以二甲基亚砜定容至1 mL,得乙酸乙酯相,剩余部分用蒸馏水定容至5 mL,得水相。
1.3.3 蛋白、总糖、总酚质量分数测定
1.3.3.1 蛋白质量分数测定
参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,采用凯氏定氮法测定,计算各提取方法的蛋白提取率(式(1))。

1.3.3.2 总糖含量测定
参考GB/T 15672—2009《食用菌中总糖含量的测定》,采用苯酚-硫酸法测定。取适合质量浓度样品1 mL,加1 mL去离子水摇匀,加入1 mL 6 g/100 mL苯酚,马上加入5 mL浓硫酸,摇匀,室温反应40 min,于490 nm波长处测吸光度。配制质量浓度分别为0.01、0.02、0.04、0.06、0.08、0.10 mg/mL的葡萄糖溶液,按以上步骤测定其490 nm波长处吸光度,绘制标准曲线。样品总糖含量以葡萄糖质量表示,计算各提取方法的糖类物质提取率(式(2))。

1.3.3.3 总酚含量测定
采用福林-酚法[26]测定总酚。取适合质量浓度样品1 mL,加5 mL去离子水摇匀,加入0.5 mL福林-酚、在1~8 min内加入1.5 mL 质量分数20%的Na2CO3溶液,加2 mL去离子水定容至10 mL,摇匀,40 ℃孵育2 h,于760 nm波长处测吸光度。配制质量浓度分别为0.01、0.02、0.04、0.05、0.06、0.08、0.10 mg/mL的没食子酸溶液,按以上步骤测定其760 nm波长处吸光度,绘制标准曲线。样品总酚含量以没食子酸质量表示,计算各提取方法的多酚类物质提取率(式(3))。
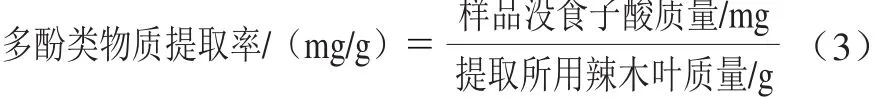
1.3.4 体外抗氧化活性测定
1.3.4.1 DPPH自由基清除能力
取适合质量浓度样品2 mL,加2mL DPPH无水乙醇溶液(0.2 mmol/L),摇匀,室温下暗处静置30 min,以无水乙醇调零,于517 nm波长处测吸光度。用无水乙醇配制浓度分别为0.02、0.04、0.06、0.08、0.10 mmol/L的Trolox溶液,按以上步骤测定其517 nm波长处吸光度,计算DPPH自由基清除率。以Trolox浓度为横坐标,DPPH清除率为纵坐标绘制标准曲线。样品DPPH自由基清除能力以Trolox当量表示,计算各提取方法的DPPH自由基清除剂溶出率(式(4))。

1.3.4.2 氧化自由基吸收能力
以75 mmol/L pH 7.4磷酸盐缓冲液配制所需浓度的样品、Trolox、荧光素钠以及AAPH。于96 孔板中依次加入适合质量浓度样品20 μL、120 μL荧光素钠(70 nmol/L),于酶标仪中混匀,37 ℃孵育15 min,迅速加入60 μL AAPH(40 mmol/L),于酶标仪中混匀并开始测定荧光强度(f0)。荧光强度为激发波长485 nm、吸收波长520 nm,每1 min测定1 次,共读数121 次。荧光强度分别记为f0、f1、f2……、f120,将每次读数连成曲线,每个样品3 个复孔。磷酸盐缓冲液为试剂空白。根据公式(5)计算曲线下面积(area under curve,AUC)(荧光猝灭面积)。

配制浓度为0.02、0.04、0.06、0.08、0.10 mmol/L的Trolox溶液,按以上步骤测定样品AUC(AUC样品)和空白AUC(AUC空白),计算其相应Net AUC(式(6))。以Trolox浓度为横坐标,Net AUC为纵坐标绘制标准曲线。样品氧化自由基吸收能力以Trolox当量表示,计算各提取方法的氧化自由基吸收剂溶出率(式(7))。

1.3.4.3 超氧阴离子自由基清除能力
以0.2 mmol/L pH 7.4磷酸盐缓冲液配制所需剂量的样品、Trolox、NBT、黄嘌呤以及黄嘌呤氧化酶。于96 孔板中依次加入50 μL适合质量浓度样品、50 μL黄嘌呤(1 mmol/L)、60 μL NBT(2 mmol/L)、50 μL黄嘌呤氧化酶(0.05 U/mL),于酶标仪中混匀,37 ℃孵育30 min,于560 nm波长处测定其吸光度,计算超氧阴离子自由基清除率。配制浓度为2.5、5.0、7.5、10.0、12.5、15.0、17.5、20.0 mmol/L的Trolox溶液,以Trolox浓度为横坐标,超氧阴离子自由基清除率为纵坐标绘制标准曲线。样品超氧阴离子自由基清除能力以Trolox当量表示,计算各提取方法的超氧阴离子清除剂溶出率(式(8))。

1.4 数据分析
2 结果与分析
2.1 不同提取方式对辣木叶蛋白提取率的影响
经测定,辣木干叶粉蛋白质量分数为(33.11±0.36)%。不同提取方式对辣木叶蛋白提取率的影响如表1所示。采用超声辅助乙醇提取法所制得的辣木叶提取物中蛋白提取率较低(20.37%);采用水提法时,辣木叶蛋白提取率有所提高(29.32%~36.17%);采用酶法和酶法耦合乙醇提取可显著提高辣木叶蛋白提取率,其中以Ns37071蛋白酶、胰酶提取所制得的辣木叶提取物蛋白提取率最高。采用超声辅助乙醇提取酶解提取后残渣,所得提取物中蛋白提取率最低(3.66%~4.55%),说明采用酶法可高效提取辣木叶蛋白。采用乙酸乙酯萃取辣木叶提取物,所得水相蛋白提取率与总提取物无显著性差异,表明蛋白(水解蛋白)均在水相中,而乙酸乙酯相不含蛋白(水解蛋白)。

表1 不同提取方式对辣木叶蛋白提取率的影响Table1 Effects of different extraction methods on the yield of proteins
2.2 不同提取方式对辣木叶糖类物质提取率的影响
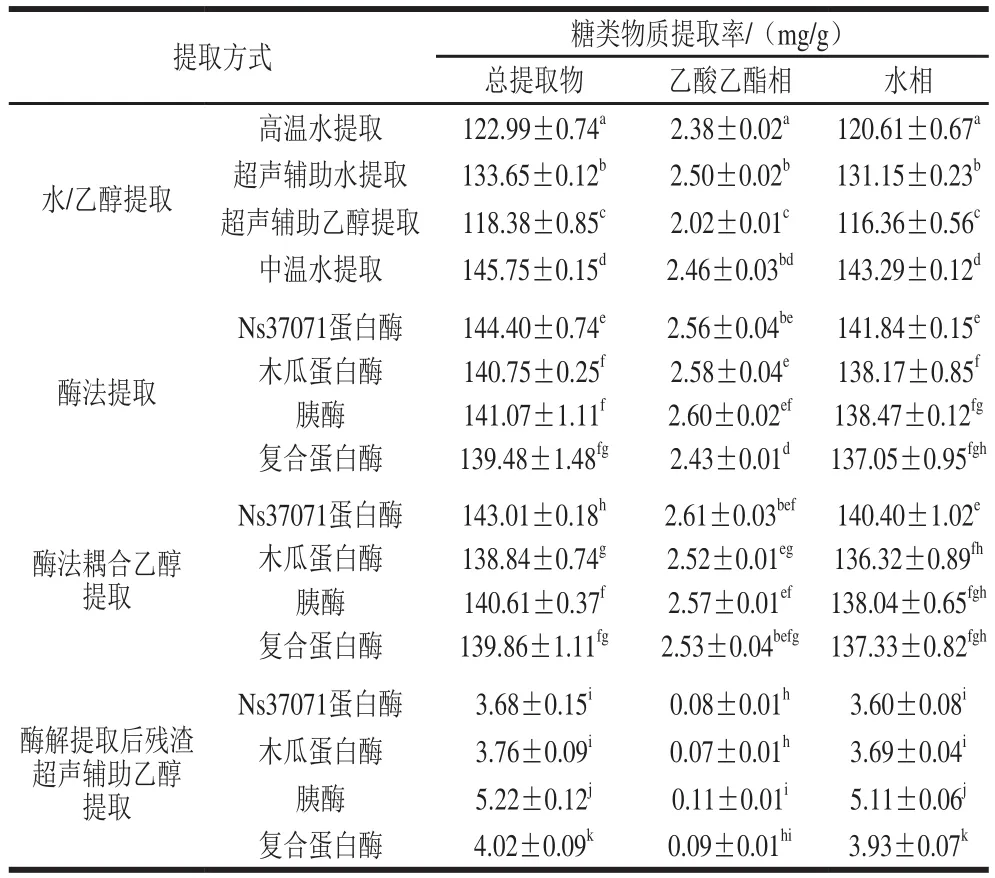
表2 不同提取方式对辣木叶糖类物质提取率的影响Table2 Effects of different extraction methods on the yield of saccharides
不同提取方式对辣木叶糖类物质提取率的影响如表2所示。采用水提法和酶法所制得的辣木叶提取物中糖类物质的提取率最高,采用乙醇提取时,糖类物质提取率较低。糖类物质的水溶性好,因此采用水提法可获得含糖量高的辣木叶提取物。采用超声辅助乙醇提取酶解提取后残渣,所得提取物中糖类物质提取率最低,说明采用水提法可高效提取辣木叶糖类物质。采用乙酸乙酯萃取辣木叶提取物,所得水相糖类物质提取率与总提取物无显著性差异,表明糖类物质均在水相中,而乙酸乙酯相不含糖类物质。
2.3 不同提取方式对辣木叶多酚类物质提取率的影响

表3 不同提取方式对辣木叶多酚类物质提取率的影响Table3 Effects of different extraction methods on the yield of phenolics
不同提取方式对辣木叶多酚类物质提取率的影响如表3所示。本研究中采用福林-酚法测定提取物中多酚含量。福林-酚法是基于电子转移机制的一种测定方法,具有还原能力的多酚类物质、蛋白(水解蛋白)、糖类物质均可与福林-酚试剂反应。辣木叶提取物中蛋白、糖类物质含量丰富,采用该方法测定总提取物中多酚含量时,会使得结果偏高。结果表明:水相多酚类物质提取率较高,而乙酸乙酯相多酚提取率相对较低。而根据2.1节和2.2节的研究结果,蛋白(水解蛋白)以及糖类物质不存在于乙酸乙酯相中,因此,乙酸乙酯相中的物质应为以多酚类物质为主的小分子活性物质。水相中的物质主要是蛋白(水解蛋白)以及糖类物质。
采用水提法时,提取物中多酚提取率为17.85~19.27 mg没食子酸/g辣木叶;采用超声辅助乙醇提取时,总提取物中多酚提取率较超声辅助水提取并无显著性提高。采用酶法和酶法耦合乙醇提取可显著提高辣木叶多酚提取率,其中以Ns37071蛋白酶、胰酶所制得的辣木叶提取物多酚提取率最高,这主要是因为采用酶法和酶法耦合乙醇提取可高效提取辣木叶中蛋白(水解蛋白)与糖类物质。采用超声辅助乙醇提取酶解提取后残渣,所得提取物中多酚类物质提取率最低,说明采用酶法可高效提取辣木叶多酚类物质。此外,采用超声辅助乙醇提取法以及酶法耦合乙醇提取法可显著提高乙酸乙酯相中多酚提取率,这与多酚为脂溶性物质,易溶于乙醇有关。综上所述,采用酶法耦合乙醇提取法,可以制备得到蛋白(水解蛋白)、糖类、多酚类物质含量高的辣木叶提取物。
2.4 不同提取方式对辣木叶中DPPH自由基清除剂溶出率的影响

表4 不同提取方式对辣木叶中DPPH自由基清除剂溶出率的影响Table4 Effects of different extraction methods on the yield of DPPH radical scavenger
DPPH自由基法是基于电子转移机制的一种快速评价样品还原能力的方法,所得样品DPPH自由基清除能力能够间接反映样品的抗氧化能力[27]。近年来,越来越多的研究结果证实了蛋白水解物(多肽)、多糖以及多酚类物质的抗氧化活性,使得多肽、多糖、多酚类物质成为众所周知的功能性因子[28-30]。2.1~2.3节研究结果表明辣木叶提取物富含蛋白、糖类以及多酚类物质。不同提取方式对辣木叶中DPPH自由基清除剂溶出率的影响如表4所示。采用酶法耦合乙醇提取时,DPPH自由基清除剂溶出率最高,其中,采用Ns37071蛋白酶和胰酶时,所得提取物中DPPH自由基清除剂溶出率最高。这是因为:采用酶法所制备的提取物中蛋白(水解蛋白)以及糖类物质含量最高;采用酶法耦合乙醇提取法所制备的提取物中蛋白(水解蛋白)、糖类、多酚类物质含量最高。采用乙酸乙酯萃取,将辣木叶提取物分为乙酸乙酯相以及水相,可以看出,水相中DPPH自由基清除剂溶出率远高于乙酸乙酯相,说明蛋白(水解蛋白)以及糖类物质对辣木叶提取物DPPH自由基清除活性的贡献大于多酚类物质。乙酸乙酯相以及水相中DPPH自由基清除剂溶出率的加和值远低于实测值(辣木叶总提取物的DPPH自由基清除剂溶出率),说明蛋白(水解蛋白)、糖类、多酚类物质三者的协同作用对于辣木叶DPPH自由基清除活性的发挥起到至关重要的作用。
2.5 不同提取方式对辣木叶中氧化自由基吸收剂溶出率的影响
氧化自由基吸收能力法是基于质子转移机制的一种普遍使用的抗氧化能力评价方法,能够准确反映样品对氧化自由基的吸收能力[27]。本实验研究了不同提取方式对辣木叶中氧化自由基吸收剂溶出率的影响,结果如表5所示。采用酶法耦合乙醇提取时,氧化自由基吸收剂溶出率最高,其中,采用Ns37071蛋白酶和胰酶时,所得提取物中氧化自由基吸收剂溶出率最高。水相中氧化自由基吸收剂溶出率远高于乙酸乙酯相,说明蛋白(水解蛋白)以及糖类物质对辣木叶提取物氧化自由基吸收活性的贡献大于多酚类物质。乙酸乙酯相以及水相中氧化自由基吸收剂溶出率的加和值低于或高于实测值(辣木叶总提取物的氧化自由基吸收剂溶出率),说明对于辣木叶提取物的氧化自由基吸收活性,提取物中蛋白(水解蛋白)、糖类、多酚类物质存在协同增效或拮抗作用。
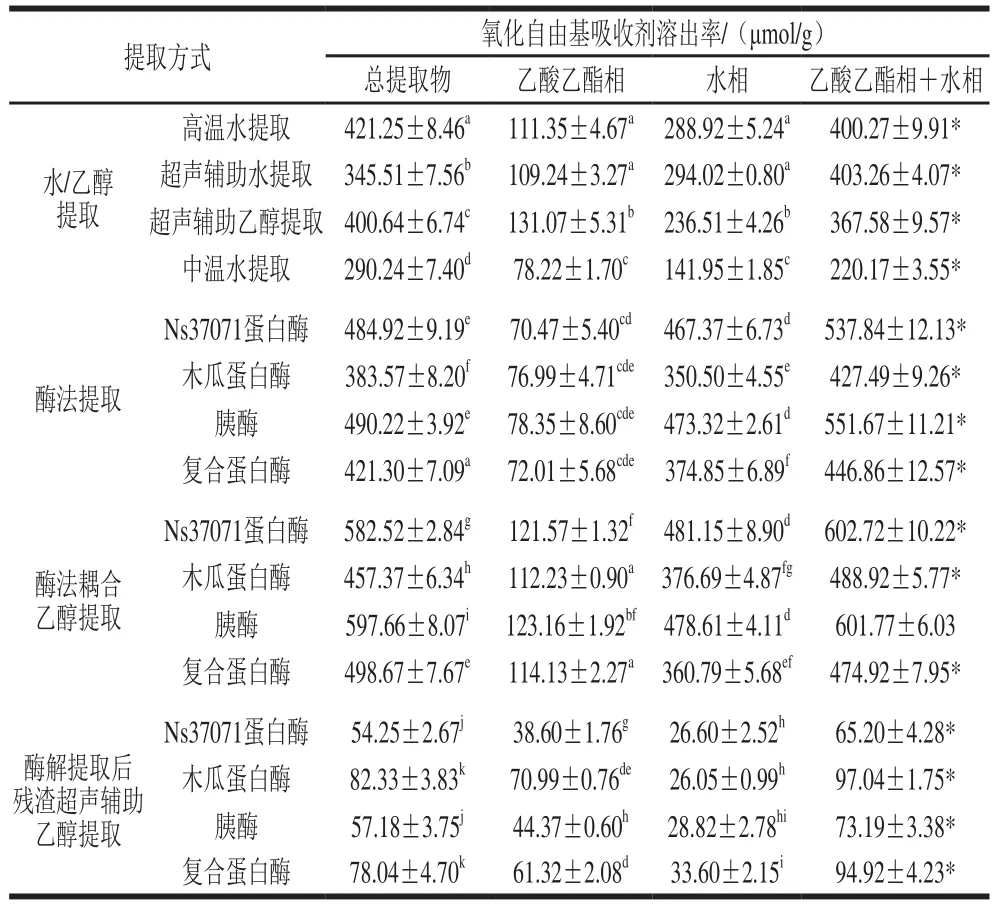
表5 不同提取方式对辣木叶中氧化自由基吸收剂溶出率的影响Table5 Effects of different extraction methods on the yield of oxygen radical absorbent
2.6 不同提取方式对辣木叶中超氧阴离子自由基清除剂溶出率的影响
本实验研究了不同提取方式对辣木叶中超氧阴离子自由基清除剂溶出率的影响,结果如表6所示。采用水提法以及酶法、酶法耦合乙醇提取时,辣木叶中超氧阴离子自由基清除剂溶出率较高,尤其是以高温水提法所制得提取物中超氧阴离子自由基清除剂溶出率最高。水相中超氧阴离子自由基清除剂溶出率远高于乙酸乙酯相。说明蛋白(水解蛋白)以及糖类物质对辣木叶提取物超氧阴离子自由基清除活性的贡献大于多酚类物质。乙酸乙酯相以及水相中超氧阴离子自由基清除剂溶出率的加和值低于或高于实测值(辣木叶总提取物的超氧阴离子自由基清除剂溶出率),说明对于辣木叶提取物的超氧阴离子自由基清除活性,提取物中蛋白(水解蛋白)、糖类、多酚类物质存在协同增效或拮抗作用。

表6 不同提取方式对辣木叶中超氧阴离子自由基清除剂溶出率的影响Table6 Effects of different extraction methods on the yield of superoxide radical scavenger
3 结 论
采用酶法和酶法耦合乙醇提取法,可以制备得到蛋白(水解蛋白)、糖类和多酚类物质含量高且抗氧化活性强的辣木叶提取物。采用Ns37071蛋白酶、胰酶时,所得辣木叶提取物蛋白、糖类、多酚类物质提取率最高,抗氧化活性最强。
蛋白(水解蛋白)以及糖类物质对辣木叶提取物抗氧化活性的贡献大于多酚类物质,蛋白(水解蛋白)以及糖类物质是辣木叶提取物发挥抗氧化活性重要的物质基础。此外,辣木叶提取物中蛋白(水解蛋白)、糖类、多酚类物质存在协同增效或拮抗作用。
