四川地区山羊源沙门菌的分离鉴定及耐药性分析
2018-11-29张毅王英黄忍李英林邵靓赵尊福
张毅 ,王英 ,黄忍 ,李英林 ,邵靓 ,赵尊福
(1.四川省动物疫病预防控制中心,四川 成都 610041;2.西南民族大学生命科学与技术学院,四川 成都 610041;3.四川省凉山州动物疫病预防控制中心,四川 西昌 615000)
沙门菌是一种革兰氏阴性杆菌,是最常见的人畜共患食源性致病菌之一。沙门菌引起的细菌性食物中毒高达70%~80%[1],消费者食用感染沙门菌的食物后,常表现出呕吐、腹泻、恶心、持续高热等症状[2]。目前国内对沙门菌的研究多集中在禽类及猪、牛等动物上,而鲜有关于山羊源沙门菌的报道。
沙门菌对各年龄段的山羊都能致病,对羔羊的危害最严重,临床上主要以败血症、胃肠炎、下痢为主要特征。王晶晶等[3]对四川省部分地区表观健康山羊的粪便进行了沙门菌的分离鉴定,结果显示山羊沙门菌的平均带菌率高达54.59%。山羊携带沙门菌不仅仅导致自身发病,还会污染山羊的奶制品、肉制品,引发食源性中毒。本研究对四川地区226份山羊粪便样本进行了沙门菌的分离鉴定,并对分离出来的菌株进行药敏分析,旨在了解四川地区山羊沙门菌的携带情况及耐药情况。
1 材料
1.1 菌株 本试验所用沙门菌(Salmonella)标准株CVCC528由西南民族大学动物医学实验室保存。
1.2 样本来源 从四川乐至、南江、金堂、青白江、攀枝花5个地区采集了158份山羊腹泻粪便样本和68份健康山羊粪便样本,共计226份(表1)。
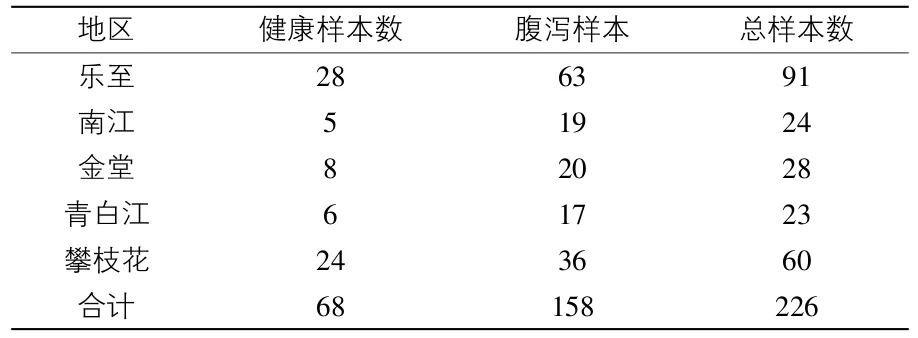
表1 山羊粪便样本来源 份
1.3 主要试剂 Premix Taq、DL2000 DNA Marker,均购自TaKaRa公司;BPW培养基、SS琼脂培养基、四硫磺酸钠亮绿培养基(TTB),均购自青岛海博生物技术有限公司;电泳琼脂糖,购至OXOID公司;头孢拉定、头孢噻吩、氨苄青霉素、头孢噻肟、阿莫西林、链霉素、庆大霉素、卡那霉素、罗红霉素、大观霉素、四环素、氟苯尼考、恩诺沙星、环丙沙星、复方新诺明、万古霉素、替考拉宁和丁胺卡那霉素18种药敏片,购自杭州微生物试剂有限公司。
1.4 引物合成 引物为参考文献[4]中的一对特异性检测沙门菌invA基因的引物,上游引物:5′-GTGAAA TTATCGCCACGTTCGGGCAA-3′,下游引物:5′-TCAT CGCACCGTCAAACCAACC-3′,引物长度为289 bp,由生工生物工程有限公司合成。
2 方法
2.1 细菌的分离纯化 取约1g粪便样品用无菌生理盐水稀释至1mL,充分振荡混匀后取500μL接种于BPW增菌液中,37℃恒温培养24 h;然后取1mL BPW增菌液接种于10mL TTB选择性增菌液中,37℃恒温培养24h,无菌环境下划线接种于SS琼脂培养基平板,37℃恒温培养24h;观察菌落形态,挑取疑似沙门菌菌落进行纯培养。
2.2 分离菌的PCR鉴定 先用酚氯仿法提取分离菌DNA,再用特异性PCR对分离菌进行鉴定。PCR反应体系(20μL):DNA模板2μL,上、下游引物各1μL,Premix Taq 10μL,ddH2O 6μL;PCR 反应条件:95℃预变性 5 min;95℃变性 30 s,58℃退火 30 s,72℃延伸40s,共40个循环;72℃再延伸10min。PCR产物经1.8%琼脂糖凝胶电泳,观察并随机抽取4份PCR阳性产物送生工生物工程有限公司测序,再将测序结果在GenBank上比对。
2.3 药敏分析 参照美国临床实验室标准化委员会(NCCLS)2009年药敏试验标准,采用纸片扩散法对分离菌进行药敏分析。取0.5麦氏单位菌液(含菌量为 1×105~2×105CFU/mL)500μL,均匀涂布于 MH 药敏琼脂平板上,贴上药敏片,37℃恒温培养18h后测定抑菌圈直径。
3 结果
3.1 细菌分离鉴定结果 结果显示:158份腹泻粪便样本中,沙门菌的分离率为15.2%(34/158);68份健康粪便样本中,沙门菌的分离率为11.8%(8/68);样本总分离率为14.2%(32/226)(表2)。随机抽取4份PCR阳性产物测序结果与GenBank Blast比对,证实是沙门菌invA基因特异性片段。
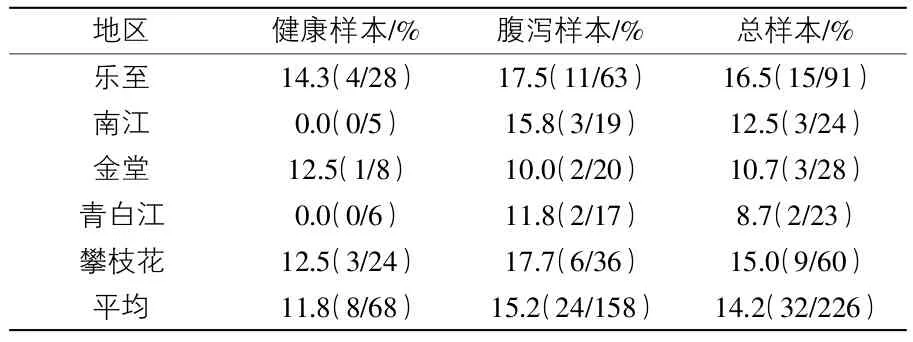
表2 226份粪便样本中沙门菌的检出率
3.2 药敏试验结果 所分离的32株沙门菌对头孢拉定、头孢噻吩、头孢噻肟、庆大霉素、大观霉素和丁胺卡那霉素的敏感率均为100%,对卡那霉素、恩诺沙星、环丙沙星、复方新诺明和替考拉宁有不同的耐药性(耐药率为21.9%~78.1%),对四环素、链霉素、罗红霉素、氟苯尼考、万古霉素、氨苄西林和阿莫西林完全不敏感(表3)。
4 讨论
目前检测沙门菌的目标基因有invA、ompC、ssrA、sefA、pefA等,特异性最强的有sefA、pefA和invA。sefA和pefA是检测鼠伤寒沙门菌和肠炎沙门菌的特异性基因,腹泻粪便中沙门菌的血清型很多,为防止漏检,需采用沙门菌属共有的特异性基因为目标基因,而invA基因序列为沙门菌属所共有。本研究选择沙门菌的侵袭蛋白基因invA为目标基因,合成一对特异性引物,然后对分离的沙门菌进行PCR鉴定,特异性好,鉴定结果可靠。
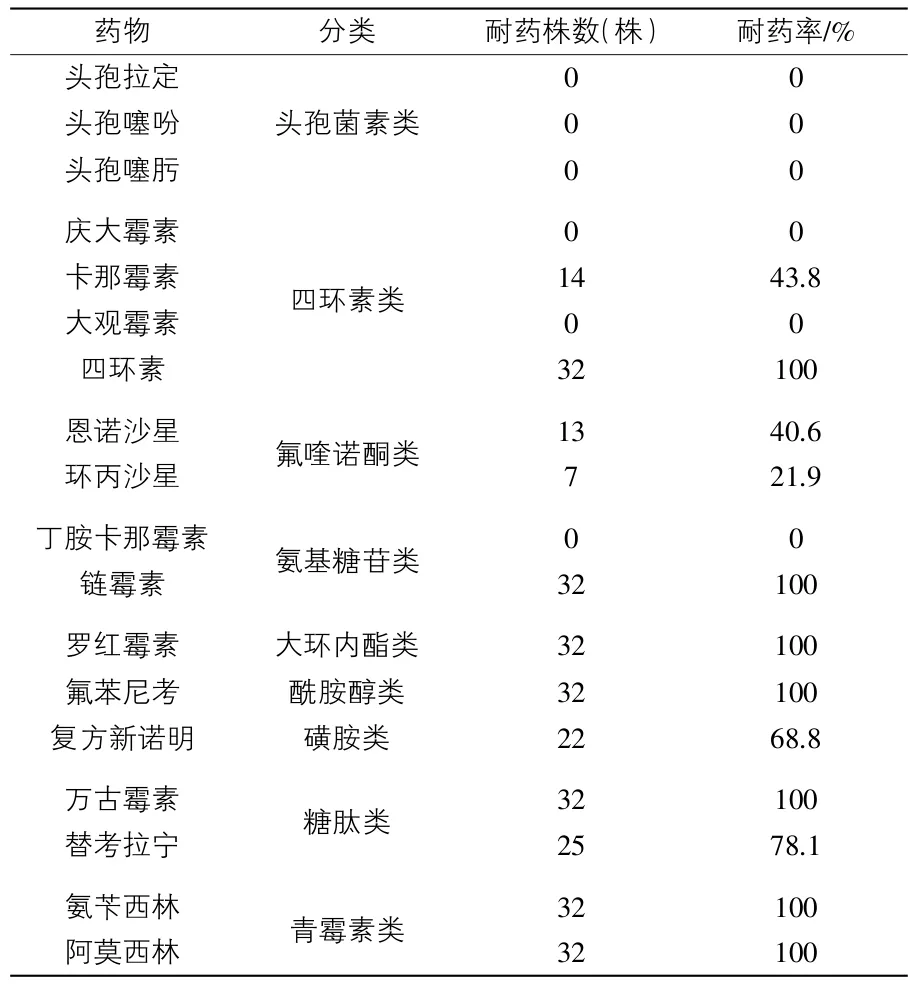
表3 32株沙门菌的耐药性试验结果
沙门菌的耐药机制主要包括基因突变引起的耐药、细菌外排作用引起的耐药、质粒介导的耐药等[5]。因基因突变引起沙门菌产生耐药性主要体现在两方面:抗生素靶基因突变与基因错配修复系统突变。沙门菌通过改变抗生素靶基因表达产物的空间结构而使抗菌药物无法识别位点,从而产生耐药性[6]。目前,喹诺酮类药物是临床上治疗肠道致病菌感染的首选药物,但Rushdy A A等[7]研究报道:27000株沙门菌分离株中,有13%对氟喹诺酮类药物耐药。本研究分离的沙门菌对氟喹诺酮类药物的耐药率高于Rushdy A A等的报道。耐药性的产生还与临床上抗生素的不规范使用,以及质粒携带的耐药基因扩散耐药性有关[8]。
