丝素蛋白/聚乙烯醇复合膜的制备及其表征
2018-11-28王宗乾杨海伟汤立洋李长龙
王宗乾, 杨海伟, 汤立洋, 李长龙
(安徽工程大学 安徽省纺织面料重点实验室, 安徽 芜湖 241000)
丝素蛋白(SF)是一种性能优良的天然高分子材料,其加工制备的丝素蛋白膜具有良好的生物相容性,可控的生物降解性以及优异的透光和绝缘性能,现已广泛应用在药物缓释[1]、组织工程[2]以及光电材料[3]等领域。丝素蛋白膜已成为丝素蛋白最为重要的应用载体之一,然而单一组分的丝素蛋白膜分子构象主要为不稳定的无规则卷曲结构,导致其柔韧度差、易脆损、强度差等缺点,严重限制了丝素蛋白膜的应用[4-5]。相关研究表明,将丝素蛋白与其他高分子材料(如聚乙烯醇、水溶性聚氨酯、海藻酸钠等)共混成膜,可提高丝素蛋白复合膜的柔韧性等[6-8]。聚乙烯醇(PVA)是一种易成膜的高聚物,具有无毒、可降解性,同时具备优良的亲水性能,因此,开发PVA与SF复合膜具有较好的应用前景。孙东豪等[9]采用水溶体系将SF与PVA共混成膜,发现二者相容性较差,各组分之间主要为物理融合。为提升SF与PVA之间的相容性,向共混体系中添加甲醛、戊二醛等交联剂是一种常用方法,但上述交联剂均具有一定的毒性,并残留在复合材料中,严重降低了复合材料的生物相容性能[10-11]。
近年来,离子液体作为绿色溶剂受到广泛关注[12-13]。其中,离子液体突破了传统溶剂对天然高分子材料和高聚物的溶解限制,实现了多种材料的共混,其溶液可直接用于成膜等再生材料的制备,已被广泛应用。张猛等[14]开展了离子液体法制备再生纤维素与角蛋白共混膜的研究,结果表明共混膜具有较高的热稳定性;刘华丽等[15]采用离子液体氯化1-丁基-3-甲基咪唑([Bmim]Cl)和水2种溶剂分别溶解丝素蛋白和聚乙烯醇,经共混制备了SF/PVA复合膜,但水溶剂的使用导致离子液体回收难度加大,甚至无法回收再利用,造成资源浪费,同时2种溶剂共混成膜同样影响了组分之间的相容性。已有文献表明咪唑类离子液体在溶解蛋白质方面具有明显优势[16];本课题组前期合成了1-烯丙基-3-甲基咪唑氯盐([Amim]Cl)离子液体[17],发现该离子液体对蛋白质、纤维素等聚合物均具有良好的溶解性。为此,本文采用[Amim]Cl离子液体共溶法制备SF/PVA复合膜,探讨离子液体共溶法制备复合膜技术的可行性,并对所制备复合膜的结构和性能进行了测试表征。
1 实验部分
1.1 实验材料与化学药剂
电力纺蚕丝织物(面密度为65 g/m2),淄博大染纺丝绸公司;聚乙烯醇(PVA,聚合度为1 700,醇解度为98%~99%)、甲醇,均为分析纯,上海阿拉丁试剂有限公司;1-烯丙基-3-甲基咪唑氯盐([Amim]Cl)离子液体,实验室自制,纯度大于99%。
1.2 实验仪器
Lambda 950型紫外分光光度计,美国PerkinElmer公司;DSA-25型光学接触角测量仪,瑞典ThetaBiolin公司;DCAT-11型表面张力仪,德国Dataphysics公司;D8系列X射线衍射仪,德国Bruker公司;S-4800型扫描电子显微镜,日本日立公司;IR Prestige-2型傅里叶红外光谱仪,日本岛津公司;ZN-P型紫外灯耐气候试验箱,南京环科公司;YG(B)026G-250型电子织物强力机,温州大荣纺织仪器有限公司。
1.3 实验方法
1.3.1丝素蛋白的溶解
首先将蚕丝织物经质量分数为0.5%的Na2CO3溶液在100 ℃下脱胶2次,每次脱胶时间均为30 min,浴比为1∶50;脱胶蚕丝经苦味酸胭脂红染色法检验丝胶成分完全去除,蚕丝织物可视为蚕丝素蛋白纤维集合体。
将脱胶蚕丝织物剪碎,分批加入[Amim]Cl中,升温至90 ℃,磁力搅拌溶解。溶解过程中通过纤维图像自动采集和识别系统检测丝素蛋白纤维的溶解状态,确定其溶解完全;然后计算溶液中丝素蛋白的质量分数,冷却溶解液,密封备用。
1.3.2聚乙烯醇的溶解
将PVA粉末缓慢加入[Amim]Cl中,在90 ℃下持续搅拌溶解2 h,制备质量分数为5%的溶解体系,冷却溶解液,密封备用。
1.3.3SF/PVA复合膜的制备
按不同质量比将丝素蛋白、PVA溶解液混合搅拌,使二者混合均匀,静置去泡后倒入聚四氟乙烯成膜器(凹槽深0.5 mm)中,并将成膜器浸入甲醇溶剂中,浸泡4 h去除[Amim]Cl,然后将成膜器置于空气中自然风干,取膜后封存测试。依次制备SF与PVA质量比分别为0∶10、1∶9、2∶8、3∶7的复合膜。在复合膜制备过程中,采用甲醇溶剂去除[Amim]Cl可提高成膜效率[18],同时通过旋蒸回收[Amim]Cl,实现重复使用,具有环保效益[19]。
1.4 性能测试与表征
1.4.1SF/PVA复合膜微观形貌观察
采用扫描电子显微镜对SF/PVA复合膜的微观形貌进行观察,观察前先将待测复合膜进行镀金处理,后放置于扫描电镜置物台上,抽真空进行测试。
1.4.2SF/PVA复合膜化学结构分析
采用KBr压片法分别测试PVA膜和SF/PVA复合膜的红外光谱图,测试参数:分辨率为4 cm-1,扫描次数为32,波数范围为4 000~500 cm-1。
1.4.3SF/PVA复合膜聚集态结构分析
采用X射线衍射仪分别对PVA膜和SF/PVA复合膜进行测试,测试参数:CuKα靶(λ=0.154 nm),电压为40 kV,电流为20 mA,衍射角度扫描范围为5°~80 °,扫描步长为0.02 (°)/s,扫描速度为2(°)/min。
1.4.4SF/PVA复合膜动态与静态接触角测试
动态接触角:室温下采用Wilhelmy吊片法测试复合膜润湿性能,通过系统分析软件记录试样与液体(超纯水)的动态接触角,测试中样品的前进和后退速度均为0.05 mm/s,浸入深度为2.00 mm,每个试样测3次,取平均值。
静态接触角:针头向复合膜上滴加超纯水,水滴在膜上停留5 s后,用光学接触角测量仪对水滴形状进行拍摄并计算静态接触角,每个试样测3次,取平均值。
1.4.5SF/PVA复合膜透光率测试
将不同质量比的SF/PVA复合膜在紫外分光光度计上测试其透光率,测试参数:采样孔径为2 cm,波段范围为200~700 nm。
1.4.6SF/PVA复合膜光老化与力学性能测试
将不同质量比的SF/PVA复合膜放置在紫外灯耐气候试验箱中进行光老化实验,紫外光源由8只UVB灯管(飞利浦)组成,其能量发射光谱波长范围与发射峰值见文献[20];经不同时间光照后测试膜的断裂强力和伸长率,选取夹持长度为20 mm,拉伸速度为20 mm/min,测定各复合膜的拉伸断裂强力及断裂伸长率。
2 结果与讨论
2.1 SF/PVA复合膜的结构与形貌
制备不同质量比的SF/PVA复合体系,复合体系经均匀磁力搅拌共混均匀后,静置并采用聚乙烯(PE)薄膜封口放置24 h,未出现分层、析出或沉淀现象,表明[Amim]Cl共溶体系下SF与PVA组分具有良好的相容性。不同质量比SF/PVA复合膜透光率测试结果如图1所示。
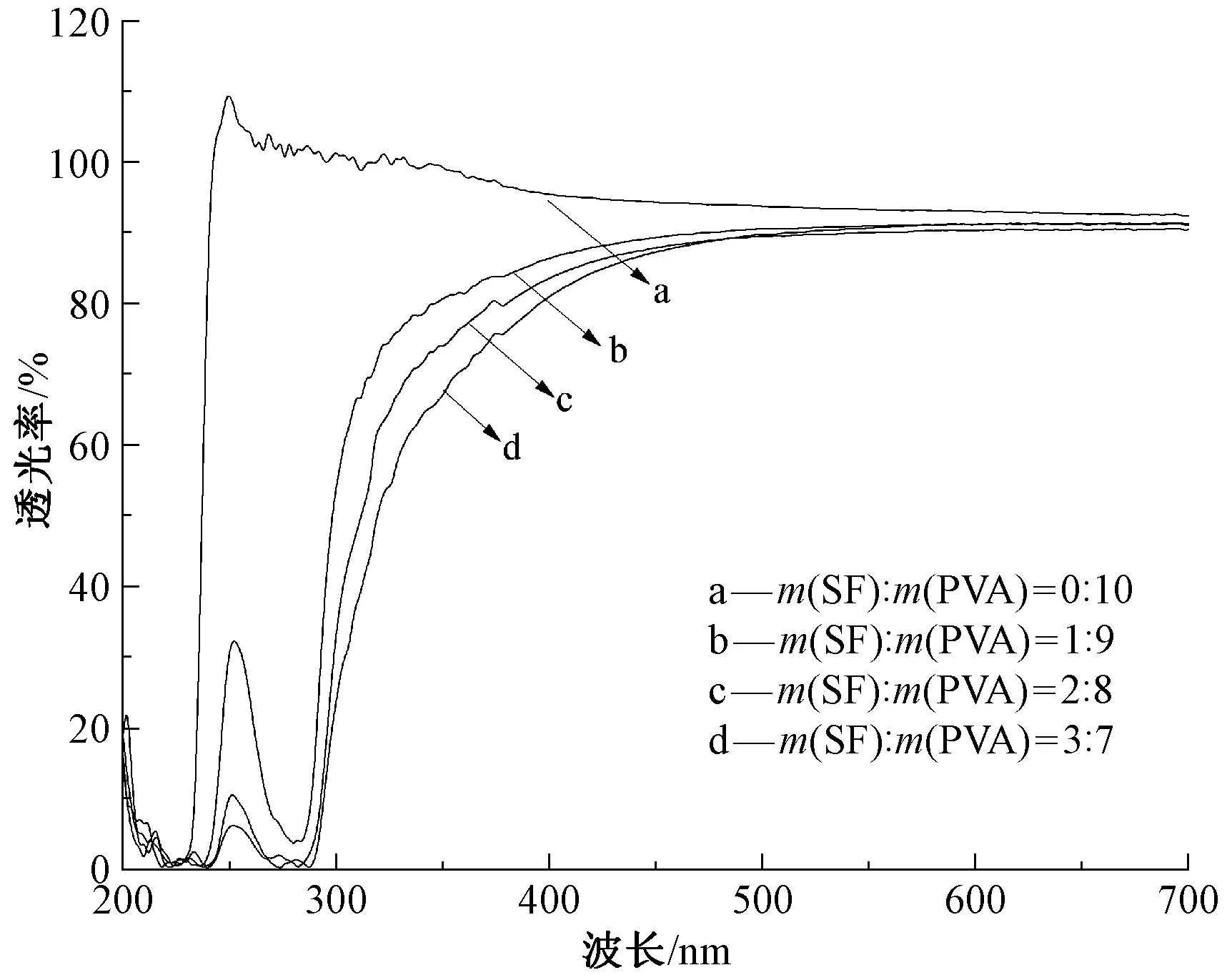
图1 不同配比SF/PVA复合膜的透光率曲线Fig.1 Transmission curves of SF/PVA composite membranes with different proportions
由图1可知,PVA膜对240~400 nm区间的紫外线入射光没有特征吸收,入射光线可完全透过PVA膜,同时PVA膜在240~700 nm整个波段均具有较高的透光率。组成丝素蛋白的氨基酸分子中含有芳环、咪唑环等杂环结构,上述结构对紫外线波段能量存在特征吸收[21],因此,若复合膜中含有丝素蛋白成分,入射的紫外线将被膜吸收而不能透过。图中SF/PVA复合膜在240~400 nm的紫外光波区间具有较低的透光率,表现出特征吸收,证明了复合膜中丝素蛋白成分的存在;同时还可发现,随着复合膜中丝素蛋白含量的增加,膜在紫外线波段的透过率逐渐下降,其透过率与丝素蛋白的配比呈负相关。综上分析可知,本文方法可成功制备SF/PVA复合膜,同时在成膜过程中没有耗时长的透析除盐、蛋白质浓缩过程,成膜过程较为简便。
图2为PVA膜和SF/PVA复合膜的X射线衍射谱图。可以看出,PVA膜和SF/PVA复合膜的衍射峰信号有显著差异。衍射峰信号的差异表明,成膜过程中SF与PVA分子之间发生相互作用[22],产生共混相容。其中,本文成膜体系下,纯PVA膜分别在2θ为20.1°、23.1°处出现衍射峰;PVA与SF共混制备复合膜在2θ为20.4 °处有尖锐的衍射峰,此峰与丝素蛋白经甲醇处理后形成的SilkⅡ构象衍射峰相对应[23]。
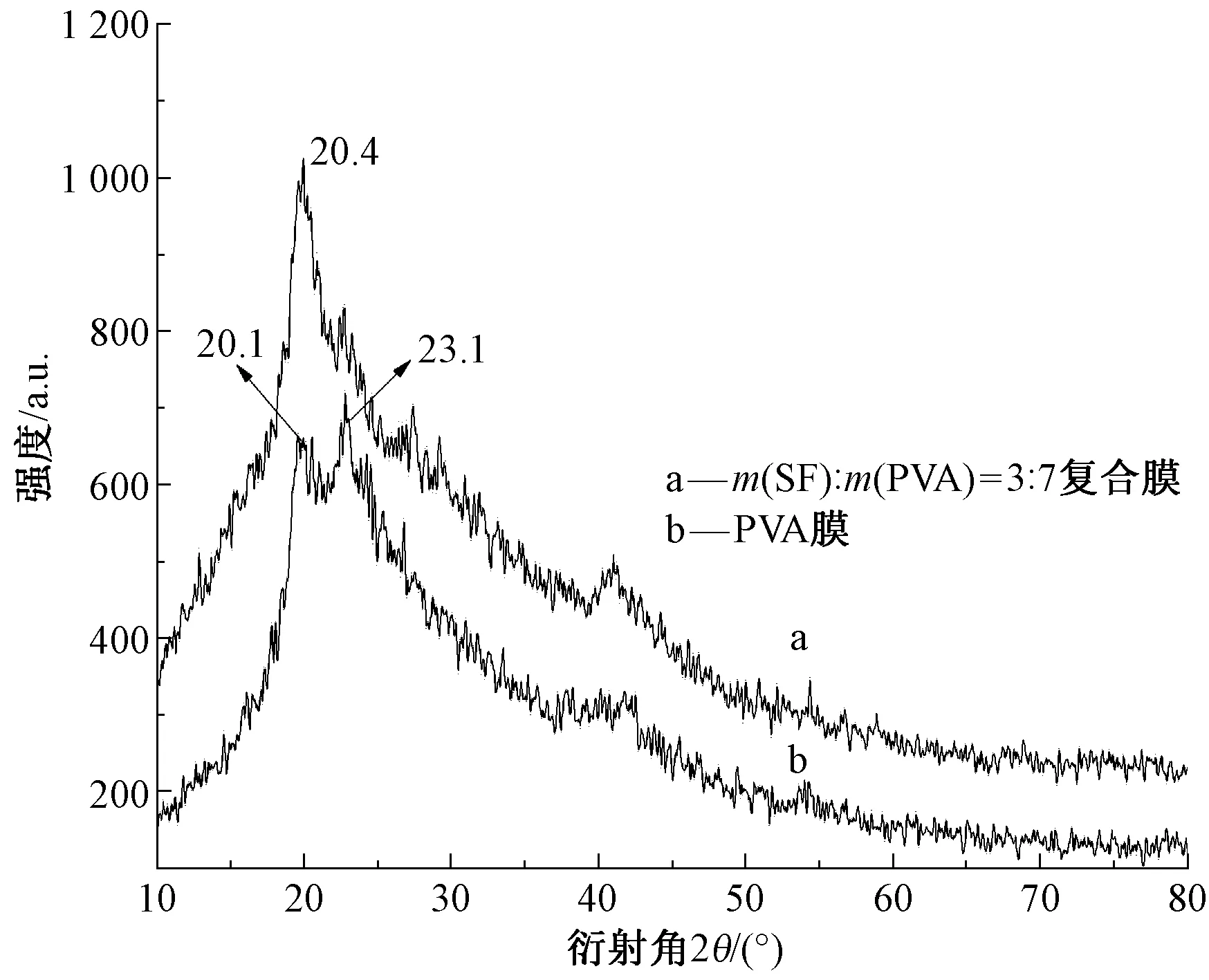
图2 PVA膜和SF/PVA复合膜的X射线衍射谱图Fig.2 X-Ray diffraction spectra of PVA membraneand SF/PVA composite membrane

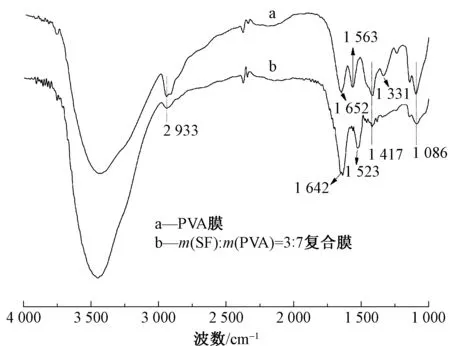
图3 PVA膜和SF/PVA复合膜的红外谱图Fig.3 FT-IR spectra of PVA membrane and SF/PVA composite membrane
图4示出SF/PVA复合膜的结构与形貌。可以看出:纯PVA膜表面较为平整光滑,而SF/PVA复合膜的表面平整度降低,表面分布着密集的颗粒状或片状物质;同时,随着复合膜中SF组分含量的增加,复合膜的表面粗糙度增加。分析原因认为分布在复合膜表面的物质为小分子质量的丝素蛋白组分,前期研究表明碳酸钠脱胶蚕丝制备的丝素蛋白分子质量较低,且分子质量差异率较高,在SF/PVA成膜过程中,溶剂[Amim]Cl将通过甲醇溶解去除,在[Amim]Cl向甲醇相扩散溶解的过程中,丝素蛋白中相对分子质量较小的丝素蛋白随着[Amim]Cl的扩散向膜的表面迁移并固着在膜的表面,造成膜表面粗糙度增加。

图4 不同质量比SF/PVA复合膜的SEM照片(×3 000)Fig.4 SEM images of SF/PVA composite membranes at different proportions (×3 000)
综上可知,[Amim]Cl共溶体系提升了SF与PVA组分的相容性,但在成膜过程中,小分子的丝素蛋白将向膜的表面迁移并固着,同时致使复合膜表面粗造度增加。
2.2 SF/PVA复合膜的亲水性能
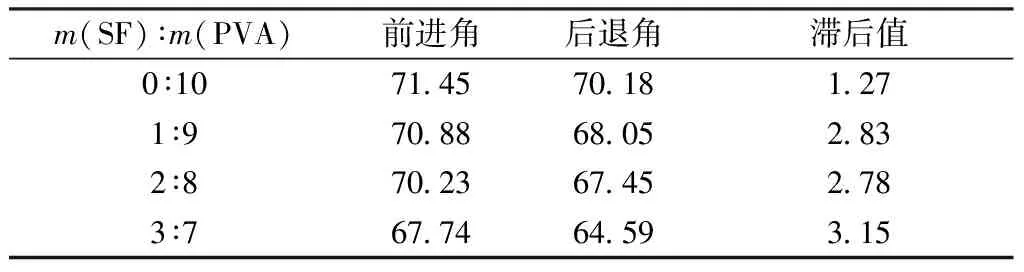
图5示出不同质量比SF/PVA复合膜的静态接触角。因含醇羟基等极性基团,纯PVA膜具有一定的亲水性能,静态接触角为98.4°,SF/PVA复合膜的接触角随着SF组分的增加逐渐减小,表明复合膜的亲水性能逐渐提升。造成复合膜亲水性能提升的原因:一方面是与膜的表面粗造度直接有关,根据Wenzel模型,提升表面粗糙度可提高膜表面的亲水性能[25],相同材质的膜表面粗造度越大,膜的亲水性能越强;另一方面,迁移到膜表面的小分子丝素蛋白自身具有优良的亲水性。同时测试了不同质量比SF/PVA复合膜的动态接触角,结果如表1所示。

图5 不同质量比SF/PVA复合膜的静态接触角Fig.5 Static contact angles of SF/PVA composite membranes at different proportions
(°)
由表1可知:随着复合膜中SF组分的增加,复合膜的前进角、后退角均有逐渐减小的趋势;同时前进角与后退角之间的滞后值逐渐增大。上述变化规律也可证明复合膜的表面亲水与润湿性能逐渐增强。综上,动静态接触角的测试结果同时证明了复合膜的亲水性能随着SF组分的增加而逐渐提升。
2.3 SF/PVA复合膜的光老化与力学性能
为探究SF/PVA复合膜的自然降解性能,对比分析了光照过程中不同配比复合膜的力学性能变化,结果如图6所示。
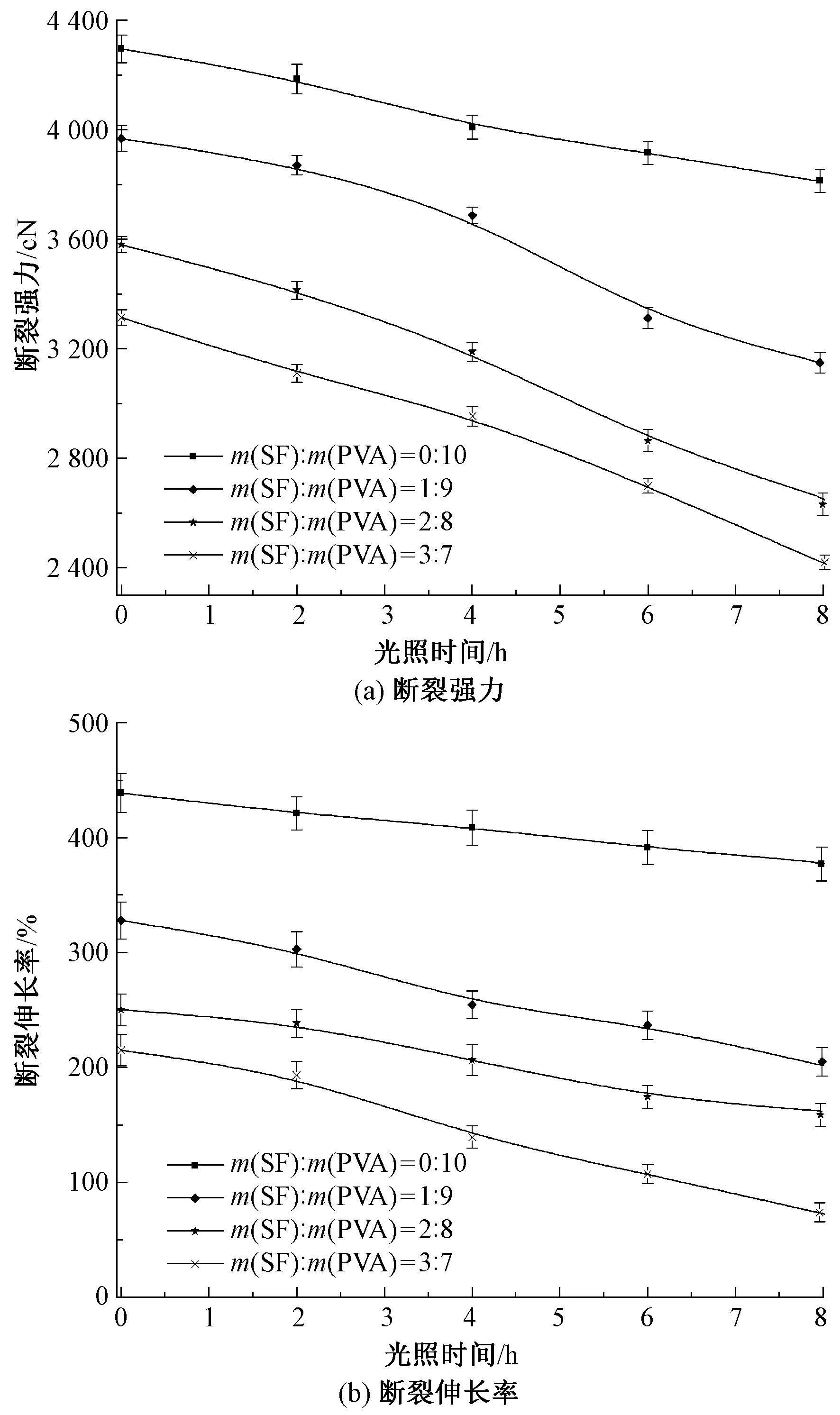
图6 光照时间对SF/PVA复合膜断裂强力与伸长率的影响Fig.6 Effect of exposing time on breaking strength (a) and elongation at break (b) of SF/PVA composite membranes
由图6可知:相对于SF/PVA复合膜而言,纯PVA膜具有较高的断裂强力和断裂伸长率,呈现优良的强度和柔韧性;随着SF组分含量的增加,SF/PVA复合膜的断裂强力和断裂伸长率同时下降,表明复合膜的脆性增强,这是由于在该成膜共混体系中,SF蛋白分子与PVA分子两相之间虽然有一定的相容性,但SF分子的嵌入破坏了PVA分子结构的连续性,形成类似结构缺陷[6],破坏了PVA分子之间的原有结构与作用力,降低了膜的力学性能,复合膜的性能逐渐向丝素蛋白膜方向演化,膜的脆性增加。
经光老化实验,复合膜的强力损失明显高于纯PVA膜,其中光照8 h后,纯PVA膜的断裂强度损失率为11.35%,断裂伸长率损失率为13.80%;质量比为1∶9的SF/PVA复合膜的断裂强力损失率为20.70%,断裂伸长率损失率为38.63%;质量比为3∶7的SF/PVA复合膜的断裂强力损失率为27.12%,断裂伸长率损失率为66.25%。因为SF具有特征紫外线吸收,光老化实验中入射到SF分子结构的紫外线能量对蛋白肽键作用,造成肽键直接断裂,产生光脆损和光降解;同时复合膜表面粗糙度的增加,减少了膜对光子能量的镜面反射,增加了紫外线光子能量对复合膜聚合物结构的作用比率。由此可知,复合膜中SF组分含量的增加,将加速复合膜的光降解进程,因此,亦可通过对复合膜中SF蛋白组分的调节实现对复合膜光降解性能的调控。
3 结 论
1)脱胶蚕丝和聚丙烯粉末分别由离子液体溶解,经共混、甲醇浸泡、自然风干,可制备不同质量比的SF/PVA复合膜,[Amim]Cl离子液体共溶提高了丝素蛋白与聚乙醇组分的相容性。
2)成膜过程中丝素蛋白组分向膜的表面迁移,并主要以Silk II构象存在;随着复合膜中丝素蛋白含量的增加,复合膜表面粗糙度增加,膜的亲水性能提升;同时丝素蛋白含量的增加还加速了复合膜的光老化进程。
3)本文成膜方法省去了传统蛋白膜制备过程中透析、浓缩等耗时工序,成膜操作简便;同时溶解蚕丝和聚丙烯使用的[Amim]Cl离子液体,经旋蒸去除甲醇后可重复使用,具有环保效益。
FZXB
