L-苹果酸降解菌酿酒酵母降酸功能影响因素分析
2018-11-28周剑忠夏秀东胡彦新黄自苏
王 英, 周剑忠, 夏秀东, 胡彦新, 李 莹, 黄自苏
(江苏省农业科学研究院 农产品加工研究所,江苏 南京210014)
有机酸是果酒组分之一,也是主要风味物质的主要组成成分,主要包括酒石酸、苹果酸、柠檬酸等,其中苹果酸含量过高会使果酒有酸涩感,酒味粗硬。如何降低果酒中的苹果酸含量一直是果酒酿造中一个亟待解决的问题。物理降酸法、化学降酸法和生物降酸法是目前果酒产业中的主要降酸方法,但物理和化学降酸方法对果酒的风味影响较大。利用乳酸菌或酵母菌生长代谢降酸成为近年来果酒降酸的主要研究方向[1-4]。
果酒生物降解苹果酸的途径主要为苹果酸-乳酸发酵(Malo-lactic Fermentation,MLF)和苹果酸-酒精发酵(Malo-alcoholic Fermentation,MAF)。MLF主要利用乳酸菌将葡萄酒中的苹果酸转化为乳酸,其特点是有选择性的降酸,并且是在酒精发酵之后进行[5-8]。MAF是通过裂殖酵母利用糖作底物生成酒精外,还能在厌氧条件下分解苹果酸,最终生成乙醇和CO2,但是裂殖酵母发酵能力较弱,且会使果酒产生不良气味[9]。目前,有研究者从自然发酵的果酒中筛选具有优良降解L-苹果酸功能又具有优良发酵性能的酿酒酵母,在果酒发酵的过程中使酒精发酵和降酸同时进行,达到简化果酒发酵工艺[4,10-12]。
大量的研究结果表明,环境因素(时间、底物浓度、接种量等)对微生物的功能特性的发挥有很大的影响[13-15]。为了更好的发挥微生物的功能,研究者利用正交设计、响应曲面、中心组合设计等实验方法对影响微生物功能特性的条件进行优化,为充分发挥菌株的功能特性提供指导[16-18]。
作者以实验室保存的具有降L-苹果酸功能的酿酒酵母菌株FM-S-115为研究对象,研究温度、接种量、乙醇体积分数、SO2质量浓度等因素对FM-S-115菌株降酸能力的影响,并利用中心组合设计对该菌株的降酸条件进行优化,确立FM-S-115菌株的最佳降酸条件,为FM-S-115菌株在果酒生产中应用提供技术支持,同时为果酒的生物降酸提供技术支持。
1 材料与方法
1.1 菌株
降酸酵母FM-S-115,由江苏省农业科学农产品加工研究所食品生物工程实验室分离、鉴定并保存保藏。
1.2 试剂与设备
甲醇(色谱纯):国药集团化学试剂有限公司;L-苹果酸(分析纯):梯希爱(上海)化成工业发展有限公司。
PDA培养基:去皮土豆200 g,切成小块加水至1 L,煮沸1 h,双层纱布过滤,补水至1 L,加入20 g葡萄糖;固体培养基:添加质量分数2%琼脂。
LRH-150生化培养箱:上海恒科技有限公司产品;THZ-C-1台式冷冻恒温震荡机:太仓市实验设备厂产品;SevenEasy plus pH仪:梅特勒-托利多仪器上海有限公司产品;TGL-16C台式离心机:上海安亭科学仪器厂产品;超级水浴锅:常州国华电器有限公司产品;LC2030型高效液相色谱仪:北京安捷伦科技有限公司产品。
1.3 方法
1.3.1 种子液制备 在PDA液体培养基中接种菌株FM-S-115,培养至对数期,离心收集菌体,用新鲜的PDA培养液洗涤2次后重悬,调整A600nm值为2.10~2.15,作为L-苹果酸降解试验的接种菌液。
1.3.2 降酸实验设计 黑莓经打浆酶解后,5 000 r/min离心10 min, 上清液用依次用0.8 μm 和0.22 μm的无菌滤膜进行过滤。以含有体积分数50%的无菌黑莓清汁和50%的PDA液体培养基的混合液体为测定菌株FM-S-115降酸性能的培养液体,加入无菌的L-苹果酸溶液,使体系中L-苹果酸终质量浓度为4 g/L,除非特别说明,接种量为体积分数4%,培养温度为28℃,100 r/min摇床振荡培养,培养时间为9 d,HPLC检测,每次试验重复3次。
1.3.3 样品处理 发酵液样品经10 000 r/min离心10 min,取上清,用双蒸水稀释合适倍数后经0.22 μm膜过滤后进行HPLC测定。
1.3.4 L-苹果酸质量浓度的检测 色谱条件色谱柱:Atlantis C18 柱 (46 mm×250 mm,5 μm);流动相:V(甲醇)∶V(0.01 mol/L 缓冲溶液 KHPO4)=3∶97,pH 2.8;流量:0.7 mL/min;进样体积 20 μL;检测波长:210 nm;柱温:室温。
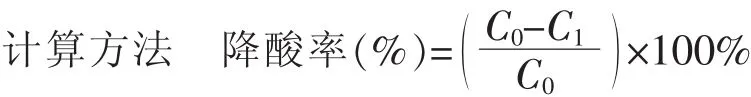
式中:C0为降解前苹果酸(柠檬酸)的质量浓度;C1为降解后苹果酸(柠檬酸)的质量浓度。
1.3.5 单因素实验 主要考虑发酵温度、接种量、SO2质量浓度、发酵时间、乙醇体积分数和糖质量分数作为菌株FM-S-115的降酸能力的影响因素,在各因素试验中采用1.3.2和1.3.3所述的方法进行样品处理和苹果酸浓度的检测。
1.3.6 FM-S-115降酸条件优化 基于单因素试验结果,同时结合果酒酿造过程中的可调控条件,选取接种量、培养温度和SO2质量浓度为3个主要因素,在苹果酸质量浓度为4 g/L的黑莓汁和PDA混合液体培养基中,100 r/min摇床振荡培养9 d,在利用中心组合设计(Central Composite Design,CCD)软件生成响应面分析实验方案,具体内容见表1。预测FM-S-115降酸条件的最优条件组合。

表1 试验因素水平及编码Table 1 Codes and levels of the test
1.3.7 响应面模型的验证 按照获得的二次回归方程所预测的最佳组分配比条件进行降酸,通过摇瓶发酵降酸试验,验证模型的有效性。
1.3.8 数据分析 用Excel 2010软件对单因素实验结果进行统计分析与作图,用Design-expert 8.0.5软件进行实验设计和统计分析。
2 结果与分析
2.1 发酵温度对FM-S-115的降酸率影响
温度是影响菌体生长的主要因素之一,同时也是影响菌株功能特性的主要因素。培养温度在20~32℃范围内,菌株FM-S-115对L-苹果酸的降解能力随发酵温度的增加其降酸能力不断增加,在26℃时,菌株FM-S-115的降酸能力最强,降酸率达29.81%。之后随着温度的增加,其降酸能力呈现下降趋势。这可能是由于在适宜菌体生长的温度条件下,菌体密度高,相应的菌体的降酸功能就会增加。综上所述,发酵时间控制在26℃左右,FM-S-115菌株的降酸能力较好。
2.2 接种量对苹果酸降解率的影响
菌体接种量的变化直接影响着菌体的生长趋势,当菌体接种量过低时,菌体的适应性降低,相应的延滞生长期就会延长,但菌体的接种量过大,菌体会很快进入生长稳定期,消耗大量的营养,导致培养基内的营养物质供不应求,影响菌体的生长。
2.3 SO2质量浓度对FM-S-115降酸率的影响
由于SO2具有抗氧化和抑制微生物的生长的功能,因此在果酒的发酵过程中,常被用来作为抑菌剂和护色剂使用[19-20]。因此,作者对SO2质量浓度变化对菌株FM-S-115的降酸特性的影响进行了分析。菌株FM-S-115对L-苹果酸的降解能力随SO2质量浓度的变化而变化,当SO2质量浓度在0~80 mg/L范围内,菌株FM-S-115的降酸能力随SO2质量浓度的增加而增加;SO2质量浓度大于80 mg/L时,菌株的降酸能力随SO2质量浓度的增加而减小。
2.4 乙醇体积分数对FM-S-115降酸率的影响
在果酒的酿造过程中,前期菌落结构组成丰富,具有多种多样的酵母类群,如汉森酵母(Hanseniaspora)、毕赤酵母 (Pichia)、 假丝酵母(Candida)、接合酵母(Zygosaccharomyces)等,但在发酵后期,酿酒酵母(Saccharomyces cerevisiae)是主要成员,因其对酒精具有较高的耐受性[21-22]。菌株FM-S-115对L-苹果酸的降解能力随酒精体积分数的变化而变化,体系中乙醇体积分数低于10%时,菌株的降酸能力随着乙醇体积分数的增加而逐渐减小,但是降低不显著(P>0.05);此结果表明,菌株FM-S-115对酒精具有较高的耐受性,并且低浓度的酒精对该菌株的其降酸功能影响不大。当乙醇体积分数在大于10%,降酸能力急剧下降。
2.5 培养时间对FM-S-115降酸率的影响
菌株FM-S-115对L-苹果酸的降解能力随发酵时间的延长其降酸率呈现增加趋势,在发酵初期,降酸率增加比较明显,但随着发酵时间的延长,降酸率增加幅度逐渐呈现减小的趋势。
2.6 蔗糖质量分数对FM-S-115降酸率的影响
适当的增加碳源浓度,有利于菌体的生长,但体系中碳源浓度过高时,体系的渗透压增大,高的渗透压对菌体生长会有不同的抑制作用。体系中蔗糖质量分数对菌株FM-S-115的降酸能力随着体系中蔗糖质量分数的变化呈现先增加后降低的趋势。
2.7 FM-S-115降酸条件的优化
根据前期的单因素试验结果,结合在果酒酿造中可操控的实验因素,对接种量(A)、发酵温度(B)和SO2质量浓度(C)进行了3因素3水平响应面分析试验,试验设计与结果见表2,利用Design Expert软件对表2数据进行二次多元回归拟合,得到菌株FM-S-115降酸率预测值(Y)对编码自变量A、B和C的二次多项回归方程:

式中,Y为菌株的降酸率的预测值;A、B、C为3个自变量的编码值。
从回归模型方差分析结果可知,该模型的F值为52.69,P<0.000 1,说明该模型极显著;且失拟项的F值为1.49,P值为0.337 0,大于0.05,说明方程具有良好的拟合性和实用性,实验误差较小。另外,该模型的矫正系数R2Adj=0.960 8,说明该模型能解释96.08%的菌株FM-S-115降酸率的变化。从模型中可以看出,根据各影响因素系数的绝对值大小可以得到各因素对FM-S-115菌株的降酸率的贡献大小顺序为培养温度>接种量>SO2质量浓度。由回归方差分析可知,培养温度、接种量和SO2质量浓度对FM-S-115菌株的降酸率的影响都处于显著水平。培养温度和接种量存在显著的交互作用,培养温度与SO2质量浓度存在显著的交互作用,对FM-S-115菌株的降酸率影响较大。接种量和SO2质量浓度的交互作用不显著。
根据回归方程,利用Design Expert软件做出两因子交互作用的响应面及其等高线,培养温度和SO2质量浓度、培养温度和接种量、接种量和SO2质量浓度的交互作用分别见图1~3。如果一个响应曲面坡度相对平缓,表明处理条件的变化对响应值较小,相反,响应曲面的坡度陡峭,表明响应值对于处理条件的改变非常敏感;等高线若为椭圆,说明两个因素交互作用明显,等高线图若为圆形,说明两者交互作用不明显[23]。
图1显示了接种量为5%时,培养温度和SO2质量浓度的交互作用对降酸率的影响,从响应曲面图中可以看出,培养温度和SO2质量浓度对菌株FM-S-115的降酸率的贡献率相当,从等高线图中可以看出,培养温度和SO2质量浓度交互作用不显著。图2显示了SO2质量浓度为80mg/L时,接种量和发酵温度对菌株FM-S-115的降酸率的影响,从响应曲面图中可以看出,接种量和发酵温度对菌株FM-S-115的降酸率的贡献率相当,从等高线图中,可以看出,接种量和发酵温具有明显的交互作用。图3显示了培养温度为26℃时,SO2质量浓度和接种量对菌株FM-S-115的降酸率的影响,从响应曲面图中可以看出,接种量对菌株FM-S-115的降酸率的贡献率高于SO2质量浓度,从等高线图中,可以看出,接种量度和SO2质量浓度具有显著的交互作用作用。

图1 SO2质量浓度和培养温度对菌株FM-S-115降酸率的交互效应Fig.2 Reciprocal effects of SO2concentrations and temperature on deacidification ratio of FM-S-115 strain

图2 接种量和培养温度对菌株FM-S-115降酸率的交互效应Fig.2 Reciprocal effects of inoculation amounts and temperature on deacidification ratio of FM-S-115 strain

图3 SO2质量浓度和接种量对菌株FM-S-115降酸率的交互效应Fig.3 Reciprocal effects of SO2concentrations and inoculation amount on deacidification ratio of FM-S-115 strain
由二次多项回归方程得出3个因素的最佳值为温度为26.26℃ 接种量为5.15%,SO2质量浓度为81.08 mg/L,菌株FM-S-115的降酸率的预测值为37.98%。采用上述优化后的条件,进行验证,3次重复,结果显示,FM-S-115的降酸率为38.11%,与预测值37.98%接近,说明该实验模型可操作性高。
3 结语
作者通过对影响菌株FM-S-115降酸能力的因素进行系统的研究,在单因素实验结果的基础上,选取接种量、发酵温度和SO2质量浓度为影响FMS-115降酸能力的3个主要因素,利用Central Composite Design实验设计建立菌株FM-S-115降酸性能的优化回归数学模型,该模型在本实验条件范围内能很准确的预测显示菌株FM-S-115的降酸能力。方差分析结果显示,各因素对FM-S-115菌株的降酸率的贡献大小顺序为培养温度>接种量>SO2质量浓度。另外,培养温度、接种量和SO2质量浓度对FM-S-115菌株的降酸率的影响都处于显著水平。培养温度和接种量存在显著的交互作用,培养温度与SO2质量浓度存在显著的交互作用,对FMS-115菌株降酸率的影响较大。接种量和SO2质量浓度的交互作用不显著。
最佳优化条件为:接种量 (体积分数)5.15%,SO2质量浓度81.08 mg/L,培养温度为26.26℃,菌株FM-S-115的降酸率的预测值为37.98%。通过实际实验,FM-S-115的降酸率为38.11%,与预测值非常接近,回归分析和验证实验都证明该实验模型的合理性和可行性。
