一种用于数字PCR的微流控芯片的设计、制作和性能验证
2018-11-28任晓龙许少飞
任晓龙,李 增*,许少飞
(1.广东顺德工业设计研究院 广东佛山528300;2.广东顺德永诺生物科技有限公司 广东佛山528300)
0 引 言
微流控芯片技术是将生物和化学实验室的基本功能微缩到几平方厘米的芯片上[1],在同一芯片上设计不同微流路沟道流型实现不同试剂的混合反应,减少繁琐的生物实验操作步骤,缩短检测所需时间[2],由于芯片产生的分散相均匀地被连续相隔离开来,解决了传统技术上交叉污染的问题。此外微滴形态稳定、易操作并可以快速大量地获得使它成为微反应器的理想选择。微流控芯片技术已成为多学科交叉的科学技术平台,目前应用于包括核酸分析、蛋白质分析和代谢物分析在内的重要领域生物化学分析。可用于制作芯片的材料主要有单晶硅、无定型硅、玻璃、金属和有机聚合物[3],与玻璃和石英相比,有机聚合物具有优良的光学特性、生物兼容性、气体通透性以及较低的制作成本等特点,如聚二甲基硅氧烷(PDMS)、工程塑料、聚甲基丙烯酸甲酯(PMMA)、聚苯乙烯(polystyrene)和环烯烃共聚物(COC)等[4]。本次实验所用芯片为PDMS芯片和COC芯片,PDMS芯片利用模塑的方法制得,COC芯片利用注塑的方法制得。由于环烯烃聚合物具有优良的光学性能和较高的生物相容性,表面易于修饰、尺寸稳定和较高的疏水性,且分子结构中不含氧、氮等原子,不存在未饱和的双键、三键及芳香环结构,其化学性质稳定,利用注塑的方法加工该芯片更易于大批量标准化生产,降低了芯片的制作和实验操作成本。
聚合酶链式反应(PCR)是一种体外酶促合成扩增特定DNA片段的方法,液滴式数字PCR(ddPCR)是利用微流控芯片产生液滴并以液滴作为PCR反应器的一种高效的数字 PCR平台方法[5]。其原理是将待测样品分配到由芯片产生的数百万个液滴中,使得每个液滴中最多含有一个拷贝的样品分子,与实时荧光定量 PCR相对定量的方法不同,ddPCR反应后液滴中有荧光显示则说明含有样品分子(记为 1),无荧光显示则说明不含有样品分子(记为 0)[6],通过统计含有荧光信号的液滴数量(即初始样品的拷贝数)而实现对核酸的绝对定量。与传统定量PCR技术相比,数字 PCR方法不受扩增效率的影响、不必建立标准曲线[7]、不依赖于扩增曲线的循环阈值(CT值)实现绝对定量。目前市场上常见的数字 PCR系统主要有美国伯乐bio-rad QX200微滴式数字PCR系统、美国ABI QuantStudio 3D 数字 PCR系统和美国RainDance皮升级微滴数字 ddPCR系统(Raindrop digital PCR System)。
1 芯片设计与制作
1.1 材料与仪器
材料:硅片、光刻胶(MicroChem)、显影液(MicroChem)、PDMS预聚物(道康宁)、载玻片、Ni基片、丙酮。
仪器:台式匀胶机、保温箱、等离子清洗机、URE-2000型系列i线深度曝光光刻机(中国科学院光电技术研究所)、FANUCα-2000I50B注塑机(日本)。
1.2 芯片的设计
随着微流控芯片的发展其功能越来越多,通道结构也越来越复杂,常用的结构有正交结构[8]、流式聚焦[9]和共轴流[10]。图1为本实验所设计的十字交叉型微通道结构图,其中 1为油相入口,2为水相入口,3为流体出口。样品管道宽度为 20μm,油相管道宽度为 15μm,a处为油相和水相的十字型剪切口,管道宽度为 20μm,深度为 30μm。水相样品和油相在压力的驱动下流经十字口处,在剪切力的作用下水相样品被油相分割成均匀的油包水结构,在收集腔内获得一定直径的微滴。

图1 微型通道结构Fig.1 Microchannel structure
1.3 PDMS芯片的制作
本实验中所用 PDMS芯片通过模塑法加工制得。首先将 CAD软件绘制的芯片微通道结构图形加工成掩膜版。然后用匀胶机在处理后的硅基片上均匀地涂覆一层厚度为30μm的SU-8 2050光刻胶(图2a);经过紫外曝光将掩膜版上的图形转移至光刻胶上(图 2b);显影后用丙酮除去多余的光刻胶,在保温箱中烘干 30s便得到用于制备芯片的阳模(图 2c);将 PDMS预聚物与固化剂按体积比 10∶1量取,搅拌均匀并经过真空脱气后倒在预先准备好的带有围堰结构的阳模上(图 2d);在保温箱中 65℃保 温 2h使其充分固化(图 2e);将固化的 PDMS基片从阳模上剥离下来进行打孔,与洁净的载玻片进行等离子体键合(图 2f),在打孔处封装聚四氟乙烯管以便于进样和连接恒压泵,从而制得所需要的 PDMS-玻璃芯片(图 3)。
1.4 COC芯片的制作
COC芯片的制作过程主要包括模具的制作和注塑成型 2步,在模具制作中主要是模芯的加工,首先将CAD软件绘制的芯片微通道结构图形加工成掩膜版,然后用匀胶机在处理后的 Ni基片上均匀涂覆一层厚度为 30μm 的正光刻胶,通过紫外曝光使得掩膜版上的图形转移至光刻胶上。显影后便可获得具有微通道结构的凹模,将凹模和镍金属块分别装夹在微电铸槽的阴极和阳极中,在伴有超声波搅拌[11]的条件下进行电铸,使得在阴模上沉积出所需高度的镍。电铸完成后,取出阴模并除去残余的光刻胶,对微结构进行抛光研磨等后处理,从而制得加工芯片的模芯(图 4)。

图2 PDMS芯片阳模的制作流程Fig.2 Fabrication process of PDMS positive modulus

图3 自制PDMS-玻璃芯片Fig.3 Self-made PDMS-glass Chip
将加工好的模具装夹在注塑机上,调整模具闭合高度、压力等参数,然后将 COC材料颗粒放入注塑机中,调节注塑机温度、注射速度和保压时间等参数,在螺杆的推动下熔融状态的 COC进入模具,冷却后脱模得到含有微通道结构的芯片结构层。将芯片结构层与另一COC塑料片进行热压键合后便可获得所要的COC芯片(图5)。

图4 模具模芯Fig.4 Mold core

图5 COC芯片Fig.5 COC chip
2 实验
2.1 试剂与仪器
试剂:人体 EGFR基因质粒由实验室自制并采用 Qubit对质粒进行定量,上游引物 5′-GCAGCATG TCAAGATCACAGATT-3′、下游引物 5′-CCTCCTTC TGCATGGTATTCTTTCT-3′、FAM 探针 5′-FAM-CA GTTTGGCCAGCCCA-MGB-NFQ-3′均 由 Thermo Fisher(美国)合成,DNA聚合酶购自生工生物(上海)。
仪器:ABI普通 PCR 仪、恒压泵(MS-PC-6)、IX73-F22FL/PH荧光倒置显微镜(Olympus)、保温箱、光学检测平台。
2.2 微滴的生成
配制 ddPCR反应体系:取 10μL自制 ddPCR mix,将 FAM 探针和引物用无菌去离子水分别稀释到 0.5μmol/L 和 1.8μmol/L,FAM 探针 0.5μL,上游引物1.8μL,下游引物1.8μL,gDNA模板2μL,加入无菌去离子水补足至 20μL。将 COC芯片置于光学检测平台,使用移液枪移取配制好的 PCR反应体系15μL至COC芯片水相孔中,在油相孔中加入50μL微滴生成油,连接压力泵,调节油相管道压力40kPa,水相管道压力 25kPa,正压进样,当液体流经十字交叉处时被油相液体切割在管道内生成扁圆形微滴,在收集腔内形成圆形微滴(图 6),将收集腔中生成的微滴放置在 PCR仪上进行扩增,并同时检测生成微滴的脉宽和荧光值的稳定性。

图6 COC芯片生成微滴Fig.6 Microdroplets generated by COC chip
数字 PCR反应条件:首先 95℃加热 10min充分变性,随后 95℃加热 30s变性,60℃退火延伸1min,经过 40个循环进行扩增,最后 95℃加热10min变性,4℃保存。
在相同条件下以相同的方法利用 PDMS芯片进行微滴生成(图7)并检测生成微滴脉宽和荧光值的稳定性。

图7 PDMS芯片生成微滴Fig.7 Microdroplets generated by PDMS chip
2.3 微滴的梯度分析
数字PCR对目标分子定量的动态范围是评价该方法分析性能的一项重要指标,根据泊松分布(Poisson distribution)理论获得每个液滴中包含目的基因的个数K的概率为:

该式中λ为液滴中的平均模板数,当λ<0.3时才可确保大部分微单元含有数量不多于1的DNA模板,因此生成微滴的数目是数字PCR技术绝对定量的重要保障[12]。将含 gDNA 定量并按 10倍梯度稀释得到101~106copies/μL 的浓度梯度样本,通过λ和每个平行PCR反应的体积和所有平行反应的数目以及可计算出每个反应中所含样品DNA的绝对浓度[13],统计不同浓度的gDNA的定量结果。
2.4 结果分析
在微滴生成实验中,液滴直径随水相进样口处的压力增加而增大,当水相的流速越大时所需要剪切力越大,因此在芯片结构不变的情况下,可通过调节进样口压力值的大小控制水相和油相的流速来获得一定直径大小的微滴。本次试验中通过调节油相压力40kPa和水相压力25kPa生成液滴直径为40μm,通过统计阳性微滴的数目可知 15μL的 PCR试剂在PDMS芯片中 7min可生成 4×105个微滴;COC芯片 4min内可生成 4×105个微滴。将 2种芯片生成的微滴放在荧光倒置显微镜下观察均呈现良好的球形,液滴界限明显。进一步检测 2种芯片生成微滴脉宽的 CV 值(图 8)和荧光值的 CV 值(图 9)表明,COC芯片生成微滴的稳定性均较好于PDMS芯片。

图8 微滴脉宽CV值Fig.8 Microdrop pulse width CV value
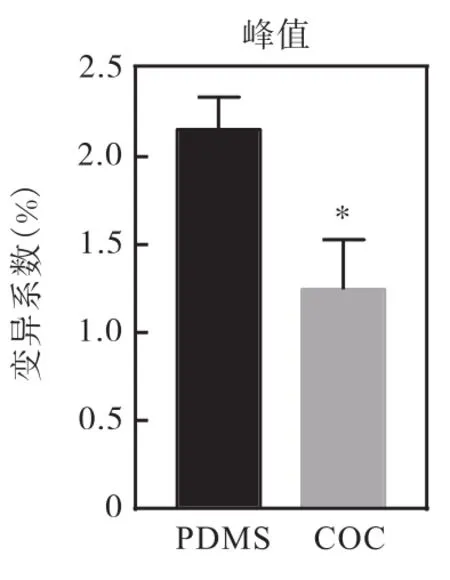
图9 微滴荧光峰值CV值Fig.9 Microdrop fluorescence value CV value
通过数字PCR对核酸分子进行绝对定量的关键在于模板有限稀释、单分子 PCR扩增和泊松分布统计[14]。将稀释后的样品进行 PCR扩增,含有目标分子样品室会产生强烈的荧光信号被检测出来,对于其他杂质分子由于引物的不匹配或荧光探针具有序列特异性,产生的信号很微弱,并不影响统计结果。
通过在荧光倒置显微镜上观察可知,当样品浓度在 106copies/μL以上时,阳性液滴的数目基本达到饱和,随着模板浓度的降低阳性液滴的数目逐渐变少,通过进行质粒实际检测浓度与理论浓度的回归分析(图 10)可知,DNA 模板浓度在 101~106copies/μL范围内呈现良好的线性关系(R2=0.9983)。
3 结 论
微流控技术是一种快速高效的微分析技术,用于数字PCR技术可实现 DNA单分子反应和核酸绝对定量且具所需试剂少、灵敏度高、成本低等特点,为核酸的检测提供了一种新的途径,而一次性生成芯片的量产是实现数字 PCR技术产业化应用的核心手段。本文主要描述了一种由 COC材料通过注塑工艺制得的微流控芯片,能单独完成整个液滴的生成收集、PCR扩增和荧光检测。与 PDMS芯片微滴生成实验对比表明,COC芯片生成微滴的速度、直径大小以及生成微滴的稳定性均可满足实验的要求。对gDNA的绝对定量实验结果表明,该芯片对 DNA的定量具有良好的准确性。由于该芯片通过注塑的工艺加工制作,使获得的芯片更加统一和标准,批量化的生产模式降低了芯片的成本,为微流控技术和数字PCR技术的广泛应用奠定了基础。

图10 线性范围回归分析Fig.10 Template concentration standard curve
