新型3D打印骨修复体的骨组织相容性研究
2018-11-28向健杨立峰田胜慧曹穗兰郑保婷
向健,杨立峰,田胜慧,曹穗兰,郑保婷
(广东省医疗器械质量监督检验所 生物性能检验室,广东 广州 510080)
临床上,对于骨的缺失或缺损,主要采取的治疗方法包括自体骨移植、异体骨移植及人造材料填补。自体骨移植由于受骨量的限制,而且会伴随新的创伤,在骨缺损面积较大时难以满足临床需求。而异体骨移植则有可能造成骨传导、骨诱导能力降低[1]。因此,近年来临床上越来越多的使用人造材料用于骨缺损的填充[2]。然而,对于如颌面骨等外形轮廓和解剖结构多样又复杂的缺损部位,应用传统工艺无法精确制备出与缺损部位完全匹配的修复体,这不但增加了术后引起并发症的风险,还可能导致修复失败[3-4]。而3D打印技术的兴起,则为解决上述问题带来了希望。本研究通过对一种由钛合金经激光3D打印技术制备的骨修复体植入兔骨组织后的生物相容性进行探讨,为后续进一步的安全性评价及临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 受试物 新型3D打印骨修复体,材料为Ti-6A1-4V钛合金。根据GB/T16886.6-2015《医疗器械生物学评价第6部分 :植入后局部反应试验》的规定制备成直径2 mm,长6 mm的圆柱状,表面经抛光处理并灭菌。
1.1.2 对照品 不锈钢,直径2 mm,长6 mm,圆柱状,表面光滑并灭菌。
1.1.3 试验系统 普通级新西兰大白兔15只[动物来源:广东省医学实验动物中心;实验动物生产许可证号:SCXK(粤)2013-0002],雌雄不限,雌性未产并无孕。实验动物选择理由:兔为常用实验动物,体型较小,便于试验操作,相关国家和国际标准均推荐采用家兔用于医疗器械骨植入试验。动物采用单笼单只饲养,饲养环境符合GB 14925-2010《实验动物环境及设施》的要求。动物给予合格的兔维持配合饲料自由摄食,经自动供水系统给予合格生活饮用水。
1.2 方法
1.2.1 试验前准备 使用30 g/L戊巴比妥钠,按1 ml/kg的剂量经耳缘静脉注射对动物进行麻醉。麻醉完成后对手术部位进行剃毛,随后将动物绑定于手术台上。采用75%乙醇和3%~5%碘町对手术部位进行消毒。
1.2.2 手术步骤 用手术刀逐层切开动物左侧胫骨植入部位皮肤、皮下,分离组织,沿肌间隙暴露胫骨皮质,使用低转速间歇在骨上钻孔,钻孔的同时用生理盐水充分灌洗,以免过热使局部组织坏死。钻孔2个,间距1.5 cm,将样品放置入钻好的孔洞中,使样品与骨组织尽量贴合紧密。植入后逐层缝合肌筋膜、皮下组织和皮肤,涂抹碘酒消毒,最后用灭菌纱布绷带进行包扎。同法在动物右侧胫骨植入2个对照品。
1.2.3 观察 手术后定期观察并记录动物的健康状况,包括植入局部、全身及行为活动是否有异常,1周后拆除缝合线。于植入后4周、12周、26周分别对5只动物施行安乐死,对植入部位正常组织结构进行肉眼观察,并切取包括植入物及其周围足够多未受影响的组织制作组织病理切片,进行组织学评价。
1.2.4 评价方法 分别从炎性细胞类型/反应及组织反应两方面进行记分(记分要求见表1和表2)。评价时,先根据表1和表2的规定,对每一动物植入物周围组织的炎症细胞反应程度及新血管形成程度、纤维化程度及脂肪浸润程度等组织反应程度进行记分,计算出每一只动物试验侧组织炎性细胞分类的记分总和(A1)和组织反应的记分总和(A2)。然后计算每只动物试验侧的总分(A):A=A1×2+A2,随后计算5只动物试验侧的总记分并求出平均值。同法计算对照侧的平均值,并按照表3判定反应程度。

表1 细胞类型/反应

表2 组织反应

表3 植入试验结果判定
2 结果
2.1 临床观察
所有动物均按计划实施手术,术后动物饮食规律,无异常表现。所有动物伤口愈合情况均良好,无明显渗出,未观察到伤口感染或干扰性创伤现象。
2.2 肉眼大体观察
植入后4周、12周、26周均各取出包含植入物及周围足够未受影响的试验侧和对照侧组织各10个。经肉眼观察,植入物周围组织无粘连、充血、水肿、坏死等异常情况。
2.3 显微镜观察
显微镜下观察可见:3D打印颌面骨修复体于骨植入4周后(见图1),骨髓腔内可见圆形空腔,空腔周边可见少量成骨组织及少量纤维组织囊形成;局部可见少量淋巴细胞浸润;骨髓腔内可见较多脂肪组织和骨髓细胞。植入12周后(见图2),植入局部炎症反应明显减轻,但仍可见少量淋巴细胞;骨髓腔内可见圆形空腔,空腔周边可见由骨组织形成的包囊,少量纤维组织增生;骨髓腔内可见脂肪组织增生。植入26周后(见图3),骨髓腔内可见圆形空腔,空腔周边由骨组织形成的包裹明显增厚,并少量纤维组织增生及脂肪组织。3D打印颌面骨修复体于骨植入4周、12 周及26周后的组织反应情况与同期对照侧组织反应情况相比,无明显差异。
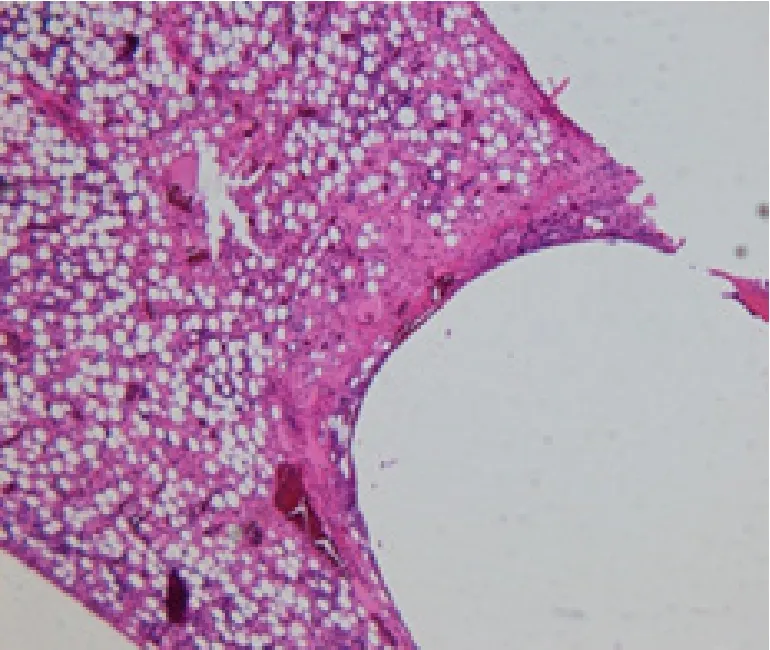
图1 3D打印颌面骨修复体骨植入后4周,HE染色
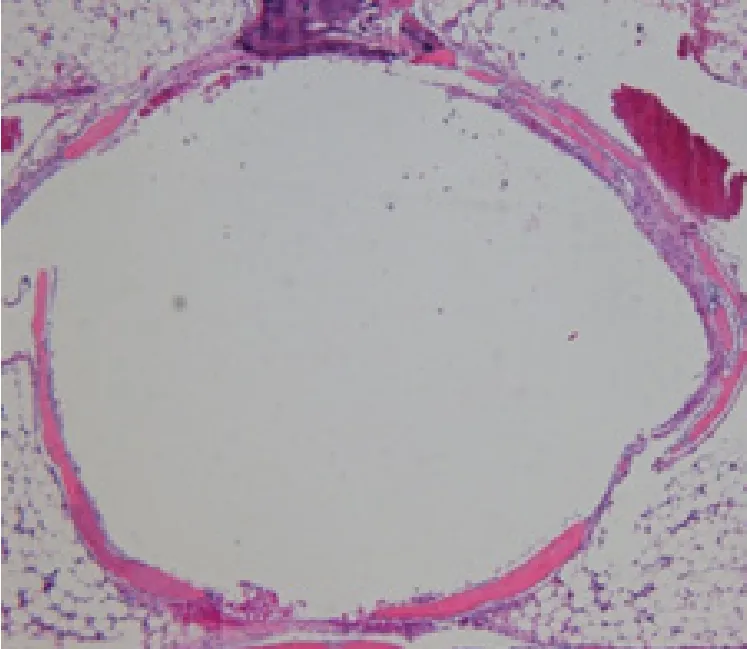
图2 3D打印颌面骨修复体骨植入后12周,HE染色

图3 3D打印颌面骨修复体骨植入后26周,HE染色
2.4 评价
根据表1和表2的记分要求对每个周期每只动物试验侧和对照侧的骨组织反应情况进行记分,并参照本文1.2.4的半定量评价方法,评价不同植入周期植入物的组织反应程度,见表4。
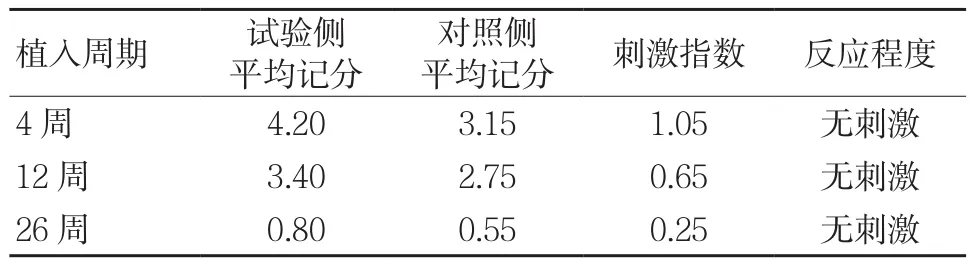
表4 3D打印颌面骨修复体骨植入记分结果
3 讨论
在骨缺失或缺损的临床治疗中,以往应用传统工艺,难以制作出与缺损区域的形态、生物力学等特征完全匹配的修复体,且制作工艺复杂,耗时又耗费材料[5]。随着3D打印技术的飞速发展,为上述难题的解决带来了希望。3D生物打印是组织工程学的一种高速仿形技术,它以计算机三维设计模型为蓝本,利用激光引导、喷墨打印等技术,将生物材料通过逐层堆积粘合,叠加塑型,最终形成仿真的组织或器官[6]。应用3D打印技术无需制作模具,就能在短时间内根据患者的骨缺损情况制作出个性化的、精度高的修复体。而用于3D打印骨缺损修复体的材料,其与骨组织的生物相容性是我们特别关注的,因为良好的生物相容性是评价材料生物安全性的重要组成部分,是决定其能否应用于临床的先决条件[7-8]。
本研究依据GB/T16886.6-2015《医疗器械生物学评价第6部分:植入后局部反应试验》的要求,对一种新型3D打印钛合金骨修复体的骨组织生物相容性进行探讨。在植入试验中,不管是试验材料还是对照材料,作为侵入机体的“异物”,均会引起不同程度的组织反应,其主要表现为:① 植入物周围组织的炎症反应程度及反应延续时间;②植入物周围组织纤维囊腔的形成过程及最终厚度;③植入物周围组织生物化学及组织化学改变及其延续时间等。这些反应可能与材料本身有关,也可能与手术操作方法及动物的个体差异等因素有关[9]。因此,在评价材料植入后的组织相容性时,需与经证实的阴性对照材料相比。本研究将3D打印钛合金骨修复体通过手术操作植入到兔的胫骨,并于植入后4周、12周和26周取植入物及其相应组织进行肉眼大体观察及显微镜观察,最后采用半定量评价系统评价其骨组织反应程度。肉眼观察结果显示,在各植入周期,所有动物的试验侧和对照侧植入部位均未出现粘连、充血、水肿、坏死等异常情况。进行显微镜下观察时,可见在植入早期,试验侧和对照侧植入物周围均出现淋巴细胞浸润,这可能由于植入物自身的微量小分子物质渗出刺激组织从而引起非感染性炎症;也可能与手术创伤引起微生物侵入有关[10]。在植入12周后,这种炎症反应明显减轻。植入材料作为“异物”进入机体,还会引起机体对其进行包裹而形成被膜,以将正常组织与植入物隔开[11]。本研究中可见,在植入早期,植入物周围便可见成骨组织和纤维细胞形成,随着植入周期的延长,新生骨组织及纤维组织逐渐增多,使包裹植入物的囊腔逐渐增厚,这也表明植入材料有良好的成骨效应。
综上所述,该新型3D打印钛合金骨修复体具有良好的生物相容性,在骨缺损修复方面具有广阔的发展和应用前景。目前,应用3D打印技术进行骨修复体的个性化制备已较为成熟,但对3D打印钛金属骨修复体的临床前动物实验研究和临床研究仍较欠缺,希望本研究能为3D打印钛金属骨修复体后续进一步的安全性探讨提供有限的实验依据。
