基质金属蛋白酶-11在骨肉瘤中的表达及生物学功能研究
2018-11-26缪晓刚阿布都艾尼热吾提王利瓦热斯江尼亚孜郭子刚王浩
缪晓刚,阿布都艾尼·热吾提,王利,瓦热斯江·尼亚孜,郭子刚,王浩
(新疆维吾尔自治区人民医院骨科中心创伤病区,新疆 乌鲁木齐 830001)
骨肉瘤也叫成骨肉瘤,是最常见的骨恶性肿瘤,常发生在20岁以下的青少年或者儿童[1]。骨肉瘤多见于长骨干骺端,约3/4发生在股骨下端及胫骨上端,极少数发生在手和足等四肢末端骨。骨肉瘤预后较差,未发生转移的骨肉瘤患者,5年生存率可达70%左右;而转移或者复发患者5生存率低于20%[2-3]。因此,针对骨肉瘤生长和转移的分子机制研究将为该病的治疗提供新的分子标记物和治疗靶点。基质金属蛋白酶11(matrix met alloproteinase-11,MMP-11)是MMP家族中的一员,研究发现其与多种人类肿瘤转移及预后密切相关,对肿瘤的分子治疗有重要的参考价值[4-5]。Nonsrijun等[6]发现MMP-11的表达与前列腺癌预后密切相关,高表达MMP-11患者提示预后不良;Yan等[7]报道低表达MMP-11胃癌患者5年生存率较高表达MMP-11患者明显升高;Hsin等[8]揭示MMP-11在舌癌中呈现高表达,过表达MMP-11可促进肿瘤细胞侵袭;此外Iwasaki等[9]报道过表达MMP-11可促进卵巢癌细胞恶性转移。目前关于MMP-11在骨肉瘤的研究尚未见相关文献报道,本研究旨在检测MMP-11在骨肉瘤和癌旁组织中的表达特征,并探究敲低其表达对骨肉瘤细胞增殖、迁移及凋亡的影响。
1 资料与方法
1.1 标本收集 2012年1月至2014年12月于新疆维吾尔自治区人民医院骨科中心收集40例骨肉瘤及配对的癌旁骨组织标本,每一例标本均经本院病理科进行病理确诊。标本的收集经本院医学伦理委员会认可并获得患者知情同意。40例标本中男性20例,平均年龄(52.61±3.42)岁;女性20例,平均年龄(51.77±4.58)岁。
1.2 RNA提取和逆转录反应 总RNA提取试剂Trizol购自美国Invitrogen公司。选取液氮保存的40例配对骨肉瘤及癌旁组织,依照Trizol试剂盒说明书,提取组织中的总RNA。遵照PrimeScriptTMRT Master Mix试剂盒说明将l μg RNA逆转录为cDNA。逆转录条件为:37℃ 15 min,85℃ 5 s,随后放置-80℃保存。
1.3 荧光定量PCR(Quantitative RT-PCR) 参照SYBR®Premix EX TaqTM ⅡPCR Kit试剂盒说明书,以合成的cDNA作为模版在LightCycler480Ⅱ荧光定量PCR仪上进行荧光定量PCR反应。反应总体系为:模版cDNA 1 μL,2×SYBR®Premix Mix 10 μL,上游引物0.5 μL,下游引物0.5 μL,RNase-free water 8 μL。MMP-11上游引物为5’-TGGGATAGACACCAATGAGATT-3’,下游引物为5’-AGCCCGCTTTGAAGAA-3’;以GAPDH为内参,GAPDH上游引物为5’-CAAGGTCATCCATGACAACTTTG-3’,下游引物为5’-GTCCACCACCCTGTTGCTGTAG-3’。反应条件为:98℃ 10 min,随后98℃ 10 s,60℃ 30 s,72℃ 30 s,共45个循环。
1.4 蛋白质印迹 参照RIPA(radio-immunoprecipitation assay)蛋白裂解试剂说明书,提取骨肉瘤细胞的总蛋白。采用BCA(bicinchoninic acid)定量试剂盒将提取好的总蛋白定量到2 μg/μL,按比例加入5×SDS上样缓冲液,105 ℃加热15 min使其完全变性。常规制备10% SDS聚丙烯酰胺凝胶,每孔上样量25 μL,随后电泳、转膜、封闭,加入抗MMP-11(ab119284,1︰1 000稀释)及GAPDH抗体(ab8245,1︰2 000稀释),4℃过夜并室温孵育相应的二抗1 h,随后使用TBST(tris-buffered saline with tween 20)洗涤3次,ECL(electro-chemi-luminescence)发光液处理后暗室内曝光胶片。
1.5 免疫组化染色 骨肉瘤及癌旁骨组织石蜡切片采用0.25% H2O2液处理20 min脱蜡。山羊血清于37℃孵育30 min后,加抗MMP-11兔多克隆抗体,后置于4℃冰箱过夜。加入生物素标记的二抗在37℃孵育60 min,随后加入辣根过氧化物酶标记的链霉卵白素孵育30 min,最后DAB显色约1 min,显微镜下观察。
1.6 细胞培养和转染 骨肉瘤细胞系(HOS和Saos-2)购自中科院上海细胞库。细胞培养基DMEM和胎牛血清FBS均购自美国Invitrogen公司。细胞采用DMEM+10%FBS在37℃,5% CO2细胞培养箱中进行培养。MMP-11 siRNA及阴性对照(siRNA control)合成于上海吉玛基因公司。取对数期生长的细胞进行铺板,采用Lipofetamine 3000转染试剂进行细胞转染,其中试验组转染MMP-11 siRNA,阴性对照组转染siRNA control。48 h后收集细胞,提取RNA和蛋白质,采用荧光定量PCR和蛋白质印迹观察两组细胞中MMP-11的表达变化。
1.7 四甲基偶氮唑盐微量酶反应比色法(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 取对数期生长的骨肉瘤细胞按照96孔板进行铺板,并使每孔细胞数达到6 500个。试验组转染MMP-11 siRNA,阴性对照组转染siRNA control,并连续4 d每天每孔加入15 μL MTT (5 mg/mL,Sigma,USA)与细胞共孵育4 h后弃上清,最后使用150μL二甲基亚砜(DMSO,Sigma,USA)溶解,并测各孔480 nm波长的吸光度。
1.8 细胞划痕试验 取对数期生长的骨肉瘤细胞按照6孔板进行铺板,并使每孔细胞数约为3.0×105个。当细胞完全贴壁后,用10μL枪头按比例划出4条横线。随后,试验组转染MMP-11 siRNA,阴性对照组转染siRNA control,细胞转染后每隔4 h进行拍照,观察和测定划痕宽度。
1.9 流式细胞仪技术 将对数期生长细胞使用6孔板进行铺板,并转染MMP-11 siRNA或siRNA control 48 h后参照AnnexinV FITC试剂盒说明书(invitrogen,USA)处理细胞,随后采用流式细胞仪检测各组细胞凋亡率。

2 结 果
2.1 MMP-11在骨肉瘤及配对的癌旁组织表达特征 经荧光定量PCR分析发现,骨肉瘤组织中MMP-11 mRNA的表达量较癌旁组织明显升高,以癌旁组织中MMP-11 mRNA的表达量为(1.0±0.22),则其在骨肉瘤组织中相对表达量为(3.94±0.79)(P<0.05)。免疫组化染色亦显示MMP-11蛋白在骨肉瘤组织的阳性率显著高于癌旁组织(见图1,P<0.05)。
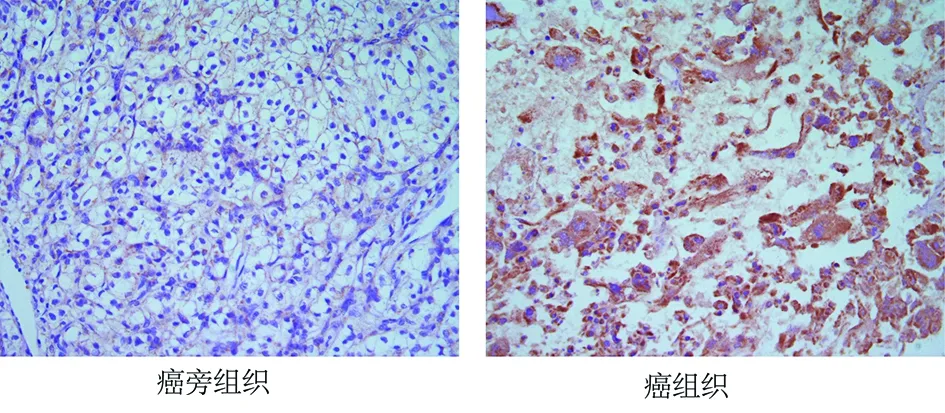
图1 免疫组化染色检测MMP-11在骨肉瘤及配对的癌旁组织的表达强度(×200)
2.2 体外转染MMP-11 siRNA对骨肉瘤细胞内源性MMP-11表达的影响 结果发现,转染MMP-11 siRNA后HOS和Saos-2细胞中MMP-11 mRNA的表达水平分别为siRNA control组的(0.22±0.12)倍和(0.46±0.15)倍,差异有统计学意义(P<0.05)。蛋白质印迹亦显示转染MMP-11 siRNA后HOS和Saos-2细胞中MMP-11蛋白的表达水平分别为siRNA control组的(0.17±0.09)倍和(0.41±0.16)倍,差异有统计学意义(见图2,P<0.05)。上述结果表明,MMP-11 siRNA可有效降低骨肉瘤细胞内源性MMP-11表达水平。

图2 体外转染MMP-11 siRNA对骨肉瘤细胞内源性MMP-11蛋白表达的影响
2.3 体外转染MMP-11 siRNA对骨肉瘤细胞增殖的影响 细胞增殖曲线显示,MMP-11 siRNA转染组骨肉瘤细胞增殖速度较siRNA control组明显降低,转染MMP-11 siRNA 2和3 d后HOS细胞生长抑制率分别为(13.52±5.24)%和(18.66±6.55)%(见图3,P<0.05);Saos-2细胞转染MMP-11 siRNA 1、2和3 d后细胞生长抑制率分别为(9.39±3.72)%、(15.43±4.86)%和(21.57±7.01)%(见图3,P<0.05)。

注:*为P<0.05
2.4 体外转染MMP-11 siRNA对骨肉瘤细胞迁移的影响 采用细胞划痕试验观察敲低MMP-11对骨肉瘤细胞迁移的影响。结果见图4。转染MMP-11 siRNA 24 h后HOS细胞划痕闭合约(36.23±11.56)%,而转染siRNA control 24 h后HOS细胞划痕闭合约(78.19±15.71)%,差异有统计学意义(P<0.05);转染MMP-11 siRNA 24 h后Saos-2细胞划痕闭合约(31.55±7.26)%,而转染siRNA control 24 h后Saos-2细胞划痕闭合约(89.65±21.86)%,差异有统计学意义(P<0.05)。

图4 体外转染MMP-11 siRNA对骨肉瘤细胞迁移的影响
2.5 体外转染MMP-11 siRNA对骨肉瘤细胞凋亡的影响 MMP-11 siRNA组HOS细胞的凋亡率为(7.78±3.31)%,而siRNA control组HOS细胞的凋亡率为(3.12±1.09)%,差异有统计学意义(P<0.05);MMP-11 siRNA组Saos-2细胞的凋亡率为(10.63±3.90)%,而siRNA control组Saos-2细胞的凋亡率为(2.57±1.41)%,差异有统计学意义(P<0.05)。
3 讨 论
基质金属蛋白酶家族(matrix met alloproteinases,MMPs)是一类依赖Zn2 +离子的内肽酶家族,具有降解细胞外基质的作用[10-11]。研究发现,MMPs可参与多种生理及病理过程,包括结构重塑、基质降解、炎性反应、细胞生长及血管生成等[12-13]。目前MMPs根据底物和结构域可划分为5大类:明胶酶、胶原酶、膜型金属蛋白酶、间质溶解素及类膜基质蛋白酶。近年来,MMPs在肿瘤中的研究日益增多,并发现其与肿瘤生长、转移、浸润及预后密切相关[10]。例如,MMP-7可降解细胞膜上的死亡配体,进而抑制死亡受体介导的细胞凋亡,促进肿瘤细胞生长[14];MMP-2和MMP-9的表达在浸润性乳腺癌组织显著高于癌旁组织和良性病变组织[15];结肠癌组织中MMP-2和MMP-9表达水平及阳性率均显著高于癌旁正常组织[16];此外低表达MMP-10宫颈癌患者预后明显好于高表达MMP-10患者[17]。
MMP-11是MMPs中的一员,研究发现其与多种人类肿瘤转移及预后密切相关,对肿瘤的分子治疗有重要的参考价值。目前关于MMP-11在骨肉瘤的研究尚未见相关文献报道。本研究以MMP-11为主要研究对象,通过采用荧光定量PCR和免疫组化染色分析我院骨科中心40例骨肉瘤及癌旁组织中MMP-11的表达特征,首次发现骨肉瘤组织中MMP-11 mRNA和蛋白的表达量较癌旁组织明显升高,上述结果与MMP-11在其他肿瘤组织的表达相符,提示高表达MMP-11在骨肉瘤中可能发挥促癌作用。
为了证实上述科学假设,我们委托上海吉玛基因公司合成MMP-11小干扰RNA(siRNA)和阴性对照(siRNA control),并体外转染至骨肉瘤细胞。结果发现,转染MMP-11 siRNA可有效降低骨肉瘤细胞内源性MMP-11 mRNA和蛋白表达水平,提示MMP-11 siRNA可靶向敲低MMP-11的表达,进一步用于观察其对骨肉瘤细胞增殖、迁移及凋亡的影响。随后MTT、细胞划痕试验以及流式细胞术发现,敲低MMP-11的表达可显著抑制HOS和Saos-2细胞的增殖及迁移能力,并增加细胞凋亡。上述结果强烈提示高表达MMP-11作为致癌基因促进骨肉瘤的发生发展。
综上所述,本研究发现MMP-11在骨肉瘤中呈现高表达,并初步揭示敲低MMP-11的表达可显著抑制HOS和Saos-2细胞的增殖及迁移能力,并增加细胞凋亡,提示高表达MMP-11在骨肉瘤的发生和发展过程中发挥促癌作用。
