红毛七总皂苷体外抑制乳腺癌细胞ZR-75-30增殖的研究
2018-11-24樊梦莹于润泽王红英展颖转
康 圆,樊梦莹,于润泽,王红英,展颖转
(西安交通大学药学院,西安 710061)
乳腺癌在女性中的发病率和致死率[1-2]在全球范围内高居第一,严重威胁女性健康。现有的治疗方式有手术治疗、化疗、放疗和内分泌治疗等。在临床上,大多数药物由于严重的不良反应以及耐药性的产生,治疗效果并不尽人意,不能满足临床的需要,这给抗乳腺癌药物的研发提出了巨大的挑战。随着分子生物学、细胞生物学、有效成分分离提取以及活性筛选等技术的发展,从天然植物中筛选特异性强的新型靶向抗肿瘤药物,已成为研究开发抗肿瘤药物的重要途径。
红毛七(RadixetRhizomaLeonticis)为小檗科红毛七属(CaulophyllumrobustumMaxim)植物,又名葳严仙,其主要药用部位为干燥根和根茎,常用于跌打损伤、月经不调、胃腹疼痛和类风湿性关节炎等疾病的治疗,主要分布于我国的东北、西北和西南地区。现代药理学研究表明,红毛七的主要药理学活性成分为生物碱[3]和皂苷,有抗炎、镇痛、抗氧化、抑菌及抗肿瘤等活性。目前采用化学分离及光谱方法分析鉴定出32种红毛七三萜皂苷,并确定了其化学组成[4]。本实验室成功地从红毛七中提取总皂苷,对其抗肿瘤活性进行研究,发现其对肝癌细胞及肺癌细胞的生长有抑制作用[5],但在乳腺癌中的作用未见国内外文献报道,本研究旨在通过体外实验考察其对乳腺癌细胞株ZR-75-30增殖、凋亡及迁移的影响及其作用机制。
1 仪器与材料
1.1仪器 MCO-15AC CO2恒温培养箱,购自日本Sanyo公司;Mini-002-0107自动计数仪及细胞计数板,购自美国Nexcelom公司;Model 550型酶联免疫检测仪,购自美国BIO-RAD公司;Cham Chemi Professional全自动凝胶成像分析系统,购自北京市赛智创业科技有限公司;TS-100多用脱色摇床,购自江苏省海门市其林贝尔仪器制造有限公司。
1.2试药 红毛七总皂苷由西安交通大学食品药品研究与检测中心提取分离得到[5];DMEM培养基(干粉) 购自美国Sigma-Aldrich公司;胎牛血清购自赛默飞世尔生物化学制品有限公司;胰蛋白酶购自美国Amresco公司;SDS-PAGE制胶试剂盒购自陕西先锋生物有限公司。
1.3细胞 人乳腺癌细胞株ZR-75-30(TCHu203),购自中国科学院典型培养物保藏委员会细胞库。
2 方法
2.1细胞培养 将人乳腺癌细胞ZR-75-30培养于含有体积分数10%的胎牛血清、100 u·mL-1青霉素与链霉素的DMEM培养基中,在37 ℃、体积分数为5%的CO2条件下培养,隔天换液,3~4 d胰酶消化传代培养,取处于对数生长期的细胞用于实验。
2.2MTT实验 将处于对数生长期的细胞消化计数,以2×104个·mL-1接种于96孔培养板中,待细胞贴壁后加入不同质量浓度(0.125,0.187,0.250,0.375,0.500和1.00 mg·mL-1)的红毛七总皂苷20 μL·孔-1,阴性对照组加入无血清培养基,每孔20 μL。分别作用24,48和72 h后,吸弃孔板中的培养基,加入MTT溶液,使其终质量浓度为0.5 mg·mL-1,37 ℃孵育4~6 h,小心吸去 MTT,每孔加入DMSO 150 μL,摇床上振荡15 min,用酶联免疫检测仪于490 nm波长处测定各孔吸光度值A,并计算细胞活力。

2.3平板克隆形成实验 将处于对数生长期的细胞接种于12孔板(200 个·孔-1),待细胞贴壁后,加入不同质量浓度的(0.05,0.01和0.2 mg·mL-1)红毛七总皂苷,作用7~10 d后,终止培养,弃上清液,用甲醇固定10 min,用PBS缓冲液洗涤2次,采用质量浓度为2 g·L-1的结晶紫染色15 min,后用三蒸水缓慢洗去未结合的染色液,室温干燥,于凝胶成像系统下拍照。同时规定50个细胞以上的细胞集落为1个克隆。将孔板置于倒置显微镜下,选取不同视野计算不同质量浓度药物作用后的细胞克隆形成数。
2.4Hoechst 33258染色 将处于对数生长期的细胞接种于12孔板中,贴壁后加入不同质量浓度(0.1,0.2和0.4 mg·mL-1)的总皂苷处理细胞,培养24 h后,吸弃培养基,每孔加入300 μL Hoechst 33258染色液,染色5 min后,用三蒸水冲洗干净,在340 nm波长下,观察细胞核的形态并拍照记录细胞数量,计算出凋亡比例。
2.5细胞划痕实验 取处于对数生长期的细胞接种于12孔板中,待细胞密度为80%时,用灭菌枪头在各孔中划一条直线。小心洗去脱离的细胞及碎片,更换新鲜培养基并给予不同质量浓度的红毛七总皂苷干预48 h,于相应时间点在显微镜下观察并记录对照组及各实验组细胞迁移的距离。
2.6Western Blot实验 取处于对数生长期的细胞接种于6孔板,贴壁后加入红毛七总皂苷,使其终质量浓度分别为0.1,0.2和0.4 mg·mL-1。作用48 h后,弃去培养基,用PBS缓冲液冲洗 2次,每孔加入含有蛋白酶抑制剂的RIPA裂解液,冰上裂解30 min;于4 ℃以12 000 r·min-1离心10 min,取上清液,用BCA法测定蛋白质量浓度。向蛋白样品中加入上样缓冲液,沸水中煮沸变性5 min,待冷却后将样品保存于-20 ℃备用。样品经质量浓度为100 g·L-1的SDS-PAGE 胶电泳分离,加入相应的一抗4 ℃孵育过夜;加入二抗(稀释比例为1∶20 000),在37 ℃孵育1 h,用TBST缓冲液冲洗4次,每次5 min。ECL化学发光检测条带,用蛋白灰度分析软件Image-Pro Plus分析各条带灰度值,以GAPDH为内参,确定目标蛋白的表达量。

3 结果
3.1红毛七总皂苷抑制ZR-75-30细胞的增殖 采用MTT法考察红毛七总皂苷对乳腺癌细胞ZR-75-30增殖的影响,实验结果表明,不同质量浓度的红毛七总皂苷(0.125,0.187,0.250,0.375,0.500和1.00 mg·mL-1)作用24,48和72 h时,对细胞的增殖均表现出抑制作用。统计结果分析得到,在不同时间点的细胞半数抑制质量浓度(IC50)值依次为0.539 1,0.348 2和0.259 6 mg·mL-1,且抑制率随着药物质量浓度的增加和孵育时间的延长而逐渐增大,具有明显的时间和剂量依赖性,见图1。
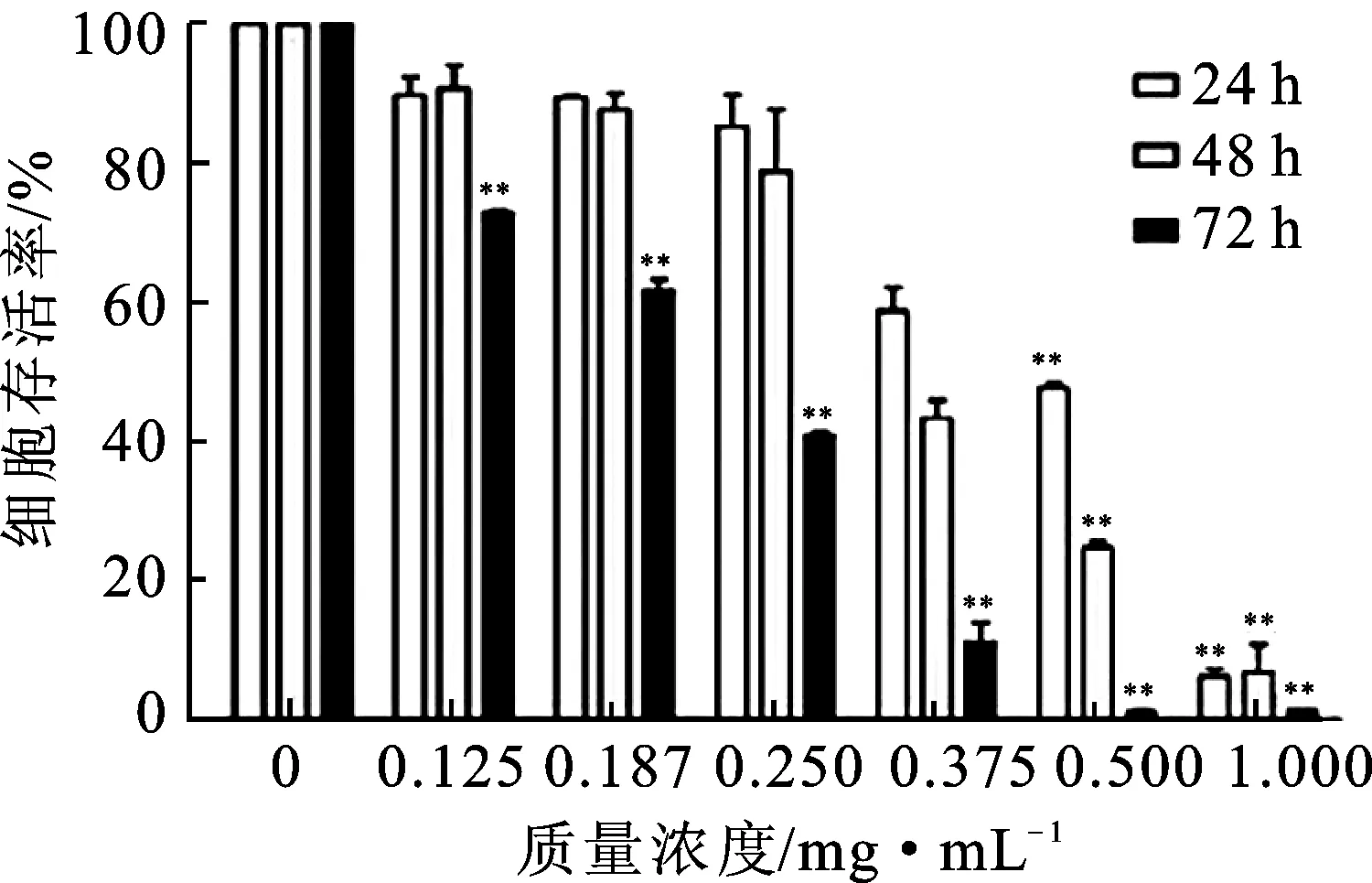
图1红毛七总皂苷对ZR-75-30细胞增殖的抑制作用
Fig.1 Inhibitory effect of RLTS on ZR-75-30 cells
通过平板克隆形成实验结果可知,与对照组相比,给药组克隆形成数量显著降低,且单个克隆中的细胞数量显著减少,呈现剂量依赖性。由此可知,红毛七总皂苷能显著抑制ZR-75-30细胞的增殖,见图2。
3.2红毛七总皂苷能够诱导ZR-75-30细胞凋亡 由Hoechst 染色实验结果可知,给药组细胞凋亡数量明显增加,且随着药物质量浓度的增加,细胞凋亡率呈上升趋势,不同质量浓度(0,0.1,0.2和0.4 mg·mL-1)的红毛七总皂苷给药组细胞的凋亡比例依次为0.82%,2.00%,2.57%和14.50%。同时 Western Blot 结果表明,随着给药质量浓度的增加,抑制凋亡蛋白Bcl-2的表达量显著降低(P<0.05),凋亡标志性蛋白Cleaved-Caspase-3和Cleaved PARP的表达量明显增多(P<0.05),其中质量浓度为0.4 mg·mL-1的红毛七总皂苷与对照组相比,差异有统计学意义(P<0.01),见图3。
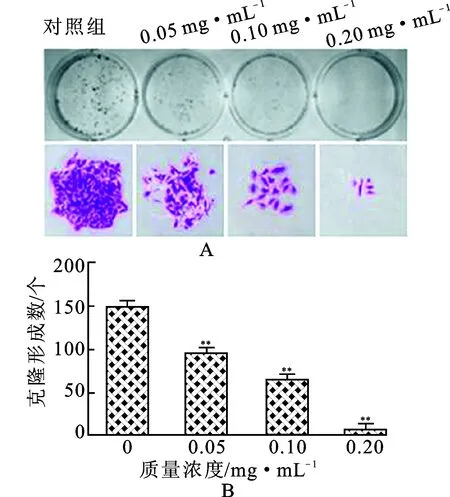
图2红毛七总皂苷对ZR-75-30平板克隆形成的影响(n=3)
A.平板克隆;B.平板克隆数统计。
注:与对照组比较**P<0.01。
Fig.2 Effect of RLTS on colony formation of ZR-75-30 cells (n=3)
A.colony formation;B.the statistics analysis of colones.
Note:**P<0.01 vs control group.
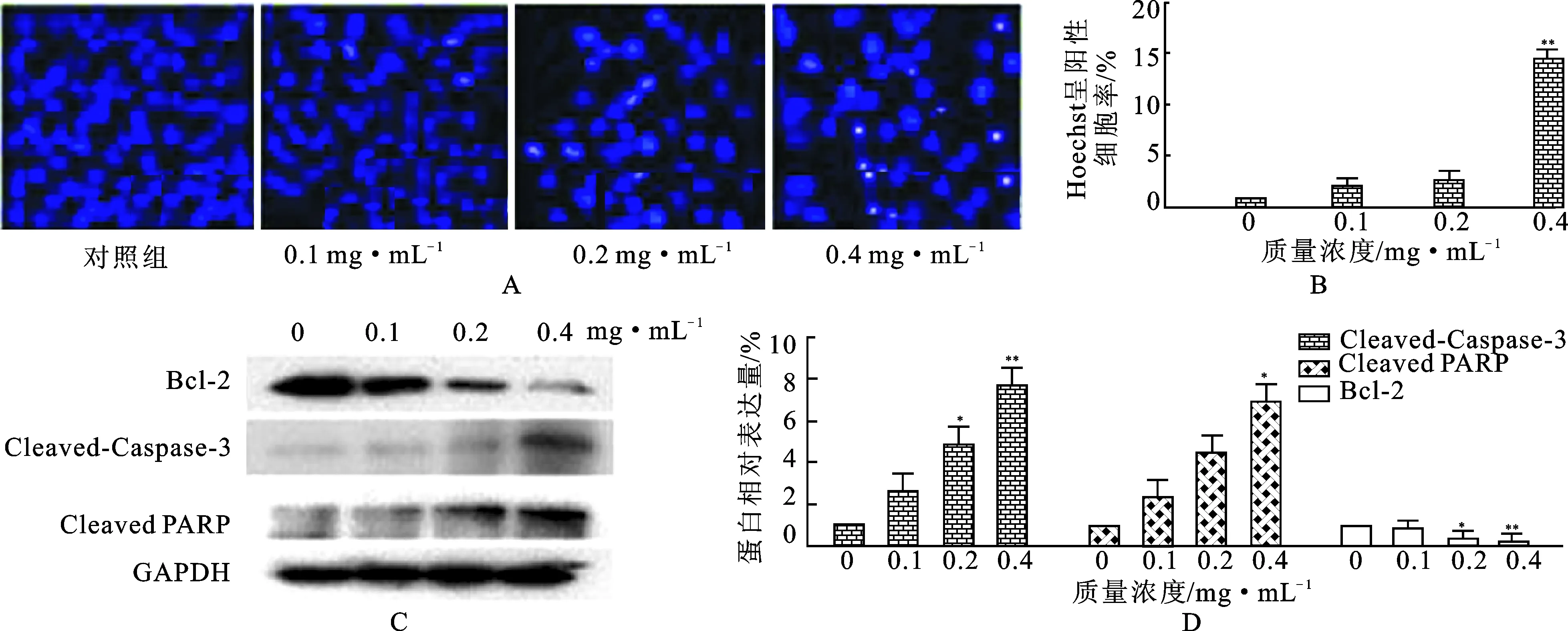
图3红毛七总皂苷对ZR-75-30细胞凋亡的影响(n=3)
A.Hoechst染色;B.A图统计;C.细胞凋亡相关蛋白表达;D.C图统计。
注:与对照组比较*P<0.05,**P<0.01。
Fig.3 Effect of RLTS on apoptosis of ZR-75-30 cells (n=3)
A.Hoechst assay;B.the quantification of A;C.Western Blot analysis of apoptosis-related protein expression;D.the quantification of C.
Note:*P<0.05,**P<0.01 vs control group.
3.3红毛七总皂苷对ZR-75-30细胞迁移能力的影响 通过细胞划痕实验进一步考察不同质量浓度红毛七总皂苷作用48 h后对乳腺癌细胞ZR-75-30迁移能力的影响。划痕实验结果表明,阴性对照组中细胞迁移速度较快,在48 h处划痕已接近完全愈合。在药物处理组中,细胞迁移明显受到抑制,并随着质量浓度的增大迁移距离逐渐缩短,表明红毛七总皂苷能显著抑制乳腺癌细胞ZR-75-30的迁移(P<0.01),且呈剂量依赖性。同时,Western Blot 结果表明,随着给药剂量的增加,基质金属蛋白酶MMP-2和MMP-9的蛋白表达水平均显著下调,见图4。

图4红毛七总皂苷对ZR-75-30细胞迁移的影响(n=3)
A.细胞划痕实验图;B.A图统计;C.细胞迁移相关蛋白表达;D.C图统计。
注:与对照组相比*P<0.05,**P<0.01。
Fig.4 Effect of RLTS on migration of ZR-75-30 cells (n=3)
A.the graph of wound scratch assay;B.the quantification of A;C.Western Blot analysis of migration-related protein expression;D.the quantification of C.
Note:*P<0.05,**P<0.01 vs control group.
4 讨论
1981~2010年开发的新型抗肿瘤药物中,79.8%新型抗肿瘤药物均来自天然产物或是以天然产物的结构为基础合成的[6],红毛七是中国传统中药材,而皂苷类化合物是一种在自然界植物中发现的成分,由于其具有多种药理作用,在许多植物中被认为是生物活性成分。本实验成功分离出总皂苷,采用MTT法对其抗癌活性进行了研究,结果表明,红毛七总皂苷能显著抑制乳腺癌细胞ZR-75-30的增殖,且呈剂量和时间依赖性。
在正常情况下,细胞增殖与细胞死亡间保持着动态平衡,这种平衡是维持多细胞生物自身稳定的重要因素,细胞增殖失控或细胞凋亡受阻均可导致肿瘤发生。而细胞凋亡是细胞程序化死亡的一种方式,是机体免疫自稳和免疫监视功能的重要组成部分,对肿瘤的发生、发展及药物治疗有重要影响[7]。现有研究表明,线粒体在调节细胞凋亡的过程中扮演着重要的角色[8-9],在凋亡因子的刺激下,引发线粒体外膜透化,激活半胱氨酸蛋白酶(Caspase)介导的信号级联反应,引起细胞形态和功能的改变,进而诱导细胞凋亡。其中Caspase-3是其关键的凋亡执行蛋白,PARP是其重要的作用底物,而Cleaved-Caspase-3是Caspase-3经剪切后产生的活性片断,其表达程度可反映Caspase-3的活性和凋亡情况。正常情况下,Caspase-3以无活性的Caspase-3酶原(Procaspase-3)形式存在,当受到机体内部或外界因素刺激时被激活,Caspase-3酶原裂解为活性体,激活凋亡的级联反应。从Western Blot实验结果可知,随着给药剂量的增加,Cleaved-Caspase-3和Cleaved PARP的表达量明显增多。由此推测,细胞的凋亡可能是通过下调与线粒体凋亡途径密切相关的抗凋亡蛋白Bcl-2的表达,进而活化凋亡执行蛋白Caspase-3,上调Cleaved-Caspase-3,裂解PARP,阻碍DNA损伤修复,诱导细胞的凋亡。
据统计,90%的癌症死亡是由癌症转移导致的[10],而肿瘤的侵袭与转移是恶性肿瘤重要的生物学特征,是一个多步骤的复杂过程。基底膜和细胞外基质(ECM)的生理动态平衡是防止肿瘤浸润、转移的一道天然屏障。基质金属蛋白酶家族(MMPs)是一组能够降解ECM的锌离子依赖型内肽酶,在恶性肿瘤内,MMPs主要由间质细胞以无活性酶原的形式分泌。MMPs活化后,可通过影响细胞内信号来介导细胞对宿主ECM的降解、控制肿瘤新生血管生成、调节细胞黏附、运动以及调控肿瘤细胞的生长,直接或间接参与多种生理及病理过程[11]。明胶酶类的MMP-2和MMP-9在肿瘤组织中的高表达已被大多数研究所证实[12-13],本研究中给药组MMP-2和MMP-9蛋白表达量均显著下调,表明红毛七总皂苷可能是通过下调乳腺癌细胞ZR-75-30中MMP-2和MMP-9蛋白的表达,从而抑制乳腺癌的转移。本研究证明了红毛七总皂苷具有良好的体外抗肿瘤活性,并确定了其作用机制,其主要发挥抗肿瘤作用的单体活性成分尚不明确,有待进一步研究。
