重组质粒pGEM-HERV-K gag的构建与鉴定
2018-11-24张宗彦刘妙龄贲亚琍
张宗彦,张 雯,刘妙龄,贲亚琍
(江汉大学:1医学院免疫疾病研究所;2学生工作部,湖北武汉 430000)
T载体为线状的DNA片段,3’端带有突出的“T”尾,同时Tap酶在PCR产物的5’末端加上非模板依赖性A碱基。TA克隆技术利用T碱基与A碱基互补配对,快速准确的使PCR产物在连接酶的作用下与T载体粘性连接,重组为环状DNA分子,从而极大提高克隆效率。人类内源性逆转录病毒(Human endogenous retrovirus sequences,HERVs)普遍存在于人类染色体中,是与逆转录病毒同源的DNA序列[1],约占人类基因组的8%[2]。近年来很多研究表明,HERVs基因的活化与多种疾病相关[3-4],包括与白血病[5]、乳腺癌[6]、1型糖尿病[7-8]等。本实验通过分离人外周血单核细胞(peripheral blood mononuclear cell,PBMCs),选择HERV-K基因p1442-1888片段,构建pGEM-T载体,为后续实验奠定基础。
1 材料与方法
1.1 实验对象与主要试剂
健康者血液由志愿者提供。主要试剂包括:淋巴细胞分离液(灏洋华科),总RNA提取试剂盒(天根公司),逆转录试剂盒(Thermo公司),凝胶回收试剂盒(QIAGEN公司),PCR Mix(Thermo公司),pGEM®-T克隆试剂盒(Promega公司),EcoRI(Thermo公司),质粒小提试剂盒(AXYGEN公司),异丙醇,感受态细菌(DH5α),LB培养基等。
1.2 引物设计与合成
引物依据美国国立卫生研究所基因及染色体基因组数据库提供HERV-K序列设计并合成。引物序列上游:5'-ATGAAAACGCCAATCCTGAG-3';下游:5'-CAAATGGCTGAATTGGGAAT-3'。预期扩增片段大小为446 bp。
1.3 实验方法
1.3.1 分离PBMC
用含肝素采集管采集全血5 mL,200 r/min离心10 min,分离最上层血清。用等体积的PBS替代吸取的血清,转移至50 mL离心管,从底部缓慢加入15 mL淋巴细胞分离液。800 r/min离心20 min后将中间层白色絮状物吸入一个新的50 mL离心管,加入PBS至50 mL刻度线。250 r/min离心10 min,弃上清。重新用30 mL PBS重悬细胞,细胞计数后,250 r/min离心10 min。
1.3.2 提总RNA并逆转录
按总RNA提取试剂盒要求进行总RNA提取。随后进行逆转录,在12 μL反应体系中加入Random Hexamer primer 1μL,总 RNA 0.1 ~ 5 μg,Nuclease-free纯水至12 μL,轻柔混匀,65 ℃水浴5 min。冰上静置后,加入 5 × Reaction Buffer 4 μL,Ribolock RNase Inhibitor 1 μL,10 mM dNTP Mix 2 μL,ReverAid M-MLV Reverse Transcriptase 1 μL,共 20 μL反应体系。置于PCR仪中进行逆转录反应:42℃60 min;70℃酶失活5 min,最后逆转录产物于-20℃保存。
1.3.3 PCR扩增
在20 μL反应体积中加入2×PCR Master Mix Green 18 μL,上下游引物各0.5 μL,模板 1 μL。 上述反应体系混匀后放入PCR扩增仪中进行扩增。PCR反应条件:94℃5 min,1个循环;94℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,12个循环;94 ℃ 30 s,52 ℃ 30 s,72℃ 45 s,25个循环;72℃延伸10 min。
1.3.4 凝胶DNA提取
PCR产物1.5%琼脂糖凝胶电泳后,紫外灯下切取DNA片段,放于1.5 mL离心管中称量后,加入3倍体积Buffer QG。50℃水浴10 min,检查其颜色为黄色后加入1倍体积异丙醇混匀并移入2 mL吸附柱内。17 900 r/min离心1 min,弃收集液。加500 μL Buffer QG于吸附柱内,17 900 r/min离心1 min,弃收集液。加750 μL Buffer PE于吸附柱内,17 900 r/min离心1 min,弃收集液。将吸附柱放入新的1.5 ml收集管内,加50 μL Buffer EB,放置1 min,17 900 r/min离心1 min,弃吸附柱。收集的液体即为提取的DNA溶液。提取DNA溶液通过光密度分析仪测定其浓度及OD值。
1.3.5 TA克隆
在10 μL反应体系中加入2×Rapid Ligation Buffer 5 μL,pGEM-T Easy Vector 1 μL,PCR 产物 3 μL,T4 DNA Ligase 1 μL,混匀后室温放置1 h,4 ℃过夜,构建HERV-K基因p1442-1888片段pGEM-T载体。构建完成的T载体2 μL与感受态细菌DH5α混匀,冰上放置30 min,42℃水浴90 s,冰浴2 min。加250 μL LB液体培养基,于37℃培养60 min(200 r/min)。将已转化的感受态细胞涂在培养皿(含有100 μg/mL的Ampicillin)中,倒置平皿,37 ℃培养过夜(12~16 h),出现菌落。蓝白斑筛选,挑取白色阳性单个菌落,加入到3 mL LB(含Ampicillin)液体培养基中,37℃培养过夜。菌液质粒小提试剂盒提取质粒。
1.3.6 重组质粒酶切和PCR鉴定
在10 μL反应体系中加入EcoRI 1 μL,10 × buffer EcoRI 1 μL,提取质粒 8 μL。将上述反应体系混匀后放于37℃水浴进行酶切4 h,琼脂糖凝胶电泳。阳性质粒酶切后生成500 bp左右条带。PCR扩增用于鉴定是否为阳性质粒(方法同前)。
2 结果
2.1 PBMC细胞计数
健康者5 mL血样可获得的白细胞总数为8×106。
2.2 PCR凝胶电泳结果
依据引物设计,PCR目标产物是分析HERV-K gag基因,序列长度446 bp。PCR产物经1.5%琼脂糖凝胶电泳显示,在250~500 bp之间可见一条特异扩增带,片段大小符合预期值(图1)。250 bp下方条带为引物二聚体,不影响后期实验。

图1 PBMC cDNA PCR凝胶电泳
2.3 重组质粒的鉴定结果
HERV-K gag基因成功插入载体,并转染成功的菌落为白色;没有基因插入但生成蓝色菌落的克隆为假阳性(图2A)。挑取单个白色菌落扩增后,质粒小提,并通过酶切和PCR验证。图2B显示,经EcoRI酶切,1.5%琼脂糖凝胶电泳显示质粒酶切片段大小在400~500 bp之间,与预期基因片段大小一致。图2C显示,以重组质粒为模版,经PCR扩增,1.5%琼脂糖凝胶电泳显示扩增产物在400 bp处,符合预期扩增片段(446 bp)。
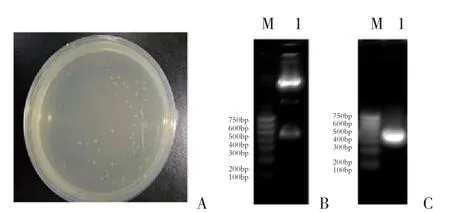
图2 重组质粒的鉴定
3 讨 论
HERV为古老的逆转录病毒残余物,这类病毒是在数百万年前整合到人类基因组中,并以孟德尔方式遗传至今[3,9-10]。由于逆转录病毒原始的分子特性,HERV可以通过逆转录和重组进行基因内的传播,因而创造出多种HERV基因[11-12]。长期的进化使HERV序列发生了大量的突变,导致其毒力丧失[13-15]。但研究表明,人类疾病与HERV相关,尤其是一些多因素疾病及与免疫功能失调相关的疾病,例如多发性硬化,1型糖尿病,类风湿性关节炎,系统性红斑狼疮等。
目前已经发现的HERV家族有31个,HERV-K家族因有完整的gag、env、pol等病毒基因的开放阅读框架(open reading frames,ORFs)和相应的逆转录活性,而具有潜在的生物学功能和致病性[16]。其中gag基因编码病毒的核心蛋白,具有调节细胞的跨膜转运,直接装配和促进病毒粒子萌芽的功能[5,17]。在NOD小鼠中的研究表明,胰岛来源的间充质干细胞表达HERV-K gag基因,提示HERV基因的异常活化可能是引发Ⅰ型糖尿病自身免疫反应的原因[18]。本实验以健康人外周血白细胞作为研究对象,利用TA克隆技术成功构建pGEM-HERV-K gag质粒,通过质粒测序进行gag基因的鉴定和比对,以此鉴别特异的HERV-K家族成员。
4 结 论
重组质粒pGEM-HERV-K gag的构建,可用于比较患者和健康人群是否携带或表达不同的HERV-K成员,为研究人类内源性逆转录病毒(HERV-K)gag基因序列与1型糖尿病病的关系,寻找疾病诊断和治疗的新靶向奠定基础。
