石斛合剂序贯法治疗糖尿病合并肝损伤的作用机制
2018-11-23萧自智饶焕文罗丽芬
萧自智 ,施 红 ,饶焕文 ,罗丽芬
(1.福建中医药大学中西医结合学院,福建 福州 350122;2.罗丽芬集团嘉文丽化妆品技术中心,福建 漳州 363000)
我国糖尿病人数已达 1.096亿,居全球首位,其中 2 型糖尿病(type 2 diabetes mellitus,T2DM)占90%~95%[1]。而 T2DM患者中非酒精性脂肪肝(non-alcohol fatty liver disease,NAFLD)的患病率为60%~80%[2]。T2DM合并NAFLD是一种代谢性疾病,往往与患者高脂高糖饮食有关[3]。高脂高糖饮食可以引起生物体内高活性分子如活性氧簇(reactive oxygen species,ROS)产生过多或消除减少,Kupffer细胞被激活并释放大量炎症因子TNF-α、IL-6、IL-1 等[4],导致肝组织细胞损伤[5]。选定由石斛、黄芪、知母、生地黄、丹参、地龙、葛根、五味子等组成滋阴清热、益气生津、活血化瘀的石斛合剂1方,选定由茵陈、栀子、大黄、萹蓄、滑石、甘草等组成清泻浊毒的石斛合剂2方,临床上先以石斛合剂1方,继以石斛合剂2方,随之再返回1方,如此循环,形成石斛合剂序贯法(the dendrobium mixture in order cycle method,DMOC),并且发现 DMOC 治疗T2DM合并NAFLD疗效较好,但是对其作用机制研究较少。为此,本研究通过构建高成模率和高稳定性的糖尿病大鼠模型,探讨DMOC治疗糖尿病合并肝损伤的作用机制。
1 实验材料
1.1 实验动物 40只健康清洁级雄性Sprague-Dawley 大鼠[许可证号:SCXK(沪)2012—0002],5周龄,体质量(180±10)g,由上海斯莱克实验动物有限责任公司提供。大鼠饲养条件为12 h白昼、12 h黑夜自动光照控制25℃、相对湿度55%的室温控制,给予自来水及标准啮齿类饲料自由饮水及进食,经1周的适应期后开始实验。大鼠饲料成分由国外动物饲料Dyets公司提供(见表 1、2),动物实验通过台湾弘光科技大学实验动物照护及使用委员会审查(同意书编号10405,计划执行期间2015年9月—2016年8月)。
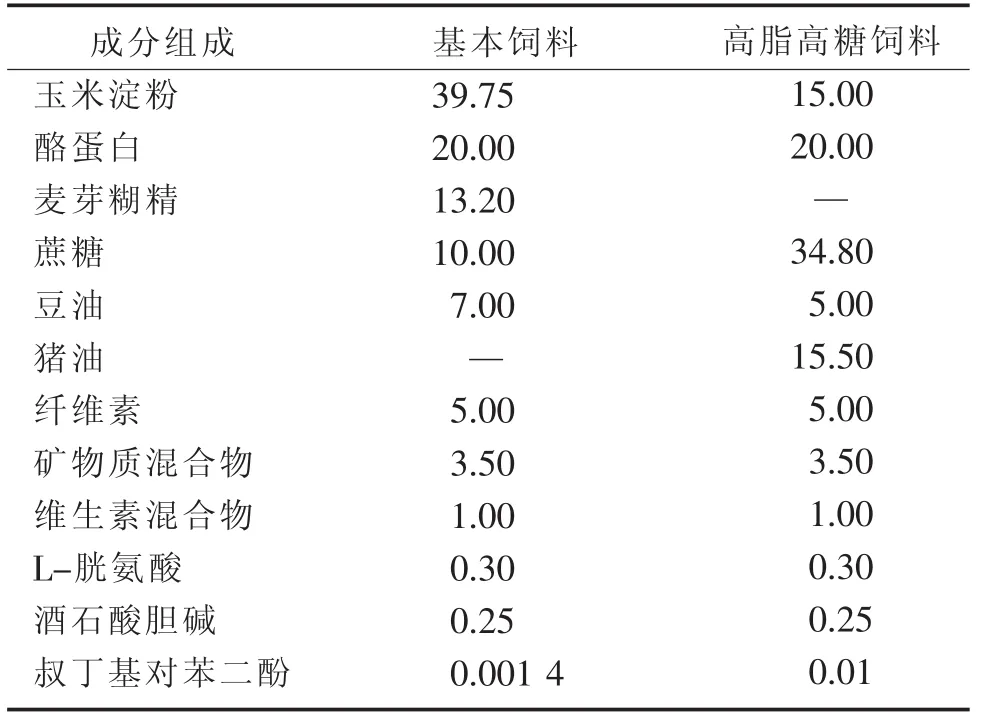
表1 大鼠饲料成分组成g/kg
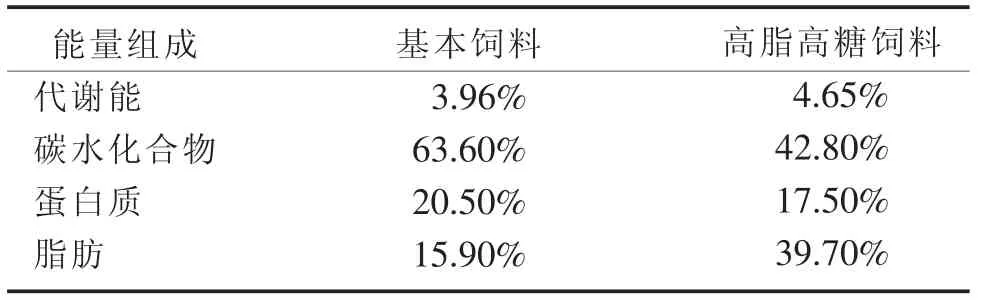
表2 大鼠饲料能量组成Kcal/g
1.2 实验药物 DMOC 1方(石斛15 g,黄芪21 g,知母 12 g,生地黄 15 g,丹参 18 g,地龙 15 g,葛根15 g,五味子 9 g,共计 120 g)、DMOC 2 方(茵陈 18 g,栀子 12 g,大黄 6 g,萹蓄 15 g,滑石 15 g,甘草 6 g,共计72 g)购自福建中医药大学附设国医堂。DMOC 1方和DMOC 2方均以常规水煎2次后合并、过滤、浓缩成 100 mL药液,DMOC 1、2方的含药量分别为 1.2、0.72 g/mL。
1.3 实验试剂与仪器 链脲佐菌素(streptozotocin,STZ)(美国 Sigma公司);ELx800酶标仪(美国 Bio-TEK公司);55I尼康生物显微镜(日本尼康公司);DSC-N158A台式离心机(台湾欧米克斯公司)。
2 实验方法
2.1 动物模型的建立与干预 采用随机数字表法将大鼠分成正常组、正常干预组、模型组和模型干预组,每组10只。正常组和正常干预组予以基本饲料喂养。模型组和模型干预组予以高脂高糖饲料喂养 4 周后,以腹腔注射 2 次 STZ 25 mg/(kg·m2),间隔72 h加以诱导,注射后第4天,用血糖测定仪测量血糖,筛选空腹血糖>11.1 mmol/L为糖尿病造模成功大鼠。饮食处理后出现高血糖、高血脂、肝功能异常现象,表明糖尿病合并肝损伤大鼠造模成功。喂养至第36~44周,正常干预组和模型干预组进行DMOC中药干预。根据体重计算灌胃量,每只实验大鼠的灌胃量参考文献[6]进行换算,临床上成人 1 包 /(60 kg·d),每包100 mL,相当于大鼠 0.05包/(0.5 kg·d),每包 5 mL。
2.2 组织取材与处理 实验期间大鼠进行采血检验分析,实验结束以二氧化碳对大鼠施行安乐死,组织取材保存于-80℃备用并进行肝活检。
2.3 观测指标及方法 观察每组大鼠的体质量、肝组织重量、腹腔脂肪重量。葡萄糖氧化酶法检测空腹血糖(FBG);紫外分光比色法检测 TC、TG、AST、ALT;DCF法检测活性氧簇(ROS);酶联免疫吸附测定法检测TNF-α、IL-6;HE染色法观察肝脏组织形态学变化。
2.4 统计学方法 采用SPSS 19.0统计软件进行分析处理。符合正态分布的计量资料以(s)表示,采用单因素方差分析。
3 结 果
3.1 4组大鼠体质量、肝组织重量、腹腔脂肪重量比较 见表3。
表3 4组大鼠体质量、肝组织重量、腹腔脂肪重量比较(s)

表3 4组大鼠体质量、肝组织重量、腹腔脂肪重量比较(s)
注:与正常组比较,1) P<0.01,2) P<0.05;与模型组比较,3) P<0.01,4) P<0.05。
腹腔脂肪重量/g 36.99±4.80 28.17±2.80 93.90±21.401)73.30±16.004)组别正常组正常干预组模型组模型干预组n 10 10 10 10体质量/g 626.00±50.10 586.70±31.50 781.70±114.901)654.80±51.304)肝组织重量/g 16.11±2.00 16.24±2.90 19.08±2.402)16.05±1.303)
3.2 4组大鼠血清血糖、血脂、肝功能指标比较见表4。
表4 4组大鼠血清血糖、血脂、肝功能指标比较(±s)
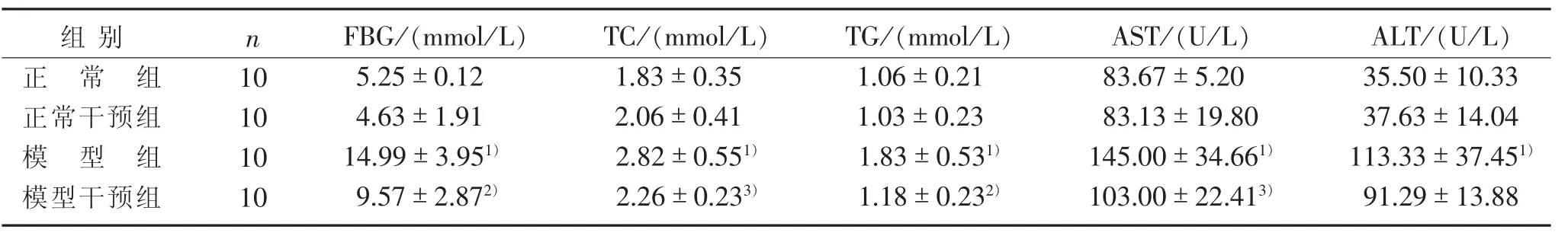
表4 4组大鼠血清血糖、血脂、肝功能指标比较(±s)
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.01,3) P<0.05。
TG/(mmol/L)1.06±0.21 1.03±0.23 1.83±0.531)1.18±0.232)组别正常组正常干预组模型组模型干预组n 10 10 10 10 FBG/(mmol/L)5.25±0.12 4.63±1.91 14.99±3.951)9.57±2.872)TC/(mmol/L)1.83±0.35 2.06±0.41 2.82±0.551)2.26±0.233)AST /(U/L)83.67±5.20 83.13±19.80 145.00±34.661)103.00±22.413)ALT/(U/L)35.50±10.33 37.63±14.04 113.33±37.451)91.29±13.88
3.3 大鼠肝组织形态学观察 正常组与正常干预组肝细胞大小均匀,肝小叶结构正常且肝索排列整齐,表明DMOC本身不会造成肝细胞毒性。模型组肝细胞呈空泡状变性,肝组织脂肪堆积明显,细胞间质增厚,纤维组织增粗,肝小叶结构破坏明显,中央静脉周围伴汇管区有炎性细胞浸润等情形;与模型组相比,模型干预组肝细胞坏死、炎性细胞浸润程度明显减少,表明DMOC具有改善糖尿病大鼠肝损伤的作用。见图1。
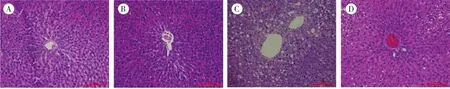
图1 4组大鼠肝组织HE染色图(×200)
3.4 4组大鼠血清ROS、TNF-α、IL-6变化比较见表5。
表 5 4 组大鼠血清 ROS、TNF-α、IL-6 变化比较(s)
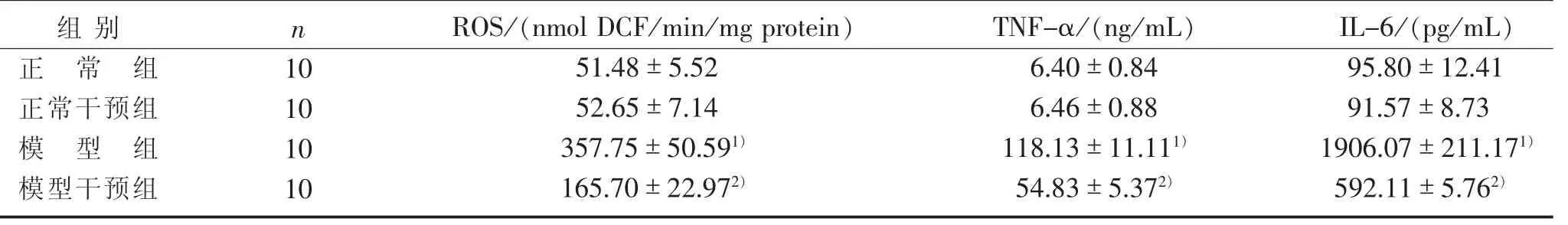
表 5 4 组大鼠血清 ROS、TNF-α、IL-6 变化比较(s)
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.01。
IL-6/(pg/mL)95.80±12.41 91.57±8.73 1906.07±211.171)592.11±5.762)组别正常组正常干预组模型组模型干预组n 10 10 10 10 ROS /(nmol DCF /min /mg protein)51.48±5.52 52.65±7.14 357.75±50.591)165.70±22.972)TNF-α/(ng/mL)6.40±0.84 6.46±0.88 118.13±11.111)54.83±5.372)
4 讨论
T2DM发生胰岛素抵抗导致肝脏脂质沉积,从而促进NAFLD的发生。以氧化应激和脂质过氧化为中心的“二次打击”学说认为:当脂肪细胞内活性氧的产生超过抗氧化系统的清除能力时,便产生氧化应激引起ROS产生,导致脂质过氧化损伤,致使Kupffer细胞激活并释放 TNF-α、IL-6、IL-1等炎性细胞因子和递质,进而引起细胞浸润、变性或坏死,最终造成肝损伤形成NAFLD。
糖尿病合并脂肪肝的大鼠造模是一种双疾病动物模型,近年来国内外学者利用大鼠建立糖尿病合并脂肪肝的病理模型进行大量研究[7]。本课题组基于脂肪肝造模的优缺点,最后决定采用雄性SD大鼠造模,实验时间延长为36周以符合人类30岁的年龄[8],高脂高糖饮食的成分组成参考国外动物饲料Dyets公司配方,模型组脂肪和总能量的实际摄入量明显高于正常组,并在预实验36周后活检观察到肝损伤后再进行中药干预。
在动物模型的研究中,血糖是观察糖尿病和药物治疗的最主要指标。血脂分析的重要指标TC是指血液中脂蛋白所含胆固醇的总和,TG是人体主要的能量储存单元,生命活力的重要来源,血清中持续的高浓度TG可导致肝细胞中脂肪过度堆积而引起脂肪肝病变。血清AST、ALT是肝细胞重要的酶,AST、ALT及AST/ALT比值是糖尿病合并脂肪肝的相对敏感指标,可反映肝纤维化、肝硬化的发展。正常完整的肝细胞膜中AST及ALT不会溢流到肝细胞外,但肝细胞本身受到某些因素的伤害后,使得肝细胞中所含的AST及ALT释放到血液中呈异常增加。
动物实验中还发现:大鼠予以高脂高糖饮食后,内脏的脂肪细胞增生肥大可诱导肝脏炎性浸润反应、脂肪变性坏死及肝纤维化,同时K upffer细胞释放大量炎性因子TNF-α、IL-6,随着病变的进展,炎性细胞和巨噬细胞将在肝细胞内不断增加,促进肝细胞内的氧化应激反应,ROS产生过多或消除减少,从而促进肝星状细胞激活、转化和合成细胞外基质,最终诱发进展性肝纤维化或肝细胞凋亡。检测ROS、TNF-α、IL-6水平可以用来判断糖尿病合并肝损伤的严重程度。
临床经验中用于治疗T2DM合并NAFLD的中药少见。石斛合剂序贯法是根据施红教授[9]提出的“糖尿病气阴两虚血瘀贯穿始终,伴阶段性痰、湿、热以及浊毒不祛,气阴难补”的观点,根据滋阴清热、益气生津、活血化瘀、清泻浊毒治则对糖尿病及其并发症进行治疗,DMOC包含2个方剂(1方、2方),临床上先以DMOC 1方滋阴清热、益气活血、补益脾肾,并随证加减,扶正为主,7剂左右;继以DMOC 2方清肝利湿泄浊,3剂,中病即止;随之再返回1方,如此循环,临床应用效果较好。本文的动物实验结果也表明:石斛合剂能改善糖尿病合并肝损伤大鼠的 FBG、TC、TG、AST、ROS、TNF-α、IL-6,以及改善大鼠的肝组织泡沫样变、细胞肿胀、界线不清、肝窦狭窄、中央静脉周围伴汇管区淋巴细胞浸润。此外,为了观察石斛合剂是否对肝脏具有毒性作用,本文在实验设计上增设了正常干预组,结果显示在肝功能及肝活检方面,石斛合剂不具肝细胞毒性。关于石斛合剂序贯法治疗糖尿病合并肝损伤大鼠的具体机制及安全性有待进一步研究。
