水稻spl5突变体类病变受光诱导的机理分析*
2018-11-23袁俊杰傅小进陈析丰马伯军
刘 辉, 袁俊杰, 傅小进, 陈析丰, 马伯军
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江师范大学 图文信息中心,浙江 金华 321004)
植物类病变(lesion mimic)是一类在没有病原物入侵时就能产生类似病变的坏死斑(lesion)的现象[1],其表型与植物抗病应答的超敏反应(hypersensitive reaction)非常相似,在抗病分子机理研究中受到广泛关注.有趣的是,植物类病变的表型虽然不依赖于病原物的入侵,但是却受光照、温度[2]或湿度[3]等外界环境因子的影响.尤其是光照,许多类病变的发生都需要光的诱导,如拟南芥突变体lsd1[4],mips1[5]和cat2[6]等的类病变都受光诱导,水稻spl7[7],lmi[8]和玉米les23[9]等突变体光照后出现类病斑,叶片遮光处理后则无类病斑.王建军等[10]进一步研究发现,水稻突变体lrd32和lrd40在所有单色光源下均产生类病斑,而lrd31,lrd36,lrd35与lrd37的类病斑则分别受紫外、黄光、蓝光诱导.这些研究说明光是诱发类病变的重要因子,但是具体的作用机理目前尚未明确.水稻类病变spl5(spottedleaf5)是γ射线辐射诱导突变体,本实验室克隆了水稻spl5基因[11-12],并发现其类病变的形成受光照诱导.本文对光诱导spl5突变体产生类病变的原因进行了研究,初步阐明了spl5类病变受光诱导的机理.
1 材料与方法
1.1 水稻材料及种植
5月初,取水稻spl5突变体及其野生型近等基因系浙辐802(OryzasativaL.ssp.Indica)的种子,浸水37 ℃,催芽2 d,撒播苗床,6月初移栽大田,进行常规水稻种植管理.播种60 d后,开始进行实验处理与取样.
1.2 叶片遮光与滤光处理
选取spl5用突变体植株完全展开且未出现类病斑的叶片,进行遮光和滤光处理.用锡箔纸遮光包住叶片一部分进行黑暗遮光处理;用2片相同的滤光片夹住叶片一部分进行滤光处理,采用的滤光片及其通过波长分别为:紫外光(200~400 nm)、蓝光(350~550 nm)、绿光(500~650 nm)、红光(620~700 nm)与红外光(>680 nm).7 d后,待叶片未遮光或滤光部位出现类病斑后,取下锡箔纸和滤光片,观察叶片遮光或滤光处类病斑发生情况.实验至少重复3次.
1.3 叶绿体结构的电镜观察
用刀片将水稻叶片切成1 mm×1 mm的小块,用2.5%戊二醛4 ℃固定24 h以上.样品用0.1 mol/L(pH 7.0)磷酸缓冲液漂洗3次,每次15 min,再用1.0%锇酸溶液固定样品5 h,0.1 mol/L(pH 7.0)磷酸缓冲液漂洗3次,每次15 min.样品经不同浓度梯度的乙醇脱水后,用环氧树脂进行包埋.样品在LEICA EM UC7型超薄切片机中切片,获得60~80 nm的切片,切片经2.0%醋酸铀饱和水溶液、枸橼酸铅各染色15 min,晾干后,在Hitachi HT-7700型透射电镜中观察叶绿体结构.
1.4 叶绿素与类胡萝卜素的含量测定
按照Porra等[13]方法,用80%丙酮提取光合色素,用分光光度计法测定叶绿素a、叶绿素b与类胡萝卜素的含量.测定时,分别选取长势一致的6株spl5突变体与6株野生型对照,每株上取1片同一位置且完全展开的叶片,分别测定叶绿素含量,并进行t检验,分析突变体与野生型之间的显著性差异.
1.5 H2O2组织化学染色
采用二氨基联苯胺(diamino benzidine,DAB)染色法[14]:取水稻叶片,浸泡在1 mg/ml DAB溶液(pH 3.8)中,置于25 ℃培养箱中光照8 h,取出叶片置于96%乙醇溶液中,沸水浴中脱色10 min,将叶片在新的96%乙醇中25 ℃浸泡4 h,观察叶片中是否出现红褐色斑点.
2 结果与分析
2.1 光促进spl5突变体的类病变发生
在自然光照下,水稻spl5突变体叶片上会产生棕褐色类病斑.用铝箔纸将spl5突变体上未出现类病斑的叶片进行局部黑暗遮光处理1周,未遮光部位出现明显的类病斑,而遮光部位则没有类病斑(见图1),表明光照可以促进spl5突变体类病变的发生.为了进一步研究不同波长的光对spl5突变体类病斑产生的影响,笔者将铝箔纸分别换成不同滤光片,分别是只能被紫外光、蓝光、绿光、红光、红外光透过,从短波到长波,覆盖了整个光波段的滤光片.对spl5突变体上未出现类病斑的叶片进行滤光处理,发现紫外光、蓝光和红光透过的部位出现类病斑,而绿光和红外光透过的部位则没有出现类病斑.这说明,紫外光、蓝光和红光是诱发spl5突变体类病变的重要因子.

直线标注区域为叶片的遮光或滤光部位;箭头指明类病斑情况 图1 经遮光或滤光处理的spl5突变体叶片及类病斑情况
2.2 spl5突变体的叶绿体发育异常
在植物光合作用中,红、蓝光是叶绿体吸收的主要光波.因此,笔者选取野生型叶片组织与spl5突变体上没有出现类病变的叶片组织,分别进行叶绿体亚显微结构的比较观察.与野生型相比,在spl5突变体叶细胞中发现叶绿体数目偏少,类囊体片层结构不明显,甚至扭曲(见图2).同时,光合色素含量的测定也表明,spl5突变体叶片的叶绿素a、叶绿素b与类胡萝卜素的含量都显著低于野生型对照WT(见图3).这些结果都表明,spl5突变体叶片中的叶绿体结构发育异常,叶绿素含量下降.
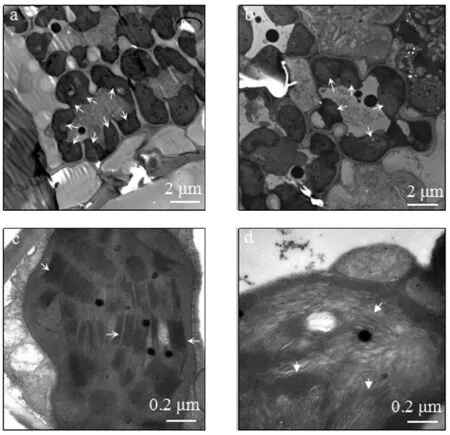
a:叶细胞野生型对照;b:叶细胞 spl5突变体;c:叶绿体野生型对照;d:叶绿体spl5突变体
2.3 光诱发spl5突变体中H2O2过量积累
叶绿体是植物体中活性氧产生的重要细胞器,而活性氧的过量积累能引起细胞坏死.通过对活性氧H2O2的组织化学染色发现,野生型叶片在光照下没有发生H2O2的积累;而spl5突变体叶片在光照下则发生大量的H2O2积累(褐色染色斑),但是经黑暗遮光处理的部位却没有发生H2O2的积累(见图4),说明光可以导致spl5突变体积累过量的H2O2.

图3 spl5突变体叶片的光合色素含量

图4spl5突变体叶片的DAB染色情况
3 讨论
目前研究表明,光照是诱导植物类病变发生的一个重要因素[7-9],但是其具体的机理并不清楚.据报道,水稻突变体lrd32和lrd40在所有单色光源下均产生类病斑,而lrd31,lrd36,lrd35与lrd37的类病斑则分别受紫外光、黄光、蓝光诱导,说明不同水稻类病变受光诱导的机理并不完全相同[10].本研究发现,紫外光、蓝光和红光均能够诱发水稻spl5突变体产生类病变,而绿光和红外光则不能.蓝光和红光是植物进行光合作用时叶绿体吸收最主要的2种光,而绿光和红外光则被叶片反射,几乎不被吸收利用.叶绿体通过吸收蓝光和红光的能量,将氧气作为光激发产生的电子受体,通过Mehler反应排散多余的能量,产生超氧阴离子、H2O2、羟自由基和单线氧等活性氧[15].高浓度活性氧对细胞有很强的毒害作用,但是叶绿体内抗氧化系统保持活性氧产生和降解的平衡,不会影响植物的正常生理功能.一旦叶绿体结构发生异常,很可能导致活性氧的过量积累,从而引发细胞坏死.笔者研究发现,在spl5突变体没有发生类病变的叶片组织中,其叶绿体结构出现异常,光合色素含量显著下降,并且光可以诱发spl5突变体叶片积累过量的活性氧.因此推测,spl5突变体的叶绿体发育异常,在光照下叶绿体不能进行正常的光能转化和电子传递时产生大量活性氧,引发细胞坏死,出现类病斑表型.
笔者还发现,红光诱发spl5突变体的类病变比蓝光更加明显.这可能有2个原因:一是叶绿体吸收最多的是红光,而蓝光其次;二是红光波长比蓝光长,叶绿体吸收相同能量的光时,红光能使更多的色素分子成为激发态,释放更多的能量.无论是叶绿体吸收更多红光,还是红光可以释放更多的能量,其结果都有可能使spl5突变体产生比吸收蓝光更多的活性氧,从而促进细胞的坏死.此外,紫外虽然不是光合作用的主要光源,但是紫外光能够使水稻叶片活性氧代谢紊乱和膜损伤[16],导致spl5突变产生类病斑.
spl5基因编码水稻剪接因子SF3b的亚基SF3b3,推测spl5基因突变可能影响了一些叶绿体发育或光系统相关基因mRNA的正常剪接,从而导致其叶绿体发育异常.拟南芥突变体lsd1的类病变可以被光捕获蛋白突变基因cao所抑制[4],而玉米突变体lls1的类病变也可被光能捕获蛋白突变基因ij1所抑制[17].可见,植物类病变的发生与光合系统有重要的关系,但是其具体的分子机制还有待于进一步深入的研究.
