强碱性熔融盐脱除生物质气化合成气中H2S的效果
2018-11-23王小波刘安琪赵增立李海滨
王小波,刘安琪,赵增立,李海滨
强碱性熔融盐脱除生物质气化合成气中H2S的效果
王小波,刘安琪,赵增立※,李海滨
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院可再生能源重点实验室,广州 510640; 3. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640)
为研究强碱性熔融盐对生物质气化粗合成气中酸性污染气体的脱除特性,在小型固定床反应器上,采用8.3%Na2CO3-91.7%NaOH对模拟粗合成气中的H2S进行脱除试验,并建立了脱除过程的数学模型。结果表明:强碱性熔融盐对粗合成气中的H2S有良好的吸收脱除效果,大多数试验工况下粗合成气中H2S脱除率均大于99.9%。熔融盐温度、表观气速等条件对H2S脱除过程影响较小,熔融盐静液高度、气泡大小等对H2S脱除过程有较为明显的影响。S被熔融盐吸收以后在熔融盐内主要以Na2S、Na2SO3、Na2SO4等形式存在,并在熔融盐内轴向及径向上基本均匀分布。模型分析表明,在熔融盐及气体物性确定的情况下,气泡大小、熔融盐静液高度等操作条件是H2S脱除率的主要影响因素。该模型可较好地预测H2S脱除过程,为利用熔融盐脱除粗合成气中H2S的实际应用提供理论依据。
净化;生物质;H2S;熔融盐;合成气;模型
0 引 言
生物质能是目前世界上的第四大能源。截止2015年,全世界共有生物质约300亿t[1],中国每年可以利用的生物质能源总量约为5亿t标准[2],如果全部加以合理利用,可解决目前中国20%左右的能源消费量。生物质主要由碳、氢、氧、氮、硫等元素组成[3]。植物中的硫是植物通过根系从土壤中吸收硫酸盐,以及通过气孔从大气中吸收SO2、H2S等其他形态的硫来满足自身的生长需要。植物中的S质量分数通常在0.05%~0.29%之间[4]。生物质气化技术是生物质高效利用的重要及首选方式之一。生物质气化技术是指限量供应氧化剂,通过热转化技术将固态生物质原料转换成富含H2、CO的合成气。在气化过程中,生物质中的S会转化为以H2S为代表的含S化合物进入到粗合成气中。因气化原料及工艺的差别,粗合成气中H2S的含量差异较大,约为(20~2000)×10-6。采用合成气制备液体燃料或者化学品的催化合成过程通常要求合成气中的H2S含量小于1×10-6[5],需要对生物质气化粗合成气中的H2S进行净化脱除。
熔融盐是指盐的熔融态液体,通常说的熔融盐是指无机盐的熔融体。目前研究较多的高温熔融盐为碱金属(Li、Na、K等)的碳酸盐、硝酸盐、氯化物等。由于熔融盐具有优异的导热及催化性能,有机物气化产生的焦油在熔融盐中被催化裂解[6],同时粗合成气中的酸性气体可以原位脱除[7-10],有机物在熔融盐中直接气化可以生产高品质合成气及富氢气体[6-13]。
将生物质在熔融盐中直接气化并原位脱除气化产生的H2S等酸性杂质气体,生产高品质合成气并用于生产液体燃料或化工品是生物质高值化利用的新途径。有研究者[12]在20世纪80年代开始采用熔融盐原位吸收废塑料气化产生的含S、Cl杂质气体。在此基础上Nygard等[13]探讨了采用熔融盐将生物质气化产生的有害物质(如:H2S、HCl等)原位吸收保留在熔融盐中的新思路。Kawase等[14]研究了熔融碳酸盐对粗合成气中H2S的脱除特性,发现温度高于900℃时,熔融碳酸盐对粗合成气中的H2S有较好的脱除效果,但由于所采用的为弱碱性熔融盐,吸收效果随试验条件变化波动较大,净化后粗合成气中H2S含量仍较高,同时文章也未对吸收效果的影响机理进行分析。本文采用试验研究及模型分析的方法详细研究了强碱性熔融盐对生物质中S气化产生的H2S的吸收脱除过程。
1 试验部分
1.1 试验原料
本文试验使用的混合熔融盐组成和熔融温度见表1,表1中所含无机盐为纯度99.5%以上的分析纯Na2CO3以及纯度99%以上的分析纯NaOH。试验中所用熔融盐制备方法如下:1)将无机盐粉末按表1中的比例混合均匀;2)随后将混合物放入反应炉中加热至700 ℃,保温30 min使混合盐完全熔融,得到单相均匀混合熔融盐;3)最后将熔融盐冷却备用。
试验使用的模拟粗合成气的主要组分为CO 35.25%、CO231.45%、H233.30%,同时根据试验需要混入一定比例的H2S。

表1 熔融盐组成及性质[10,12,15]
1.2 试验装置及方法
图1为熔融盐合成气成分调整的试验装置。试验装置主要包括合成气的进气及控制装置、熔融盐反应装置、电加热炉及气体采样装置。熔融盐反应装置采用316L不锈钢。

1.气体进口 2.流量计 3.测温控温 4.熔融盐 5.进气管出口挡板 6.反应管 7.电加热炉 8.气体采样口
熔融盐反应器(70 mm×400 mm)放置于电加热炉中,电加热炉温度采用数值温控仪控制。试验前将反应炉内熔融盐加热至某一指定反应温度,以90 L/h的流量通入粗合成气30 min以置换反应装置中的空气,反应系统产气稳定后,采集送气相色谱分析。
含有H2S的粗合成气从气体进口进入反应系统,在熔融盐反应炉内反应吸收,反应后气体进入采样系统采样分析。合成气中S采样系统参考相关文献[16-17]及EPA方法51[18],并略做改动,采用两级吸收系统:第一级采用0.1 mol/L HNO3,第二级采用0.1 mol/L NaOH+4%H2O2。
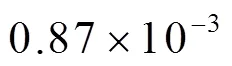
1.3 检测方法
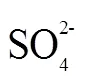
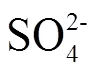
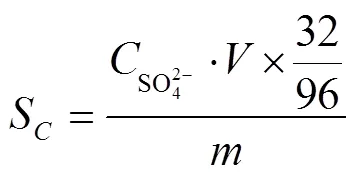
下文中H2S吸收率定义为

2 结果与分析
本文研究了熔融盐反应温度、气体流速及熔融盐液面高度等反应条件对熔融盐粗合成气中H2S脱除过程的影响。
2.1 吸收条件对H2S吸收效果的影响
2.1.1 进口粗合成气中H2S浓度对H2S吸收率的影响
从图2可以看出粗合成气中H2S体积分数在700×10-6~10 000×10-6之间变化时,S的吸收率从99.92% 增加到99.98%。进口粗合成气中H2S浓度大于10 000×10-6以后,在10 000×10-6~40 000 ×10-6之间变化时,吸收率随浓度的增加略有增加。这是因为根据化学反应动力学,气泡内H2S浓度的增加能加快气泡表面熔融盐中碱性物质吸收反应速率[19],有利于S吸收率的增加。

注:半径为 5 mm,反应温度400 ℃,熔融盐液面位置15 mm,气体流速0.5 L·min-1。
2.1.2 熔融盐液面位置对H2S吸收率的影响
图3为进气口挡板直径不同时,H2S吸收率随熔融盐液面位置的变化。试验条件下,H2S吸收率在熔融盐液面位置从−70增加到−20 mm时,H2S吸收率从99.3%增加到99.9%。熔融盐液面在−10~40 mm之间继续增加时H2S吸收率略有增加,但变化不是很明显。熔融盐液面位置的上升,有利于增加粗合成气与熔融盐的接触时间,从而提高熔融盐对H2S吸收率。熔融盐液面位置在−20到40 mm变化时,进气口挡板开孔直径对H2S吸收率影响较小,不同开孔直径的试验结果几乎重合。熔融盐液面位置在−70~40 mm之间变化时,H2S均保持在较高的吸收率(>99.3%)。这可能是一方面强碱性熔融盐中的NaOH对酸性H2S具有极好的吸收效果。同时还原性H2S比较不稳定,在熔融盐的高温强氧化环境下,容易发生分解反应,分解成H2和S[20]。
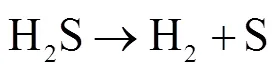
注:将坐标原点放在图1中反应管挡板5上,以竖直向上的方向为正时,得到的熔融盐液面位置的坐标。反应温度400 ℃,气体流速0.5 L·min-1。
Note: The origin of coordinates was located at the baffle-board in figure 1, vertical upward is positive, molten salts surface position coordinate is obtained. Reaction temperature is 400 ℃, air flow rate is 0.5 L·min-1.
图3 H2S吸收率随熔融盐液面位置的变化
Fig.3 H2S absorption at different surface position
2.1.3 气流速度对H2S吸收率的影响
2.1.4 熔融盐温度对H2S吸收率的影响
图5为不同进气口挡板直径下,H2S吸收率随反应温度的变化。随着反应温度从350 ℃增加到500 ℃,H2S吸收率从99.650%增加到99.995%。H2S脱除效率明显高于采用熔融碳酸盐时的脱除效率,同时吸收温度显著降低[14]。熔融盐温度升高,根据化学反应速率方程,熔融盐吸收H2S的化学反应速率增加;同时温度升高H2S从气泡传递到气泡表面的传质速率也增加。这些都有利于H2S吸收率的提高。

注:反应温度400 ℃,熔融盐液面位置15 mm。
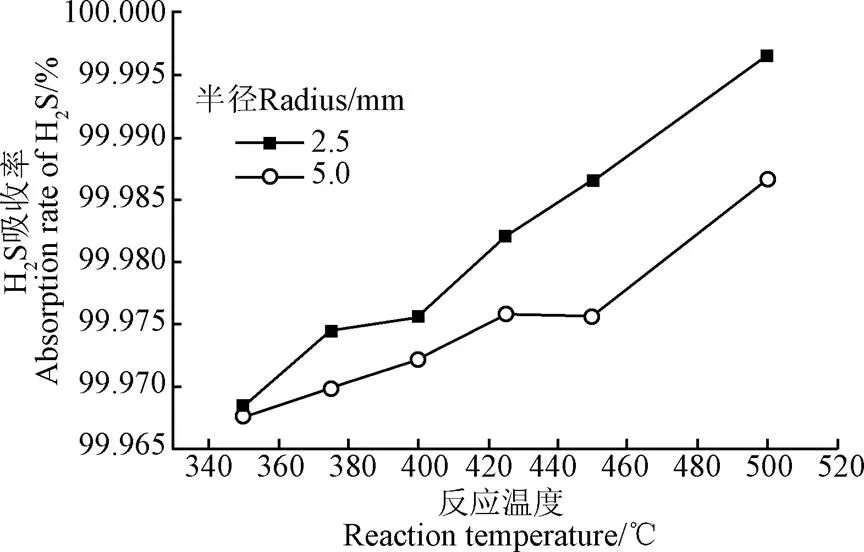
注:熔融盐液面位置15 mm,气体流速0.5 L·min-1。
2.2 熔融盐内S分布规律
待熔融盐冷却后,将反应吸收一定H2S后的熔融盐从反应炉内取出,并沿轴向分为7层,径向分为4层,熔融盐分割示意图如图6 a所示。分别测试每一小块熔融盐内S含量。
反应后熔融盐的XRD检测(图6 b)表明,被吸收的H2S在熔融盐中以Na2S、Na2SO3、Na2SO4等形式存在。如式(4)~式(6)所示,在高温氧化性NaOH-Na2CO3熔融盐环境下[21],熔融盐吸收H2S产生的Na2S被氧化生成更稳定的Na2SO3及Na2SO4。图6c、d为含S化合物在熔融盐内沿径向及轴向的分布。S在轴向上分布总的来说呈现从顶层到底层浓度增加的趋势。这可能与NaOH、Na2SO3、Na2SO4的密度有关,分别2.14、2.63、2.70 g/m3[22]。重力作用下密度稍大的Na2SO4向熔融盐底部富集,使得熔融盐底部S浓度增加。同时可以看出S在熔融盐径向上分布比较均匀,没有明显的变化规律,这可能是由于粗合成气通入熔融盐内,对熔融盐进行了剧烈的搅动使熔融盐吸收H2S形成的含硫盐在径向上均匀分布。
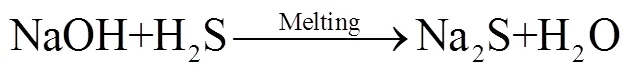



图6 反应后熔融盐物化特性
3 熔融盐H2S吸收模型
3.1 研究对象及模型假设
为简化模型建立过程,作如下几点假设:
1)由于气泡进入熔融盐液面内部的距离很小,在本文所有试验工况下,均小于40 mm,熔融盐液面高度变化引起的气泡体积变化
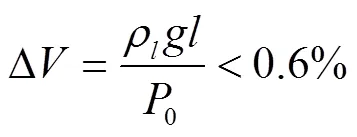
式中为熔融盐密度,kg/m3;为重力加速度,9.8 m/s2;为熔融盐液深度,m;0为大气压,Pa。
本文中大多数试验中使用的H2S浓度小于10 000×10-6,因H2S被吸收引起的气泡体积变化小于1%,气泡直径变化小于0.35%。因此模型计算中可忽略反应过程中气泡体积变化,假设反应过程中气泡体积不变。
2)熔融盐具有较大的热容及导热系数,因此忽略熔融盐与粗合成气反应过程中的吸热/放热现象所引起的熔融盐温度变化,假设反应系统温度均匀。
3)对单个气泡而言,气泡内部的CO2与熔融盐反应生成Na2CO3引起的熔融盐内NaOH与Na2CO3质量的变化很小。模型中假设在单个气泡的反应过程中,熔融盐成分不变。
3)由于气泡大小为毫米级,根据格雷斯的研究结论[23],这一尺度的气泡在运动过程中可维持较为稳定的球状外形。
3.2 H2S浓度变化模型
在球坐标系下,单位时间内从气泡内部传递到熔融盐中的气体的量为[24]
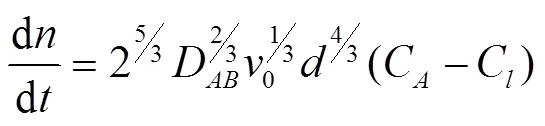
式中D为H2S在气泡表面向熔融盐传递的传质系数,kmol/(s·m2·kPa);0为气泡上升速度m/s;为气泡直径,m;C为气泡中H2S的摩尔浓度,%;C为熔融盐中H2S的摩尔浓度,%;类比传热学集总热容法[25],忽略熔融盐内部H2S的浓度梯度,可以得到
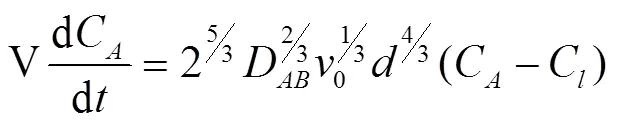
可以得到气泡内,某一气体组分随时间变化的浓度
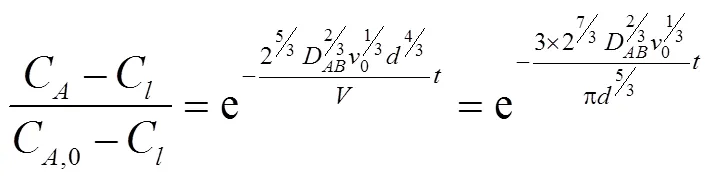
式中C,0为气泡中H2S的初始摩尔浓度,%;气泡上升很短一段距离后所受力达到平衡,气泡将以0匀速上升[26],此时有

式中熔融盐的黏度系数,Pa·s;粗合成气密度,kg/m3。
可以近似估算出气泡在熔融盐内部的停留时间为

熔融盐的黏度系数在10-3量级[27],可以估算出气泡在熔融盐内停留的时间在1 s量级。
将方程(11)和(12)带入方程(10)可以得到经过熔融盐吸收后,H2S吸收率随操作条件的变化

因熔融盐操作条件下,熔融盐对H2S的吸收化学反应速度很快,同时熔融盐的量远远大于粗合成气中的H2S,因此忽略熔融盐中的H2S的浓度,上式简化为

其中:
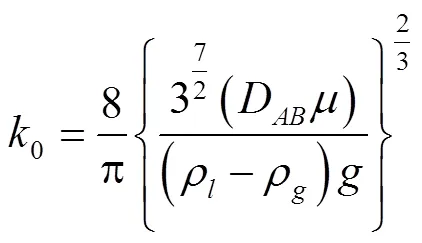
方程(14)等式左侧为粗合成气中H2S的吸收率,可以看出H2S的脱除率与熔融盐及粗合成气的物性及脱除操作条件有关。在某一指定的净化脱除条件下,熔融盐物性及粗合成气组分相对稳定,熔融盐液面高度(实际反应过程中对应熔融盐添加量)、气泡大小是脱除过程的主要影响因素。
将上式两边取自然对数可以得到
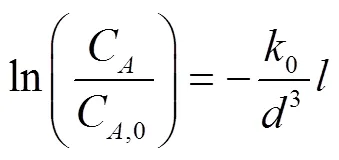
实际,气泡从熔融盐内部流出来以后,还会跟熔融盐液面的上表面继续反应一段时间,将该段时间等效为一个进气口埋入熔融盐液面内的深度0,可以得到

3.3 试验数据拟合
理论上根据式(14)就可以计算给定试验条件(气泡直径、熔融盐液面位置、熔融盐温度等)下H2S的吸收率。但目前对溶液物性的相关研究还不充分,气体在熔融盐内的传质系数、黏度以及熔融盐中挡板孔径与气泡直径间的关系还缺少详细的研究数据。
图7为将试验数据代入方程(17)得到的处理后的拟合结果。可以看出,按方程处理后的数据基本在同一直线上(半径为2.5及5.0 mm的数据拟合直线2分别为0.96,0.97),这表明本文建立的模型可以较好的描述强碱性熔融盐对粗合成气中H2S的吸收过程。同时该模型原则上也可以用于其他类似化工过程的计算。
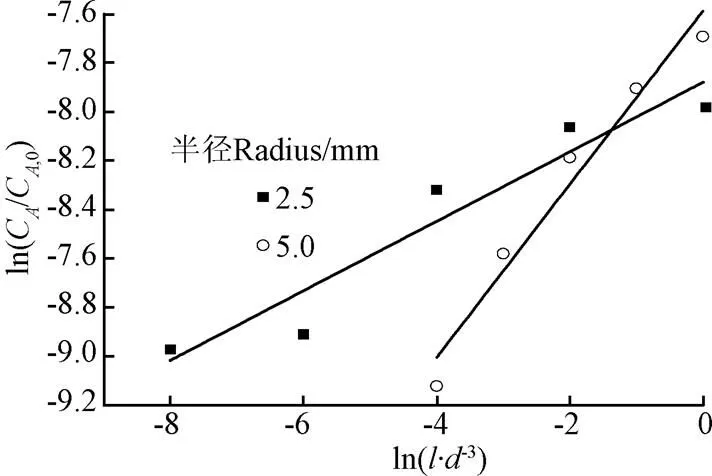
注:CA,0为气泡中H2S的初始摩尔浓度,%;CA为气泡中H2S的摩尔浓度,%;d为气泡直径,m;l为熔融盐液深度,m。
4 结 论
1)强碱性熔融盐在较低的温度下就可以高效地脱除粗合成气中的酸性H2S。优化工况下,强碱性熔融盐对H2S的吸收率大于99.99%,净化后合成气中H2S含量可满足常规合成工艺要求。吸收后的S以Na2S、Na2SO3、Na2SO4等化合物的形式固定在熔融盐中。含S化合物在熔融盐中径向分布相对较均匀,在轴向上呈现轻微的从顶层到底层浓度增加的趋势。
2)模型分析表明,净化后合成气中H2S浓度与熔融盐静液高度、气泡直径、物性参数等条件密切相关。在物性参数恒定的情况下,净化后合成气中H2S浓度与熔融盐静液高度与气泡直径的负三次方的乘积呈e指数关系。
[1] Rodriguez Correa C, Kruse A. Supercritical water gasification of biomass for hydrogen production: Review[J]. The Journal of Supercritical Fluids, 2018, 133: 573-590.
[2] 国家发展改革委. 可再生能源发展“十三五”规划[R].2016.
[3] 胡敏,于凤文,洪机剑,等. 5种生物质基本性质分析[J].西北林学院学报,2017,32(3):52-55.
Hu Min, Yu Fengwen, Hong Jijian, et al. Basic properties of five kinds of biomass[J]. Journal of Northwest Forestry University,2017, 32(3): 52-55. (in Chinese with English abstract)
[4] Andersson K J, Skov-Skjth Rasmussen M, Hjlund Nielsen P E. Industrial-scale gas conditioning including topsoe tar reforming and purification downstream biomass gasifiers: An overview and recent examples[J]. Fuel, 2017, 203: 1026-1030.
[5] Ruggeri F, Sudiro M, Papa I, et al. New process concept for H2S capture from syngas[J]. Energy & Fuels, 2011, 25(11): 5345-5352.
[6] Hathaway B J, Kittelson D B, Davidson J H. Development of a molten salt reactor for solar gasification of biomass[J]. Energy Procedia, 2014, 49: 1950-1959.
[7] Jiang H, Wu Y, Fan H, Ji J. Hydrogen production from biomass pyrolysis in molten alkali[J]. AASRI Procedia, 2012, 3: 217-223.
[8] 吴靥汝,姜洪涛,沈琦,等. KOH-NaOH复合熔融碱热裂解水稻秸秆制取富氢气体[J]. 化学工业与工程,2013,30(4):1-5.
Wu Yeru, Jiang Hongtao, Shen Qi, et al. Pyrolysis of biomass in molten koh-naoh to hydrogen rich gas[J]. Chemical Industry and Engineering, 2013, 30(4): 1-5. (in Chinese with English abstract)
[9] 唐强,于凤文,吕红云,等. 熔融碱裂解甘油制氢研究[J]. 太阳能学报,2014(4):721-725.
Tang Qiang, Yu Fengwen, Lü Hongyun, et al. Hydrogen production by pyrolysis of glycerol in molten alkali[J]. Acta Energiae Solaris Sinica, 2014(4): 721-725. (in Chinese with English abstract)
[10] 李小明,王小波,常胜,等. 熔融盐对生物质粗燃气的组分调整实验研究[J]. 燃料化学学报,2014(6):671-676.
Li Xiaoming, Wang Xiaobo, Chang Sheng, et al. Modification of biomass fuel in molten salts[J]. Journal of Fuel Chemistry and Technology, 2014(6): 671-676. (in Chinese with English abstract)
[11] Nygard H S, Olsen E. Review of thermal processing of biomass and waste in molten salts for production of renewable fuels and chemicals[J]. International Journal of Low-Carbon Technologies, 2012 , 7(4): 318-324.
[12] Bertolini G E, Fontaine J. Value recovery from plastics waste by pyrolysis in molten salts[J]. Conservation & Recycling, 1987, 10(4): 331-343.
[13] Nygard H S, Olsen E. Review of thermal processing of biomass and waste in molten salts for production of renewable fuels and chemicals[J]. International Journal of Low-Carbon Technologies, 2012, 7 (4) : 318-324.
[14] Kawase M, Otaka M. Removal of H2S using molten carbonate at high temperature[J]. Waste Manag, 2013, 33(12): 2706-2711.
[15] 乔宁强,杨贤,王斌,等. 离子色谱法测定天然气中H2S含量[J]. 石油与天然气化工,2017,46(6):82-85.
[16] 曾小岚,刘君,李丹,等. 离子色谱法间接检测原油中的硫化氢含量[J]. 分析测试学报,2006,25(6):108-111.
Zeng Xiaolan, Liu Jun, Li Dan, et al. Indirect det ermination of h2s in crude oils by ion chromatography[J]. Journal of Instrumental Analysis, 2006, 25(6): 108-111. (in Chinese with English abstract)
[17] EPA. Method 51:Midget impinger HCl/Cl2emission sampling train[S]. 1996.
[18] Matsunami J, Yoshida S, Oku Y, et al. Coal gasification by CO2gas bubbling in molten salt for solar/fossil energy hybridization[J]. Solar Energy, 2000, 68(3): 257-261.
[19] Canela C M, Alberici M R, Jardim F W. Gas-phase destruction of H2S using TiO2/UV-VIS[J]. Journal of Photochemistry and Photobiology A: Chemistry, 1998, 112(1): 73-80.
[20] Yao Zhitong, Li Jinhui, Zhao Xiangyang. Molten salt oxidation: A versatile and promising technology for the destruction of organic-containing wastes[J]. Chemosphere, 2011, 84(9): 1167-1174.
[21] Lide D R, ed. CRC Handbook of Chemistry and Physics[M]. Internet Version. BocaRaton: CRC Press, 2005.
[22] 戴干策,陈敏恒. 化工流体力学[M]. 北京:化学工业出版社,2005.
[23] 田恒斗,金良安,丁兆红,等. 液体中气泡上浮与传质过程的耦合模型[J]. 化工学报,2010(1):15-21.
Tian Hengdou, Jin Liang’an, Ding Zhaohong, et al. Coupling model for bubble rise and mass transfer process in liquid[J]. Journal of Chemical Industry and Engineering, 2010(1): 15-21. (in Chinese with English abstract)
[24] 郭宽良. 计算传热学[M]. 合肥:中国科学技术大学出版社,1988.
[25] 郑永令,贾起民,方小敏. 力学[M]. 北京:高等教育出版社,2002.
[26] Kanai Y, Fukunaga K, Terasaka K, et al. Mass transfer in molten salt and suspended molten salt in bubble column[J]. Chemical Engineering Science, 2013, 100: 153-159.
H2S removal from biomass gasification syngas using high alkali molten salts
Wang Xiaobo, Liu Anqi, Zhao Zengli※, Li Haibin
(1.510640;2.510640; 3510640)
Biomass energy is currently the fourth largest energy source in the world. The S content in plants is usually between 0.05% and 0.29%. Biomass gasification technology is one of the important and preferred methods for efficient biomass utilization. During the gasification process, S in the biomass is converted into an S-containing compound represented by H2S into the crude syngas. It is necessary to remove H2S in the biomass gasification crude syngas to meet the needs of the follow-up synthesis process. In order to study the removal characteristics of acid-polluted gases from biomass gasification syngas by high alkali molten salts, experiments were carried out in a small fixed-bed reactor with 8.3% Na2CO3-91.7% NaOH to remove H2S from simulated crude syngas. And then model of H2S removal was built by ignoring H2S concentration gradient in molten liquid. The results showed that high alkali molten salts had excellent effect on H2S removal. In most case, more than 99.9% of H2S was absorbed under the experiment conditions. The H2S content in the purified syngas could meet the requirements of the conventional synthetic process. When superficial gas velocity variation between 0.87×10-3-4.3×10-3m/s, and the reaction temperature increased from 350 to 500 ℃, H2S absorption rate remained higher than 99.96%. Molten salts temperature, superficial gas velocity had no significant effect on H2S removal process. While molten salts static liquid height, bubble size increased the residence time of bubbles in the molten salts and the mass transfer efficiency between the molten salts, and the bubbles had greater effect on H2S removal. When the molten salt static liquid heights increased from -70 mm to 40 mm, the H2S absorption rate increased from 99.32% to 99.99%. After been absorbed, S stabilized in molten salts mainly in forms of Na2S, Na2SO3and Na2SO4with a uniform radial distributions and a slight increase in the concentration from the top layer to the bottom layer in the axial direction which may be due to the coarse aeration of the molten salt through the molten syngas. By ignoring H2S concentration gradient in gas bubble, mathematical model between H2S removal rate and reaction condition was established from gas-liquid mass transfer equation from spherical coordinate system. The model showed that when the physical property of molten salts and syngas were fixed value, bubbles diameter, molten salts static liquid height were the main factor that affects H2S absorption. Function of H2S concentration in gas bubble was in inverse proportion to the cube of the diameter, and proportional to the height of the static liquid heights of molten salts. This model can reliably predict the H2S removal process, and it can provide a theoretical basis for the practical application of H2S removal from crude synthesis gas using molten salt. In principle, the model can also be used for calculation in other similar chemical processes.
purification; biomass; H2S; molten salt; syn-gas; models
王小波,刘安琪,赵增立,李海滨. 强碱性熔融盐脱除生物质气化合成气中H2S的效果[J]. 农业工程学报,2018,34(22):206-211. doi:10.11975/j.issn.1002-6819.2018.22.026 http://www.tcsae.org
Wang Xiaobo, Liu Anqi, Zhao Zengli, Li Haibin. H2S removal from biomass gasification syngas using high alkali molten salts[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 206-211. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.22.026 http://www.tcsae.org
2018-05-28
2018-07-07
国家自然科学基金资助项目(51506208)
王小波,博士,主要农业废弃物热化学转化及燃气净化相关研究。Email:wangxb@ms.giec.ac.cn
赵增立,博士,研究员,主要从事农林废弃物热化学转化研究。Email:zhaozl@ms.giec.ac.cn
10.11975/j.issn.1002-6819.2018.22.026
S216
A
1002-6819(2018)-22-0206-06
