番茄辣椒微型根系形态原位采集系统设计与实现
2018-11-23汪小旵王凤杰
鲁 伟,汪小旵,2,王凤杰
番茄辣椒微型根系形态原位采集系统设计与实现
鲁 伟1,汪小旵1,2※,王凤杰1
(1. 南京农业大学工学院,南京 210031; 2. 江苏省现代设施农业技术与装备工程实验室,南京 210031)
为实时获取浅根系作物的根系生长形态,设计了一种可用于多点测量的微型根系形态实时原位采集系统。系统主要由微型摄像头和光学放大元件等组成(体积1.5 cm3),采集的图像通过无线模块发送至终端。采用基于区域生长的根系图像分析方法,以腐蚀图像为出发点,膨胀图像为终止点,结合相似性准则进行区域生长、区域标记和区域保留,来滤除土壤孔隙和杂质等对图像产生的干扰,从而提取根系轮廓,并通过图像形态学计算得到根长密度、根系平均直径等形态参数。以此系统采集樱桃番茄、辣椒根系形态参数,试验结果表明,根系长度测定值的绝对误差不超过1.5 mm,相对误差不超过5.3%;根系平均直径绝对误差不超过0.09 mm,相对误差不超过6.7%。与土壤采样法测定值相比,在0~10、>10~20、>20~30和>30~40 cm 4个土壤层内2种测定方法根系平均直径决定系数2>0.87(<0.01),根长密度在30 cm深度以内的土壤层决定系数2>0.81(<0.01)。证明本文设计的微型根系形态实时原位采集系统具有较高的准确性,可用于浅根系作物形态的多点观测。
形态;算法;测量;根系形态;微型根系形态采集系统;多点采集;实时获取;区域生长算法
0 引 言
植物的根系具有吸收水分和养分,影响产量和品质的作用[1-3]。根系形态研究是植物营养学、植物生理生态学最重要的内容[4-7]。实现对根系形态的实时、准确获取是农业生产中提高水肥利用效率、保证作物品质和产量的前提和关键[8-9]。由于作物根系生长过程中的不可见性,根系形态检测与研究发展缓慢,传统的方法包括挖掘法、剖面法、土柱法、水培法和雾培法等[10]。挖掘法、剖面法、土柱法等方法均属于破坏性方法,不能用于长期对同一根系的生长和分布进行追踪,且操作方法费时费力,误差较大;水培法、雾培法不使用传统的土壤或者基质进行作物培育,而采用水或者雾气培养法,便于根系的直接观察。但此种方法严重改变了作物原有的生长环境,其试验结果不具有普适性。
随着计算机技术、微电子技术等的发展,出现了X射线计算机层析成像[11-13](X-ray computed tomography, X-CT)和微根窗[14-17]等方法。X-CT法是采用医学影像技术获取作物根系图片,并使用计算机图像处理技术进行三维重建。吴长高等采用西门子四排螺旋CT获得了理想的原位根系CT序列图像[18]。但此种方法成本很高,要求特定的培养基质,目前使用范围十分狭小。微根窗根系观测法是由Bates在1937年提出的,它是一种非破坏性、定点直接观察和研究植物根系的方法[14]。该技术主要由一个插入土壤中的微根窗管、摄像头、标定手柄和照明装置等组成。Upchurch等使用微光单色摄像机通过透明的丙烯酸管进行原位根观测,证明此方法与土壤取样法存在线性关系[19]。廖荣伟等采用微根管观测法,对试验地上玉米主要生育期的根系生长动态进行定期直接跟踪监测,结果表明微根管法与方形整段标本法有较好的一致性[20]。张志山等用微根窗观测柠条根系生长动态,并与土钻法进行比较,证明微根窗观测根系具有一定的优势[21]。
微根窗法在一定程度上解决了传统方法的不足,能够长期对同一点的根系进行观察。然而,很多研究表明,微根窗的材质、光照以及安装会对根系土壤产生扰动[22-23]。微根管与土壤间的紧实程度往往会影响根系原有的生长环境,如果土壤与微根管接触不紧密,并不能获得最真实的根系生长状态,导致根系生长不具有代表性[22,24];丙烯酸树脂、丁酸盐纤维素管对根系寿命产生影响[25]。玻璃管对根系的影响最小,但容易破碎,使用寿命较短;微根窗在地上部分留有手柄等控制部分,一般使用黑色不透明罩子防止光照影响根系生长[17,25-27]。同时,对于浅根系作物,微根管体积较大,会严重影响根系的生长,且不便于多点观察。此外,此种设备价格十分昂贵,且不能多点观察。
本文设计一种适用于浅根系作物的微型根系检测系统。通过实时采集土壤内根系的形态图片,利用图像处理技术计算根系形态信息,并与土壤采样法进行相关性验证,以实时、准确、多点获取根长密度、根系平均直径和根体积等参数。以期从多个观测点对根系进行实时观测,提高根系形态检测的准确性和时效性,减轻根系研究过程的劳动强度和提高效率。确保为植物营养学、植物生理生态学提供可靠的数据依据,为精准农业的实施提供技术支持。
1 微型根系形态采集系统设计与工作原理
微型根系形态采集和处理系统由微型摄像头、光学放大元件、发光二极管(LED,light emitting diode)、供电电源和无线模块以及图像处理部分组成,如图1所示。摄像头像素为1 200万CMOS(互补金属氧化物半导体,complementary metal oxide semiconductor),分辨率1920×1080像素,视角120°,工作温度-20~80 ℃,相对湿度15%~85%,能够满足土壤中的测量环境。放大器放大倍数为1~100倍可调。由于根系生长在不见光的土壤内部,在获取根系图像时需要外加光照。为了减小光照过强或者过弱对成像产生干扰,在顶部安装4个多波段LED光源,采用脉冲宽度调制方式,实现LED光源强度与波段调节控制。为防止土壤导电导致短路,系统电路部分用热熔胶密封。系统整体尺寸为1.1 cm×1.1 cm×1.2 cm,体积约1.5 cm3。采集到的根系图像通过无线网卡控制模块(型号:MEDIATEK MT7601)形成的Wi-Fi信号传送至终端接收装置(手机或个人电脑)。

1.微型摄像头 2.电路板(包括电源和无线模块) 3.光学放大元件及支柱 4.LED照明灯×4
2 根系图像处理与形态计算
2.1 基于区域生长算法的根系复原
采集到的根系原图如图2a、b所示,土壤孔隙结构会对图像产生严重的干扰,一些细小的根系不能被很好地保留。中值滤波和加权均值滤波(图2c、d)很难将这些干扰去除,因此需要对图像进一步进行根系的复原,以保证为根系形态计算提供完整和可靠的数据。

图2 根系原图像和低层处理图像
区域生长算法是将空间上具有某些相似性质的临近像素点合并起来连接成区域[28-30]。根系像素点在灰度值上比较相近,并且由根系连接成的区域一般比土壤孔隙和其它干扰要大,因此考虑采用区域生长的方法对经过简单低层处理的图像进行进一步处理。首先,将根系图像分别用3×3像素的结构元素进行腐蚀和膨胀处理。区域生长算法的初始点选择为腐蚀后的图像的第一个像素点,终止点为膨胀后的图像。相似性准则通过试验确定为相邻像素间的灰度差值不大于20(反复试验获得)。区域生长过程中会形成多块连通区域,这些区域可能包含不同的根系、土壤孔隙、杂质以及其他的干扰因素,因此需要对不同的区域块进行提取和标记,以便于后面进一步处理。其具体实现环境为Matlab R2013a,实现过程为:
1)将经过低层处理的根系图像分别进行腐蚀和膨胀,以腐蚀的图像里搜索第一个像素为生长点,以膨胀图像为最大边界开始生长,同时初始化一个与同样大小的空集合,并将置于中,置为“已标记”状态。
2)若的8邻域像素在中处于“未标记”状态,且满足与中心像素之间的差值小于阈值,则将加入,置为“已标记”状态,并将中对应位置的像素点置为0(避免重复生长或者陷入死循环)。
3)以为出发点继续生长,重复2)的过程,直到该小区域无满足要求的生长点为止,将该区域标记为第1连通区域。
4)重复1)、2)、3)过程,找到个连通区域
根系像素数目一般较大,而土壤孔隙、杂质以及其它的干扰因素相对较小,因此对于中像素数目小于50(试验获得)的予以删除,保留剩下的像素点,从而得到去除土壤孔隙干扰的根系图像。如图3所示土壤中孔隙和杂质引起的噪声基本上被滤除,侧根保留量有所增加。

图3 基于区域生长算法的根系轮廓图像和根系细化图像
2.2 根系长度测定
2.2.1 根系图像细化
为了统计根系的长度需要将得到的根系图像进行形态学细化,采用最大圆盘法[31-33]得到单像素连接根系图像(图3c、d)。由于图像在细化过程中最终保留的骨架点为所有圆盘的圆心的连接点,因此根系的长度在起始点和终止点分别减少了半径长度1和2,在长度计算过程中需要进行补偿。
2.2.2 根系长度
细化后的根系图像长度的自动测量,目前已有一些不同的算法,如链码跟踪法、一次扫描长度法和蚕食法[12]等,其性能各有优劣。本文对蚕食法进行改进,提出一种简单、直观的算法——有界蚕食法。该算法首先对根系的长轴进行提取,即获取一条最长轴根的长度。然后模拟蚕吃桑叶的方式,对整幅图像进行扫描,以搜索到某一条根的端点为初始点,以轴根为边界,统计每条侧根的长度,并予以删除,直到非轴根全部被删除掉,如图3c,图3d所示,细化后的根系保留了大部分侧根。


式中表示根长,1表示对角方向连接的像素个数,2水平和竖直方向连接的像素个数,1和2为补偿的长度,表示图像上像素距离与实际像素距离的对应关系,为光学元件的放大倍数。
2.3 根系平均直径
根系平均直径按下式计算
S=·/(2)

式中S表示根系总面积,表示根系平均直径,表示根系总像素个数。
2.4 根系体积
根体积V的计算可以近似把根看作柱体形状,由总根长和根系平均直径可得
V=π(/2)2×(4)
式中要根据试验获得根长密度来进行估算。
3 试验与分析
3.1 微型根系形态采集与处理系统性能验证
为了验证根系形态采集系统及根系图像处理方法的可行性和精确度,于2018年3月5日、3月13日、3月21日和4月1日各采集线椒根系片段20个和樱桃番茄根系片段20个(长度从5到50 mm不等,总计辣椒根系样=80,番茄样品=80),根系类型包括仅含有1级侧根、仅含有2级侧根以及同时包含1级侧根和2级侧根的根系片段。将每个样品混入原生长区域的土壤,于根系上表面放置微型根系形态采集器,并将微型采集器摄像头面正对着根系样品。然后,将每个试验区土壤体积减掉1.5 cm3,再将土壤覆盖到微型根系形态采集器上,并用橡胶锤轻轻镇压,以尽量保证土壤紧实度与原生长土壤环境一致和使根系样品片段能够在采集器的成像区厚度范围内(3 mm)。这样做的目的是避免实地采集过程中因挖掘导致根系移动或断裂,进而获取真实的数据以验证该系统的性能。图像采集后,将每个样品用蒸馏水洗净并用吸水纸巾擦拭干净,用手工法测量根长和根粗,用排水法测量根系体积,作为真实值与图像法对比。由于根系体积值是由根长密度和根系平均直径来进行间接计算,因此仅绘制根长密度和根系平均直径图表。
由表1的结果可以看出,本文的根系形态采集系统及其图像处理算法能较为准确的获得采集系统视野范围内的根系参数。对于不同的根系均能以较高的精确度获得根长、平均直径等参数,为进一步使用该系统进行原位监测提供了较为可靠的技术手段和方法。

表1 微型根系形态采集系统性能
3.2 微型根系形态采集与处理系统原位监测
为了验证微型根系形态采集和处理系统的性能,进一步进行了原位监测试验。试验于2018年3月27日开始,于6月9日结束。种植于经过筛选(1 cm×1 cm)的通用型种植营养土。设置3个小区,每个小区面积为2×2 m2,株距20 cm,按如图4所示的方式于定植期分别在距离地表5,15,25和35 cm的土层安装根系采集器。为了减小随机误差和变异性,于每个土壤层中距离根系中心线(竖直方向实线)5 cm和10 cm处各安装一个采集器,并用其平均值来代替这一层的根系形态参数。由于根系形态采集器个数的限制,一个周期试验仅能采集6株作物样本(每株作物安装有8个微型根系采集器),为了充分利用有限的采集器获取更多的样本数据和获得处于不同生长期的根系形态,连续进行6个周期试验,分别于3月27日,4月2日,4月15日,5月17日,5月24日和5月30日2-3片真叶时定植,并同时埋入微型根系形态采集器。每个周期采样挖掘后所有的采集器立即使用进入第2周期,整个采集周期共计获得36个样本。采集根系图像的同时,用柱形取样器,以植株根系中心点为圆心,10 cm为半径,每10 cm深度为一层,挖掘4个土壤层的含有根系的土柱。用蒸馏水洗掉根系上附着的土壤,然后将根系用吸水纸巾擦拭干净,最后手工测量每一层土壤中根系的根长密度和根系平均直径。试验期间,灌溉营养液配方采用山东农业大学番茄辣椒配方,灌溉方式为肥液灌溉每周一次(200 mL/株,Ec值为2.0 mS/cm,pH值为6.5),灌溉水每日一次(200 mL/株)。

图4 微型根系形态采集器摄像头布置示意图
图5为定植后第13天和第32天土壤采样法和微型根系采集法获得的根长密度和根系平均直径对比图。由图可知,在辣椒定植后第13天,在浅层土壤中,距根系中10 cm处的根长密度为0.137 cm/cm3,远小于平均值(0.199 cm/cm3)。而距根系中心线水平距离为5 cm处根长密度为0.273 cm/cm3,表明在作物生长初期浅层土壤中根系横向伸展不明显,主要集中在水平距离为5 cm范围内;而在作物生长中后期,根系的横向扩展程度逐渐增加。在大于25 cm的土壤中,在距根系中心线水平距离为10 cm处根长密度值略大于平均值,表明在深层土壤中根系有横向伸展增大趋势,这可能与水肥供应以及作物主动获取适宜生长空间有关。

注:图中1,2,3,4分别表示土壤采样法测定值,微型根系采集法在每个土壤层测得的平均值,采集器与根系中心线水平距离为5 cm处的测定值,采集器与根系中心线水平距离为10 cm处的测定值。
从总体上来看,辣椒的根系主要集中在深度为20 cm以内的浅层土壤中,辣椒根系的根长密度随着深度增加而减少。微型根系采集法获得的根长密度略小于土壤采样法。这种现象产生的原因主要有两个,一方面是随着深度的增加,根系数目减少,微型根系采集器布置个数较少,能捕获到根系的概率相应减少;另一方面,由于采集器在不同深度的土壤层中的布置方式较为单一,其对根系的拦截可能不够全面。微型根系采集法获得的根系平均直径与土壤采样法在各个土壤层总体趋势较为一致,能够反应根系的真实平均直径。
为了进一步分析微型根系采集法和土壤采样法之间是否具有相关关系,将采集到的样本(=36)进行回归。定义微型根系采集法测定值为,土壤采样法测定值为,计算其线性回归关系,如表2所示。在深度0~10,>10~20,>20~30和>30~40 cm处,2种方法测得的根系平均直径呈现较好的线性关系,2分别为0.902、0.899和0.813(<0.01)。在深度>30 cm的土壤层相关关系较低,这可能是因为辣椒是浅根系作物,其根系主要聚集在10~20 cm左右的土壤层,尤其是在作物生长的早期阶段,>30 cm深度处的根系十分稀疏,微型根系形态采集系统很有可能无法捕获稀疏的根系,导致采集到的根长密度值与实际测量值相关性较低。
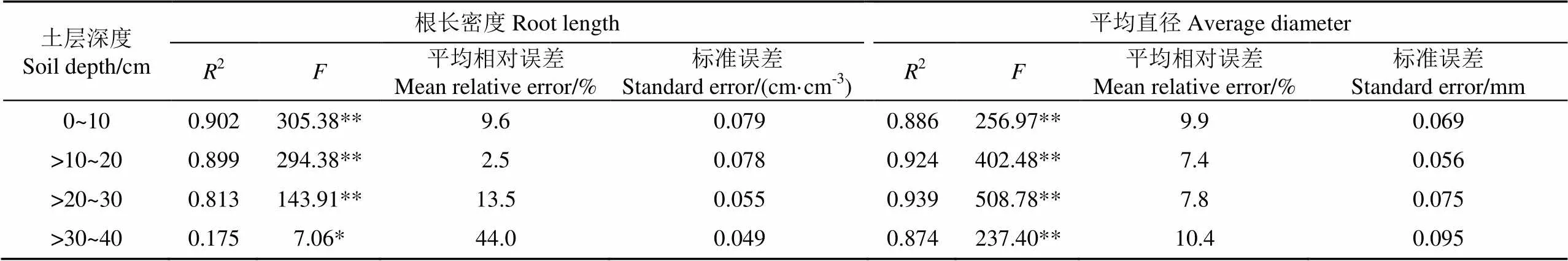
表2 微型根系形态原位监测与土壤采样法测定值回归分析
注:**表示达到极显著水平(<0.01),*表示达到显著水平(<0.05)。
Note: **represents significant at 1% level, and *represents significant at 5% level.
微型根系形态采集系统获得的根系平均直径与土壤采样法测定值在各个深度均达到极显著相关关系,能够反应根系的真实平均直径。在>30~40 cm深度处,根系平均直径表现出较高的相关性,而根长密度的相关性较低,其主要原因是根长密度是通过计算某一土壤层内多个采集器测量的平均值,如果采集器不能拦截到根系,其平均值会减小,从而影响最终测量结果。
4 结论与讨论
设计了一种适用于浅根系作物的微型根系形态实时采集系统,结合图像处理技术能够实时监测根系形态信息。采用基于区域生长的方法对低层处理的根系图像进行处理,滤除土壤孔隙结构和杂质等对图像产生的干扰,提取基本的根系轮廓,并根据根系形态学原理计算根长密度、根系平均直径等参数。用于检测辣椒苗,与土壤采样法测定值相比,在30 cm深度以内的土壤层根长密度相关系数2>0.81(<0.01),根长密度平均相对误差不超过13.5%;根系平均直径在0~10、>10~20、>20~30和>30~40 cm 4个土壤层内决定系数2>0.87(<0.01),平均相对误差不超过10.4%。该微型根系形态采集器可用于定点观测根系的形态变化,尤其适用于浅根系作物。
准确及时获取作物根系原位图像,对于作物生长检测具有非常重要的意义。多点原位检测是获取整株作物根系构型和生长状态的一种有效手段。由于微型根系形态采集器体积小巧,相对于其他观测方法,具有对根系生长环境改变较小的优点,适合于长期多点观测。尤其对于设施生产中的袋培等基质栽培方法,由于作物根系生长较浅,密度较高,采用微根观测可以比较方便获取整个生长周期的图像,可为环境调控、作物肥水管理等提供直接的根系数据。但是对于其他的栽培方式,如果根系长度超过30 cm,并且横向分布不均匀,如何通过合理的位置预埋,并考虑作物根系的避让特性,获得准确的根系图像就变得非常关键,也是今后研究的重点。
[1] Chen X, Li Y, He R, et al. Phenotyping field-state wheat root system architecture for root foraging traits in response to environment×management interactions[J]. Scientific Reports, 2018, 8(1): 1-9.
[2] Rogers E D, Benfey P N. Regulation of plant root system architecture: implications for crop advancement[J]. Current Opinion in Biotechnology, 2015, 32(32C): 93-98.
[3] Mari C L, Kirchgessner N, Marschall D, et al. Rhizoslides: paper-based growth system for non-destructive, high throughput phenotyping of root development by means of image analysis [J]. Plant Methods, 2014, 10(1): 13.
[4] Morris E C, Griffiths M, Golebiowska A, et al. Shaping 3D root system architecture [J]. Current Biology, 2017, 27(17): R919.
[5] Amato M, Lupo F, Bitella G, et al. A high quality low-cost digital microscope minirhizotron system[J]. Computers & Electronics in Agriculture, 2012, 80(1): 50-53.
[6] Taylor B N, Beidler K V, Strand A E, et al. Improved scaling of minirhizotron data using an empirically-derived depth of field and correcting for the underestimation of root diameters[J]. Plant & Soil, 2014, 374(1/2): 941-948.
[7] Chen Y, Xie Y, Song C, et al. A comparison of lateral root patterning among dicot and monocot plants [J]. Plant Science, 2018, 274: 201-211.
[8] Padilla F M, Pena-Fleitas M T, Fernandez M D, et al. Responses of soil properties, crop yield and root growth to improved irrigation and N fertilization, soil tillage and compost addition in a pepper crop[J]. Scientia Horticulturae, 2017, 225: 422-430.
[9] 孔清华,李光永,王永红,等. 不同施肥条件和滴灌方式对青椒生长的影响[J]. 农业工程学报,2010,26(7):21-25.
Kong Qinghua, Li Guangyong, Wang Yonghong, et al. Influences of subsurface drip irrigation and surface drip irrigation on bell pepper growth under different fertilization conditions[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(7): 21-25. (in Chinese with English abstract)
[10] 温维亮,郭新宇,赵春江,等. 作物根系构型三维探测与重建方法研究进展[J]. 中国农业科学,2015,48(3):436-448.
Wen Weiliang, Guo Xinyu, Zhao Chunjiang, et al. Crop roots configuration and visualization: A Review[J]. Scientia Agricultura Sinica, 2015, 48(3): 436-448. (in Chinese with English abstract)
[11] Koenig C, Wey H, Binkley T. Precision of the XCT 3000 and comparison of densitometric measurements in distal radius scans between XCT 3000 and XCT 2000 peripheral quantitative computed tomography scanners[J]. Journal of Clinical Densitometry the Official Journal of the International Society for Clinical Densitometry, 2008, 11(4): 575-580.
[12] Yang Xiaofan, Varga Tamas, Liu Chongxuan, et al. What can we learn from in-soil imaging of a live plant: X-ray Computed tomography and 3D numerical simulation of root-soil system[J]. Rhizosphere, 2017, 3(2): 259-262.
[13] 周学成,罗锡文. 基于XCT技术的原位根系三维可视化研究[J]. 农业机械学报,2009,40(增刊1):202-205. Zhou Xuecheng, Luo Xiwen. 3-D Visualization of root system in situ based on XCT technology[J].Transactions of the Chinese Society for Agricultural Machinery, 2009, 40(Supp.1): 202-205. (in Chinese with English abstract)
[14] Bates G H. A device for the observation of root growth in the soil[J]. Nature, 1937, 139(3527): 966-967.
[15] Sanders J L, Brown D A. A new fiber optic technique for measuring root growth of soybeans under field conditions[J]. Agronomy Journal, 1978, 70(6): 1073-1076.
[16] Sumioitoh. In situ measurement of rooting density by micro-rhizotron[J]. Soil Science & Plant Nutrition, 1985, 31(4): 653-656.
[17] 白文明,程维信,李凌浩. 微根窗技术及其在植物根系研究中的应用[J]. 生态学报,2005,25(11):3076-3081.
Bai Wenming, Cheng Xinxin, Li Linghao. Applications of minirhizotron techniques to root ecology research[J]. Acta Ecologica Sinica, 2005, 25(11): 3076-3081. (in Chinese with English abstract)
[18] 吴长高,罗锡文. 计算机视觉技术在根系形态和构型分析中的应用[J]. 农业机械学报,2000,31(3):63-66.
Wu Changgao, Luo Xiwen. Appl ication of computer vision technology to analysis of root pattern and architecture[J]. Transactions of the Chinese Society for Agricultural Machinery, 2000, 31(3): 63-66. (in Chinese with English abstract)
[19] Upchurch D R, Ritchie J T. Root observations using a video recording system in mini-rhizotrons[J]. Agronomy Journal, 1983, 75(6): 1009-1015.
[20] 廖荣伟,刘晶淼,安顺清,等. 基于微根管技术的玉米根系生长监测[J]. 农业工程学报,2010,26(10):156-161.
Liao Rongwei, Liu Jingmiao, An Shunqing, et al. Monitor of corn root growth in soil based on minirhizotron technique[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(10): 156-161. (in Chinese with English abstract)
[21] 张志山,李新荣,张景光,等. 用Minirhizotrons观测柠条根系生长动态[J]. 植物生态学报,2006,30(3):457-464.
Zhang Zhishan, Li Xinrong, Zhang Jingguang, et al. Root growth dynamics ofusing minirhizotrons[J]. Journal of Plant Ecology (formerly Acta Phytoecologica Sinica), 2006, 30(3): 457-464. (in Chinese with English abstract)
[22] Joslin J D, Wolfe M H. Disturbances during minirhizotron installation can affect root observation data[J]. Soil Science
Society of America Journal, 1999, 63(1): 218-221.
[23] Phillips D L, Johnson M G, Tingey D T, et al. Minirhizotron installation in sandy, rocky soils with minimal soil disturbance[J]. Soil Science Society of America Journal, 2000, 64(2): 761-764.
[24] Majdi H. Root sampling methods-applications and limitations of the minirhizotron technique [J]. Plant & Soil, 1996, 185(2): 255-258.
[25] Withington J M, Elkin A D, Bulaj B, et al. The impact of material used for minirhizotron tubes for root research[J]. New Phytologist, 2003, 160(3): 533-544.
[26] Merrill S D, Upchurch D R. Converting root numbers observed at minirhizotrons to equivalent root length density[J]. Soil Science Society of America Journal, 1994, 58(4): 289-302.
[27] Taylor H M, Ruck M G, Klepper B, et al. Measurement of soil-grown roots in a rhizotron[J]. Agronomy Journal, 1970, 62(6): 807-809.
[28] 孙海英. 图像高斯噪声及椒盐噪声去噪算法研究[D]. 上海:复旦大学,2012.
Sun Haiying. Research on denoising algorithm of image gao si noise and salt and pepper noise[D]. Shanghai: Fudan University, 2012. (in Chinese with English abstract)
[29] Shih F Y, Cheng S. Automatic seeded region growing for color image segmentation[J]. Image & Vision Computing, 2005, 23(10): 877-886.
[30] 王博,苏玉民,万磊,等. 基于梯度显著性的水面无人艇的海天线检测方法[J]. 光学学报,2016(5):58-67.
Wang Bo, Su Yumin, Wan Lei, et al. Sea sky line detection method of unmanned surface vehicle based on gradient saliency[J]. Acta Optica Sinica, 2016(5): 58-67. (in Chinese with English abstract)
[31] 周学成,罗锡文. 采用区域生长法分割根系CT图像的改进算法[J]. 农业机械学报,2006,37(12):122-125.
Zhou Xuecheng, Luo Xiwen. An improved region growing algorithm for the CT images segmentation of plant root[J]. Transactions of the Chinese Society for Agricultural Machinery, 2006, 37(12): 122-125. (in Chinese with English abstract)
[32] 刁智华,吴贝贝,魏玉泉,等. 利用最大圆盘提取作物行骨架的改进算法[J]. 中国农机化学报,2016,37(7):141-144.
Diao Zhihua, Wu Beibei, Wei Yuquan, et al. Improved algorithm of crop rows skeleton extraction based on maximum disc[J]. Journal of Chinese Agricultural Mechanization, 2016, 37(7): 141-144. (in Chinese with English abstract)
[33] 周南,崔屹. 数学形态学骨架化及重建[J]. 中国图象图形学报,1997,2(10):712-716.
Zhou Nan, Cui Yi. Skeletonization and reconstruction via mathematical morphology[J]. Journal of Image and Graphics, 1997, 2(10): 712-716. (in Chinese with English abstract)
Design and validation of in situ micro root observation system for tomato and pepper
Lu Wei1, Wang Xiaochan1,2※, Wang fengjie1
(1.,210031,; 2.,210031,)
Being the principle organ to absorb water and nutrition, root system plays a very important role in the growth of plants. Since roots usually grow in soil that is invisible to us, it is very difficult to detect root morphology in real time or to study on it over a long period of time, especially for shallow root plants. In order to acquire root morphological characteristics in real time, a kind of in situ micro root observation system was proposed and designed. The system was composed mainly of micro camera, optical amplifiers and adjustable lighting device, and its whole volume was only 1.5cm3. The captured images were sent to the terminal (mobile-phone or personal computer) via the wireless module for later image processing. Images of root were always with low quality affected by complicated soil environment (soil pores, obstacles, and moisture), which could not be eliminated by simple image processing method such as median filter and mean filter algorithm. In order to filter out these interferes to the image, method of regional growth was used to extract roots image. First, the image was corroded and expanded by 3×3 structural element to acquire the start point and the end point of the algorithm, where the corrosion image was determined as the start point, and the expansion image as the end point. Then the process of regional growth was carried out by similarity criteria(grayscale difference less than 20), and regions including soil pore structure, moisture and other obstacles were formed. These regions were marked and numbered, and distinguished by the threshold (the threshold 50 pixel was determined by trial and error). At last, root regions were kept, and soil pore structure, moisture and other obstacles were deleted by filtering. The kept root regions were further processed by skeleton extraction based on maximum circle to calculate root length, diameter and other parameters. Non-in-situ test was carried out to test the accuracy of the designed system. The result showed that the system was able to capture images with high accuracy (maximum absolute errors of root length and average diameter were less than 1.5 mm and 0.09 mm respectively , and maximum relative errors of root length and average diameter were less than5.3% and 6.7% respectively). In situ experiment was then carried out by arranging micro root observation systems in different positions and depths into soil around root system. Calibration of micro root observation system was made by comparing with soil samples. The results of in-situ monitoring showed that the micro root observation system can dynamically observe the growth of shallow root in multi points. The determination coefficient of average diameter was more than 0.87 in all soil depths (0-10, >10-20, >20-30 and >30-40 cm; relative error less than 10.4%); and the determination coefficient of root length density within 30 cm was over 0.81 (relative error less than 13.5%). This micro root observation system could dynamically acquire root morphology in multiple spots fast and accurate, which would provide reliable data for plant nutrition, plant physiology and ecology.
morphology; algorithm; measurements; root morphology; micro root observation system; multi-point acquisition; real-time acquisition; regional growth algorithm
鲁 伟,汪小旵,王凤杰. 番茄辣椒微型根系形态原位采集系统设计与实现[J]. 农业工程学报,2018,34(22):12-18. doi:10.11975/j.issn.1002-6819.2018.22.002 http://www.tcsae.org
Lu Wei, Wang Xiaochan, Wang Fengjie. Design and validation of in situ micro root observation system for tomato and pepper[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 12-18. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.22.002 http://www.tcsae.org
2018-06-16
2018-10-20
国家重点研发计划项目(2016YFD0200602-4);江苏省农业科技自主创新资金项目(CX(16)1002)
鲁 伟,博士生,主要从事农业智能检测与控制技术研究。 Email:lwreed@126.com
汪小旵,教授,博士生导师,主要从事农业生物环境模拟与控制研究。Email:wangxiaochan@njau.edu.cn
10.11975/j.issn.1002-6819.2018.22.002
S237
A
1002-6819(2018)-22-0012-07
