UHPLC-ESI-MS/MS法测定动物源食物提取物中肌肽与鹅肌肽的含量
2018-11-22王雨晴贾福怀李月琪张海欣谷瑞增
王雨晴,陈 亮,贾福怀,郑 锌,李月琪,马 勇,张海欣,王 憬,谷瑞增
(1.中国食品发酵工业研究院有限公司 北京市蛋白功能肽工程技术研究中心,北京 100015;2.宁波御坊堂生物科技有限公司,浙江 宁波 315012;3.岛津企业管理(中国)有限公司,北京 100020)
肌肽(β-丙氨酰-L-组氨酸,Car)和鹅肌肽(β-丙氨酰-1-甲基-L-组氨酸,Ans)是动物体内的组氨酸二肽。肌肽类生物活性肽具有抗氧化能力,可以抑制体内脂质氧化以及蛋白质的氧化和糖基化,并具有抗衰老、抗白内障等功能[1-6],主要存在于脊椎动物的肌肉和大脑中,通常从家禽骨骼肌中提取[7]。天然提取肌肽和鹅肌肽可以满足人们的保健需求,在特医食品和保健食品领域已有应用。因此,建立快速、可靠的肌肽和鹅肌肽的检测方法十分必要。
目前肌肽和鹅肌肽的检测尚无相关国家标准,据文献报道,组氨酸二肽类物质的测定方法主要有高效液相色谱法、离子交换色谱法和毛细管电泳法。高效液相色谱法有效实现了肌肽和鹅肌肽的测定[8-9],但该方法选用210 nm波长进行测定,基线较高、易受到干扰,方法准确度尚需考察。田颖刚等[10]用NH2柱分离测定肌肽含量并进行质谱(MS)验证,但利用液相色谱定量,目标物质准确性有待进一步确定。Gil-Agustí等[11]利用毛细管液相色谱测定肉类样品中的肌肽和鹅肌肽,该方法需高纯试剂,成本高,且对样品纯度的要求很高,不利于肌肽和鹅肌肽含量的测定。利用离子交换色谱和毛细管电泳荧光检测法分析肌肽和鹅肌肽含量的前处理较为复杂,对样品分离纯化要求较高,分离效果欠佳[12-13]。随着分析技术的快速发展,利用液相色谱-串联质谱法对短肽进行定性定量成为主流趋势[14-15]。
本文利用超高效液相色谱-串联三重四极杆质谱法,以分子离子和碎片离子质荷比定性,建立了一种简单、快速、可同时测定肌肽和鹅肌肽含量的方法,以满足特医食品、保健食品等领域动物源提取物中肌肽和鹅肌肽含量的分析要求。
1 实验部分
1.1 仪器与试剂
超高效液相色谱仪Nexera X2与三重四极杆质谱仪联用系统(日本岛津公司),包括:LC-30AD×2输液泵,SIL-30AC自动进样器,CTO-20AC柱温箱,CBM-20A系统控制器,LCMS-8060三重四极杆质谱仪,LabSolutions Ver.5.91色谱工作站。XS205DU分析天平(美国Mettler Toledo公司);QL-901涡旋混合仪(其林贝尔仪器制造有限公司)。
标准品:肌肽购于Sigma公司,鹅肌肽购于苏州强耀生物科技有限公司,纯度均≥99%;乙腈(色谱纯,德国Merck公司);甲醇(色谱纯,美国J.T.Backer公司);甲酸(色谱纯,迪马科技有限公司);乙酸(>99.99%,Sigma公司);乙酸铵(质谱纯,Sigma公司);实验所用超纯水(18.2 MΩ·cm)由Milli-Q纯水系统制备。
1.2 多肽标准品的配制
分别准确称取肌肽及鹅肌肽标准品粉末20.0 mg,加水溶解,涡旋混匀,定容至100 mL,即得200 mg/L的标准储备液。分别取500 μL上述标准储备液,定容至10 mL,即得10 mg/L的混合标准中间工作液。将上述混合标准中间工作液用水逐级稀释成1.95、3.91、7.81、15.63、31.25、62.5、125、250、500 μg/L的系列标准工作溶液。
1.3 肌肽、鹅肌肽提取物的制备
以富含肌肽和鹅肌肽的海洋鱼和家禽为原料,先进行破碎和调浆,调节温度和pH值至最佳反应条件进行搅拌提取,离心后取上清液,浓缩后冷冻干燥,制成固体粉末状低聚肽提取物样品,分别为海洋鱼低聚肽样品A、B和家禽低聚肽样品A、B、C、D。
1.4 样品前处理
将“1.3”所述以海洋鱼和家禽为原料制备的6个低聚肽样品,用水分别配成20.0 g/L的溶液,以水稀释104倍待测。
1.5 分析条件
液相色谱条件:Inertsil Amide HP(2.1 mm×100 mm,3 μm)色谱柱;流动相:A为0.1% 乙酸水溶液,B为乙腈溶液;梯度洗脱程序:0~3.0 min,70%~55%B;3.0~4.0 min,55%B;4.0~4.2 min,55%~70%B;流速:0.4 mL/min;进样体积:1 μL;柱温:40 ℃。
质谱条件:离子化模式:ESI+;离子喷雾电压:4.5 kV;雾化气(氮气)流速:3.0 L/min;加热气(空气)流速:10 L/min;干燥气(氮气)流速:10 L/min;脱溶剂管温度:250 ℃;加热模块温度:400 ℃;离子源温度:300 ℃;扫描模式:多反应监测(MRM);驻留时间:100 ms;延迟时间:3 ms;MRM参数见表1。
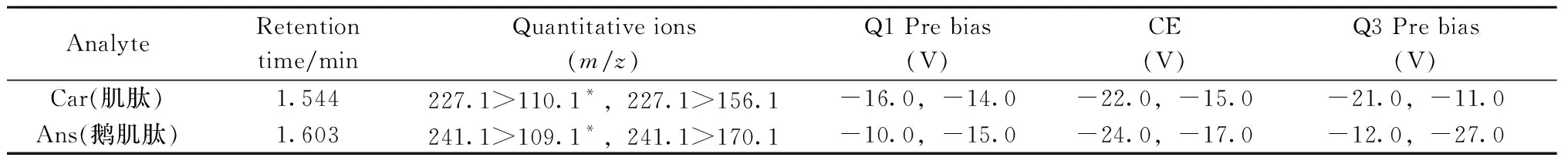
表1 目标化合物的MRM优化参数Table 1 The multiple reaction monitoring conditions of the analytes
*quantitative ions
2 结果与讨论
2.1 质谱条件的优化
肌肽和鹅肌肽均含有氨基,在酸性条件下易加氢形成[M+H]+,因此实验选择ESI+模式分别对1 mg/L肌肽及鹅肌肽混合标准溶液进行一级全扫描,得到丰度较高且稳定的前体离子,再利用仪器自动优化功能,筛选出二级产物离子信息,获得产物离子和碰撞能量(CE)。结果表明,肌肽的酰胺键断裂可得到m/z156.1的产物离子,组氨酸残基脱羧得到m/z110.1的产物离子;鹅肌肽酰胺键断裂得到m/z170.1的产物离子,经脱羧和脱氨基得到m/z109.1的产物离子。一级质谱及二级质谱图见图1,肌肽和鹅肌肽的裂解途径见图2。肌肽选择m/z227.1>110.1和227.1>156.1为检测离子对,鹅肌肽选择m/z241.1>109.1和241.1>170.1为检测离子对,其他MRM检测参数见表1。
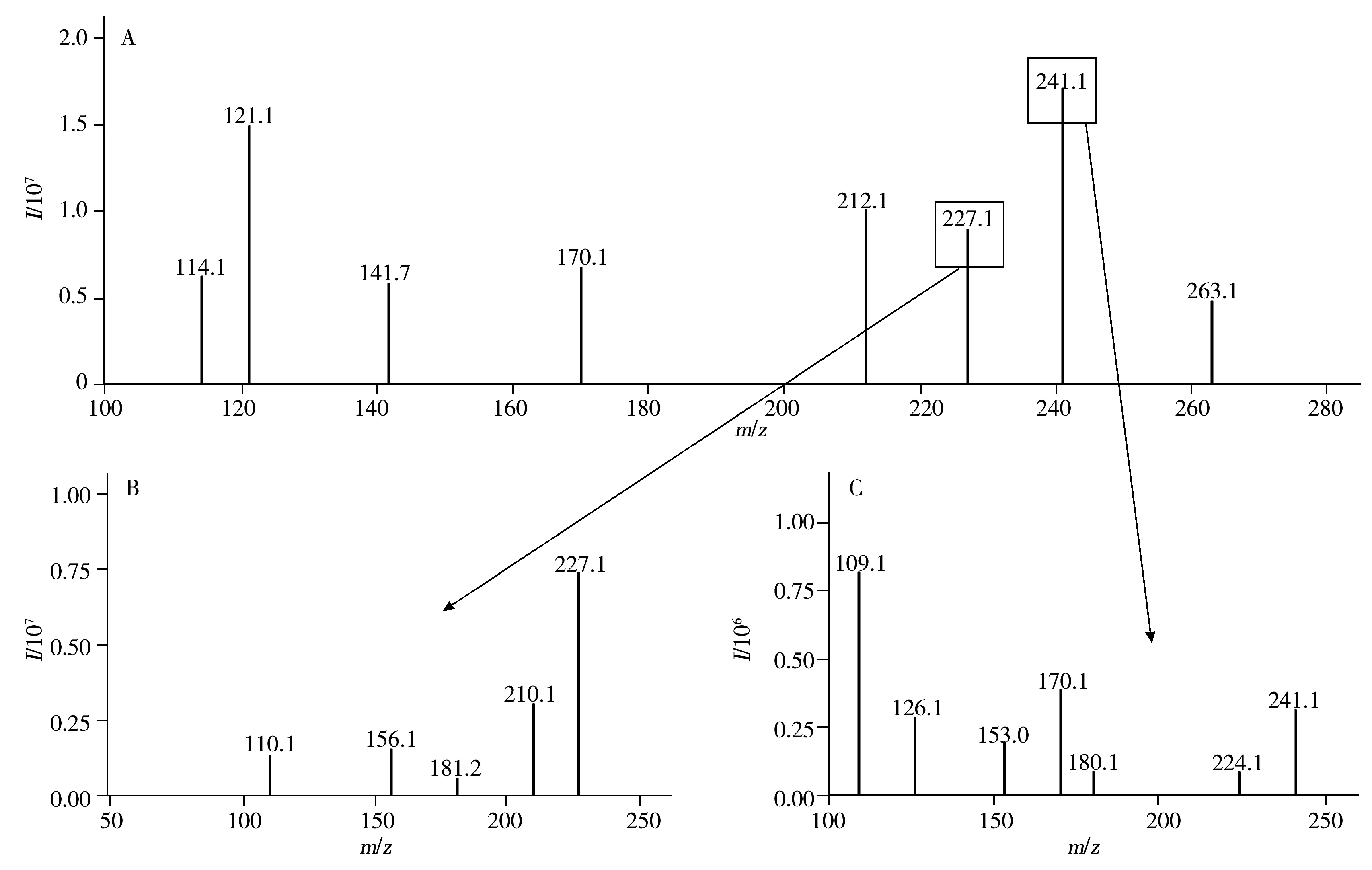
图1 肌肽和鹅肌肽混标的一级(A)、二级(B,C)质谱图Fig.1 Precursor ions(A) and product ions(B,C) spectra of carnosine and anserineA.carnosine and anserine,B.carnosine,C.anserine
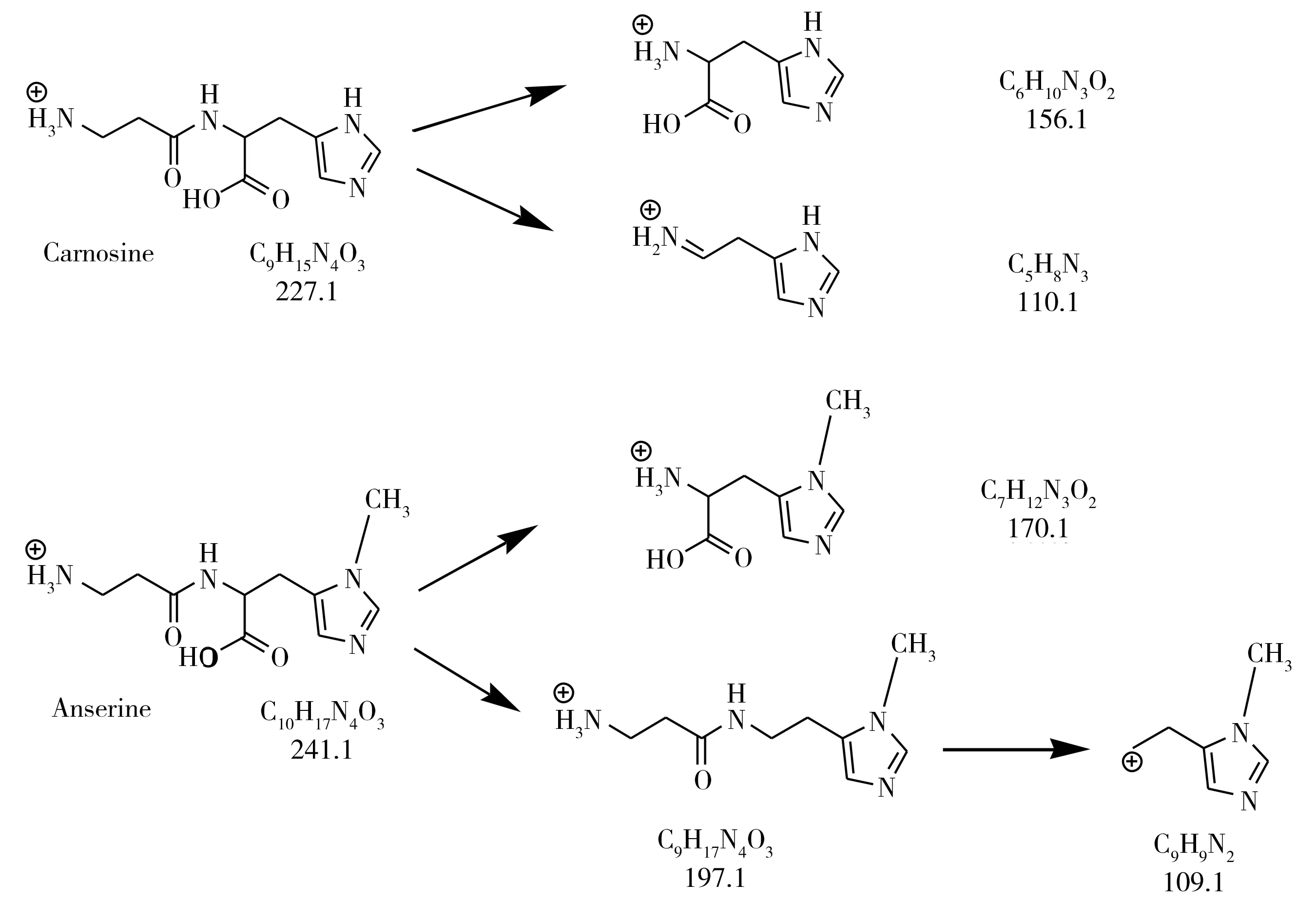
图2 肌肽和鹅肌肽的质谱裂解途径Fig.2 MS fragmentation pathways of carnosine and anserine
2.2 色谱条件的优化
2.2.1色谱柱的选择肌肽和鹅肌肽均属于极性亲水化合物,在常规C18色谱柱上很难保留,且二者的分子结构只相差1个甲基,极性差异较小,分离难度大。本实验比较了亲水性色谱柱CORTECS HILIC(2.1 mm×100 mm,2.7 μm)、Inertsil Amide HP(2.1 mm×100 mm,3 μm)以及适合极性化合物保留的反相色谱柱ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)对肌肽和鹅肌肽的分离效果。结果表明,T3反相色谱柱对肌肽和鹅肌肽难以实现保留;另两种亲水性色谱柱对肌肽和鹅肌肽均有保留,且Inertsil Amide HP柱保留时间的稳定性更优,因此实验选择Inertsil Amide HP(2.1 mm×100 mm,3 μm)色谱柱进行分离。
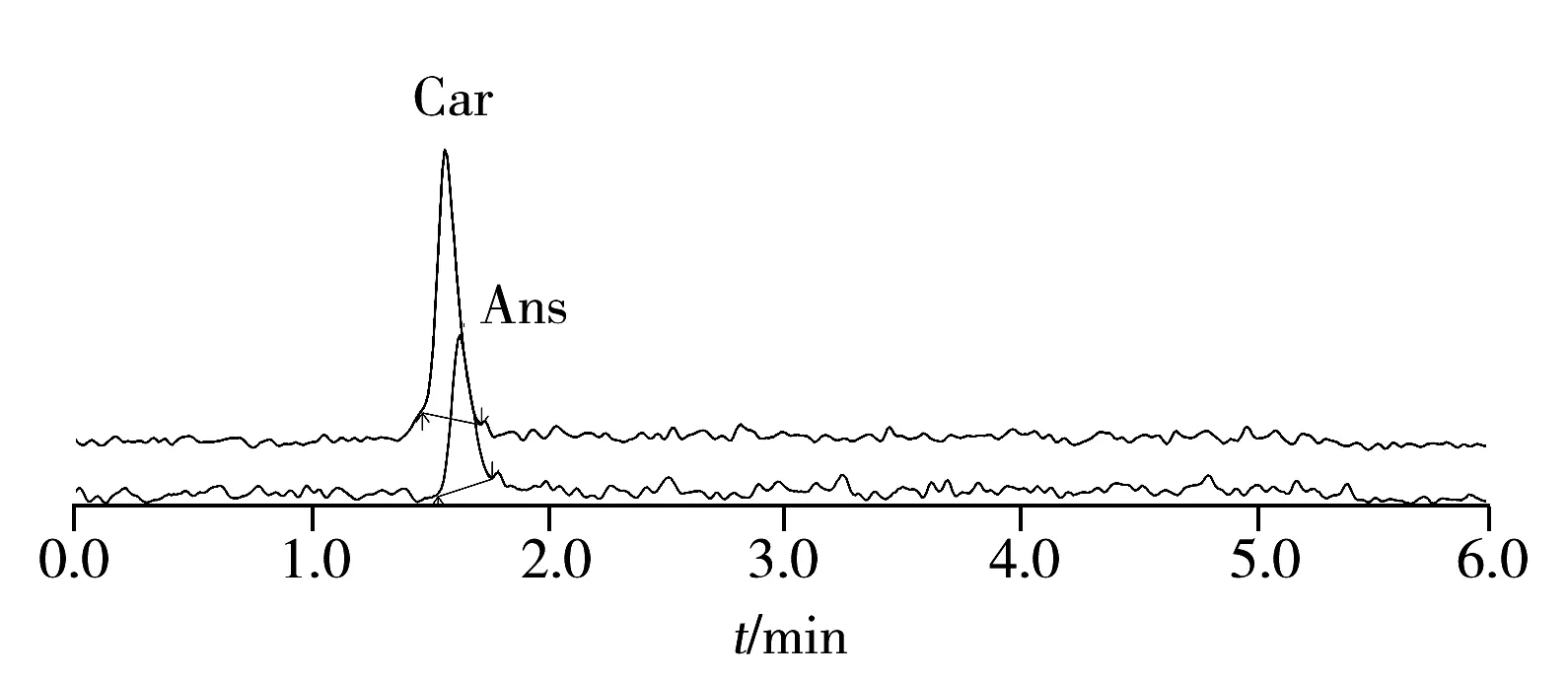
图3 肌肽及鹅肌肽标准溶液(1.95 μg/L)的定量离子流色谱图Fig.3 Quantitative ion chromatograms of standard solution(1.95 μg/L)
2.2.2流动相的优化比较了甲醇-水、乙腈-水及流动相中添加不同调节剂的分离效果。结果显示,以甲醇为有机相时目标化合物难以实现保留,而以乙腈为有机相时,目标化合物的色谱峰形好、保留时间稳定,因此实验选用乙腈作为有机相。在正离子化模式下,流动相中加入酸性介质有利于化合物的离子化,可增强目标物的色谱峰响应;加入缓冲盐也有助于增加化合物的电离效果。因此,考察了流动相中分别加入1 mmol/L乙酸铵、0.1%甲酸和0.1%乙酸的分离效果。结果表明,流动相中加入乙酸铵后色谱峰响应减弱;而加入0.1%乙酸较加入0.1%甲酸的色谱峰响应更高,峰形更对称,且分离度和灵敏度均能满足测定要求。综上,实验选择乙腈和0.1%乙酸作为流动相,此时目标物的检测灵敏度高,分离度好,且能有效改善色谱峰的拖尾现象。
在优化的UHPLC-MS/MS条件下,混合标准溶液中肌肽和鹅肌肽的分离效果良好(图3)。
2.3 系统残留测试
在高浓度低聚肽样品(500 μg/L)进样后,进样空白溶剂,考察肌肽及鹅肌肽的系统残留情况。结果表明,高浓度低聚肽样品分析后,系统无残留现象。
2.4 线性范围及灵敏度实验
将“1.2”所述系列浓度标准工作溶液(1.95、3.91、7.81、15.63、31.25、62.5、125、250、500 μg/L)在优化条件下进行测定,外标法定量。以质量浓度(X,μg/L)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。结果显示,肌肽和鹅肌肽的质量浓度在1.95~500 μg/L范围内与其峰面积呈良好的线性关系,相关系数(r)均高于0.998。以3倍信噪比(S/N=3)计算检出限(LOD),以S/N=10计算定量下限(LOQ),得肌肽和鹅肌肽的LOD分别为0.12、0.47 μg/L,LOQ分别为0.37、1.42 μg/L(表2)。

表2 肌肽和鹅肌肽的线性方程、线性范围、相关系数(r)、检出限及定量下限Table 2 Regression equations,linear ranges,correlation coefficients(r),LODs and LOQs of carnosine and anserine
2.5 回收率与精密度
根据预实验的结果,选择肌肽及鹅肌肽含量相对较低的低聚肽样品作为基质。取10 μL不同质量浓度的混合标准溶液,加入一定量的低浓度基质,配制成2、20、200 μg/L加标浓度,每个浓度平行6份。根据标准曲线测定结果,计算加标回收率(表3)。得肌肽的回收率为99.3%~109%,相对标准偏差(RSD,n=6)为0.98%~1.1%;鹅肌肽的回收率为100%~113%,RSD为1.0%~1.1%。

表3 加标回收率及相对标准偏差(n=6)Table 3 Recoveries and RSDs of spiked samples(n=6)
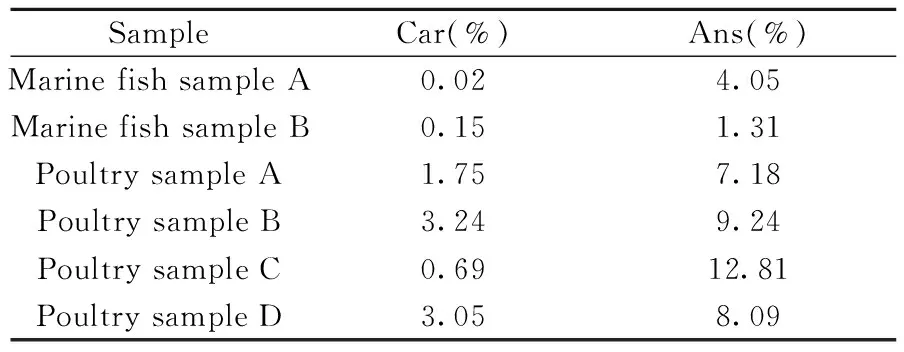
表4 实际样品的测定结果Table 4 Analytical results of real samples
2.6 实际样品的测定
取“1.3”自制的6个低聚肽样品,在优化条件下进行测定,典型样品家禽低聚肽样品B的色谱图见图4,各低聚肽样品中肌肽和鹅肌肽的含量测定结果见表4。结果表明,相同低聚肽样品中鹅肌肽的含量均高于肌肽,以家禽为原料提取的低聚肽样品中肌肽和鹅肌肽的含量均高于以海洋鱼为原料提取的低聚肽样品。
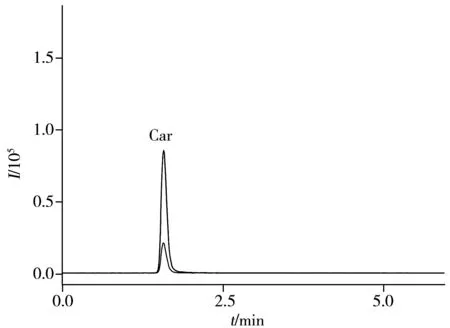
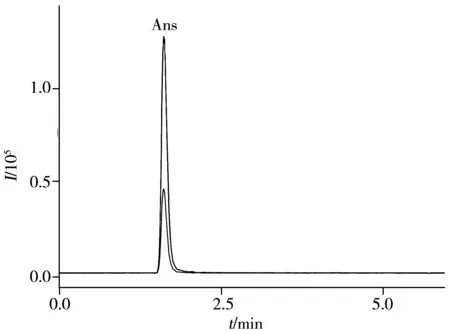
图4 家禽低聚肽样品B的色谱图Fig.4 Chromatograms of poultry sample B
3 结 论
本研究利用UHPLC-ESI-MS/MS技术,建立了动物源提取物中肌肽及鹅肌肽的测定方法。结果表明,肌肽和鹅肌肽在1.95~500 μg/L质量浓度范围内线性关系良好,检出限分别为0.12、0.47 μg/L。该方法回收率高、精密度良好、准确度高,能满足肌肽及鹅肌肽的定量测定要求。本方法对于特医食品、保健食品和药食同源类产品的研发和生产具有重要意义。
