米酒酒曲中优势霉菌和酵母菌发酵特性的研究
2018-11-22卢福芝钱丰周燕霞李启虔覃拥灵
卢福芝,钱丰,周燕霞,李启虔,覃拥灵
(1.河池学院化学与生物工程学院广西高校微生物及植物资源开发利用实验室,广西宜州546300;2.广西泰美新材料有限公司,广西宜州546311)
米酒是以优质大米为原料,经微生物发酵酿制而成,甘饴可口,风味独特,深受人们喜爱[1]。米酒发酵过程是混菌发酵,多菌种间的相互关系及其代谢协调关系对米酒的质量起着决定性的作用[2]。酒曲中的优势菌种一般为霉菌、酵母菌、细菌3种,其中霉菌和酵母菌在米酒发酵中起着重要作用,霉菌主要进行糖化作用,酵母菌则主要产酒精和芳香类物质[3-5]。尤小龙、吕南拳等通过研究发现酒曲中功能菌生态对白酒基酒的风味风格起着重要的作用[6-7]。
试验以米酒酒曲中分离出的3株优势功能菌根霉菌F1、毛霉菌F2和酵母菌F3为出发菌株,分别通过单菌和混菌发酵,检测其发酵过程发酵液中pH值、还原糖及乙醇含量的变化,并测定发酵液中酒体成分,研究菌株间的发酵规律及相关性,为米酒酒曲的制作及发酵工艺的优化提供一些参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
从米酒酒曲中分离出的一株根霉菌F1、一株毛霉菌F2和一株酿酒酵母F3,其中根霉菌F1糖化酶活性较高,3株菌株均具有单独产酒精能力[8]。
1.1.2 主要试剂
葡萄糖、淀粉:天津市光复精细化工研究所;硫酸镁、硝酸钾:西陇化工股份有限公司;蛋白胨:杭州百思生物技术有限公司,以上试剂均分析纯;乙醇标准品(色谱纯):国家标准物质网。
1.1.3 发酵培养基
将市售优质大米用水清洗、沥干水分,称取25 g大米置于250 mL的三角瓶中,加入15 mL水,加塞包扎,置于高压灭菌锅中121℃蒸煮灭菌20 min,使米粒熟而不烂,保证颗粒完整。
1.2 仪器与设备
HVE-50灭菌锅:华粤行仪器有限公司;xMark酶标仪:上海研域设备有限公司;7890A气相色谱仪:中国惠普有限公司;TDL-5-A离心机:上海安亭科学仪器厂。
1.3 试验方法
1.3.1 菌种活化
将保藏的根霉菌F1和毛霉菌F2接种于PDA斜面培养基上,28℃恒温培养箱中培养5 d,待长出孢子后取出,在无菌环境下将斜面中的孢子用无菌水洗脱,制成6×107cfu/mL的菌悬液;将保藏的酿酒酵母F3接入马铃薯葡萄糖液体培养基中,28℃,180 r/min的摇床中培养24 h后用无菌水制成菌种数为6×107cfu/mL的菌悬液。
1.3.2 发酵试验
在无菌的环境下,向发酵培养基中加入80 mL的无菌水,用玻璃棒将米粒打散,然后分别接种,于28℃进行单菌和混菌发酵,定时取样测定发酵液的还原糖和乙醇含量。单菌发酵时,菌种F1、F2和F3的接种量均为1.5 mL;3株菌种进行两两混菌发酵时,接种量分别为0.75 mL;3株菌种混合发酵时接种量各为0.5 mL。
1.3.3 发酵过程发酵液中pH值的测定
取发酵液于离心管中,10 000 r/min离心10 min。取出上清液,测定发酵液的pH值,并把相关数据记录下来。
1.3.4 发酵过程发酵液中还原糖含量的测定
取发酵液于离心管中,10 000 r/min,离心10 min。取出上清液,通过DNS法测定发酵液中还原糖的含量[9-10]。
1.3.5 发酵过程发酵液中乙醇含量的测定
将发酵液转入蒸馏器进行蒸馏,收集蒸馏组分。蒸馏组分别用微孔滤膜过滤后,装入样品瓶中,通过气相色谱利用外标法测定发酵液中乙醇含量。色谱条件如下:柱温40℃,保留1 min,以4℃/min升至55℃,再以40℃/min升至210℃,保留7 min;进样口温度220 ℃;检测器温度 300 ℃;载气(N2):25 mL/min;H2(30 mL/min);空气 400 mL/min。进样量为 1 μL,分流比为 1 ∶30。
1.3.6 发酵液中酒体成分的测定
将发酵液经蒸馏所得馏分过滤后通过气相色谱测定酒体成分,通过与标准品比较分析,结合相关参考文献推定出酒体成分。色谱条件与1.3.5中的条件一致。
2 结果与分析
2.1 发酵过程发酵液中pH值的变化情况
根据1.3.3的方法定时取样测定单菌和混菌发酵过程发酵液中的pH值。检测结果显示3株优势功能菌发酵过程发酵液中pH值虽有波动,但变化较小。单菌发酵时,3株优势功能菌发酵过程中pH值偏酸性,变化范围在5~6之间。在混菌发酵过程中的pH值呈弱酸性至中性,波动范围在5~7之间。发酵过程中pH值的变化主要是由于发酵菌种代谢产生的结果。菌种在发酵过程中将糖类物质代谢产酸,pH值会有所下降;在产酸的同时菌种也会将酸不断转化为酯、醛、酮等物质,因此整个发酵过程中pH值保持在了相对较小的变化范围[11]。
2.2 发酵过程发酵液中还原糖和酒精含量的变化规律
根据1.3.4和1.3.5的方法定时取样测定单菌和混菌发酵过程发酵液中还原糖和乙醇的含量。测定结果如图1所示。
米酒酿造过程中,菌种通过水解淀粉产生葡萄糖等还原性糖,所产的糖类一部分用于菌种的生长繁殖,其他的可通过菌种的各种代谢途径产生不同的代谢产物,其中重要的产物就是乙醇[12]。发酵过程发酵液中还原糖和乙醇含量的变化,一定程度上可以反映糖化和发酵速度。
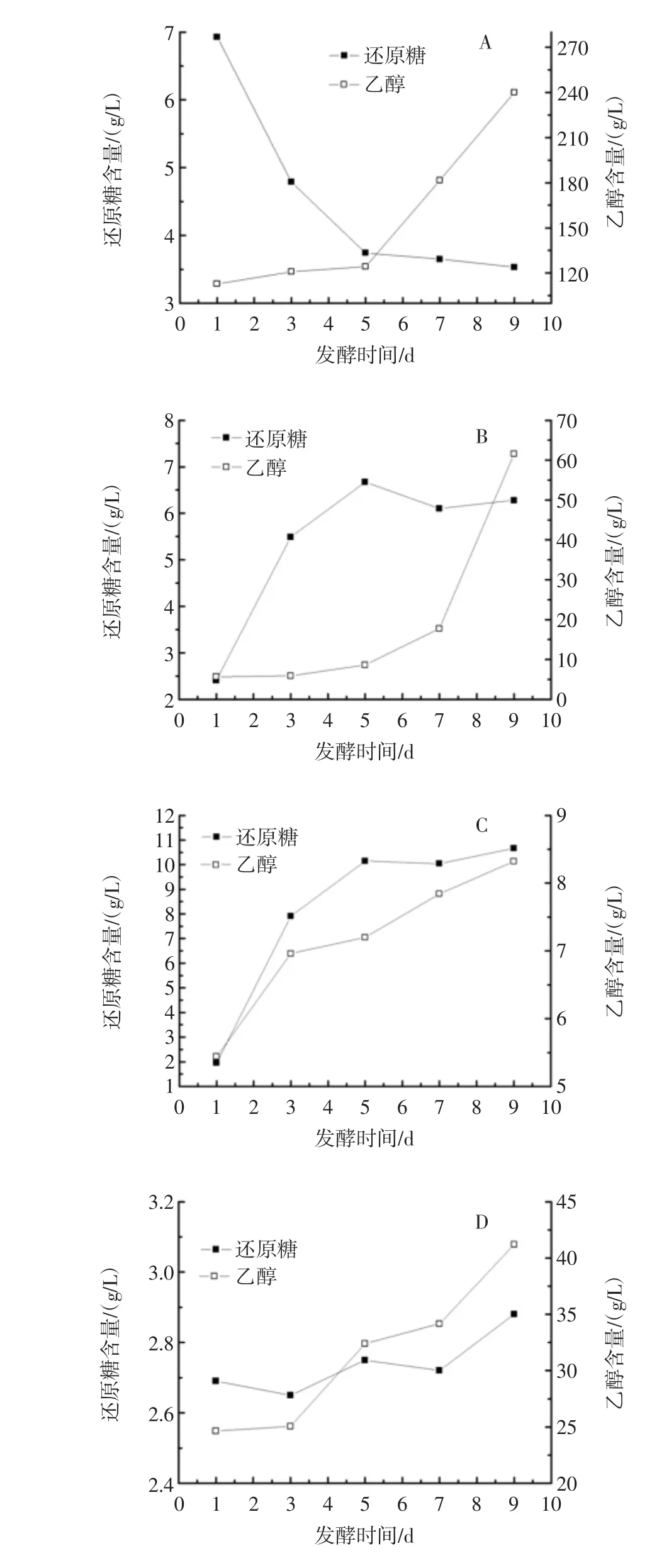

图1 菌株发酵过程发酵液中还原糖和乙醇含量的变化Fig.1 The changes of reducing sugar and ethanol content in fermentation
由图1A、1B、1C可知,在单菌发酵过程中根霉菌F1在前5天还原糖含量急剧降低,而后保持稳定,在发酵一开始就产生大量的乙醇,乙醇含量在前5天保持稳步增加,此后开始迅速增加,第9天时达240 g/L,说明发酵前期F1主要处于菌体繁殖阶段,后期开始快速发酵产乙醇,随着发酵推进,对还原糖利用速度超过了降解速度,导致还原糖含量不断减少,到发酵后期发酵速度减缓,糖化和发酵速度达到平衡,因此还原糖含量保持稳定,乙醇则不断积累;毛霉菌F2在发酵前5天还原糖含量逐渐增加,在5 d~7 d时有所降低,乙醇含量前期缓慢增加,第7天开始急速增加,说明F2在发酵前期处于生长繁殖阶段,对还原糖利用较少,发酵后期开始消耗还原糖进行代谢活动,所以还原糖含量有所下降,开始大量生产乙醇,这说明毛霉菌F2具有不错的糖化能力,但其同时具备产乙醇的代谢途径,也能利用部分还原糖发酵产乙醇。酵母菌F3在发酵前5天还原糖含量逐渐增加,第5天后基本保持不变,说明其具有一定的水解淀粉能力但酵母菌水解淀粉的能力是有限的,在整个发酵过程中乙醇含量总体很低,造成乙醇产量较少的原因可能是由于水解所得的糖类需优先满足酵母菌的生长繁殖需要,然后是才产乙醇。
由图1D、1E、1F和1G可知,根霉菌F1和毛霉菌F2混菌发酵过程中还原糖含量变化不大,说明菌种的糖化速度和发酵速度基本一致,乙醇则不断积累,达到较高水平;根霉菌F1和酵母菌F3混菌发酵过程中前5天还原糖含量迅速增加,在5 d~7 d时下降较快,而后保持稳定,说明F1和F3混菌发酵前期水解淀粉的速度较快,随着菌体快速繁殖,代谢作用加快,还原糖大量消耗,发酵后期代谢减缓,还原糖含量保持稳定,乙醇在发酵过程中不断积累,总体含量不高;毛霉菌F2和酵母菌F3混菌发酵过程还原糖含量基本保持稳定,说明菌种的糖化速度和发酵速度较为平衡,乙醇则快速积累,经过9天发酵后,产量达207 g/L;3菌混菌发酵过程中还原糖含量变化不大,乙醇不断积累,但总体含量低。
混菌发酵时,菌株的生长繁殖和代谢活动会受彼此的影响。通过对比图1中单菌发酵和混菌发酵时还原糖和乙醇含量发现,单菌发酵时根霉菌F1产乙醇最高,而毛霉菌F2和酵母菌F3产乙醇均较低,但混菌发酵时,F2和F3的混菌发酵组合产乙醇量却是最高,说明F2和F3混菌发酵时对彼此的生长及代谢有促进作用,使产乙醇含量增加。F1、F2和F3三者混菌发酵时产乙醇是4组混菌发酵中最低的,说明3株菌共同生长时,产乙醇代谢途径受到了制约。
2.3 发酵液中酒体成分测定结果
将3株优势功能菌根霉菌F1、毛霉菌F2和酵母菌F3分别经单独和混菌发酵后通过气相色谱仪测定其酒气成分,结果如表1所示。
由表1可知,3株优势功能菌单菌发酵时酒体成分较为类似,其共有成分为甲醇、乙醇、乙醛、异丁醇、丁酸异戊酯。酵母菌F3酒体成分中酯类较多,含丁酸异戊酯、丁酸己酯和乳酸乙酯3种酯类;毛霉菌F2菌酒体成分多了己酸己酯。混菌发酵时共有的酒体成分有甲醇、乙醇、异丁醇和丁酸异戊酯。混菌发酵时,根霉菌F1和毛霉菌F2两菌混菌发酵和3菌混菌共发酵所得酒体成分较多,其中F1和F2混菌发酵多了乙酸、丁酸己酯、乳酸乙酯和丙三醇,三菌混菌发酵多了乙酸、正丁酸和己酸己酯,这两种混菌发酵方式较单菌发酵和其他两种混菌发酵其酒体成分中多了酸类物质。白酒香味成分有醇类、酯类、酸类和醛类等,每种成分都对白酒的风味有不同的贡献[13-14]。白酒中酒体成分种类及含量构成了不同白酒独特的风味,只有成分种类丰满、比例协调才能形成香气与口味协调,风味独特的优质白酒[15]。
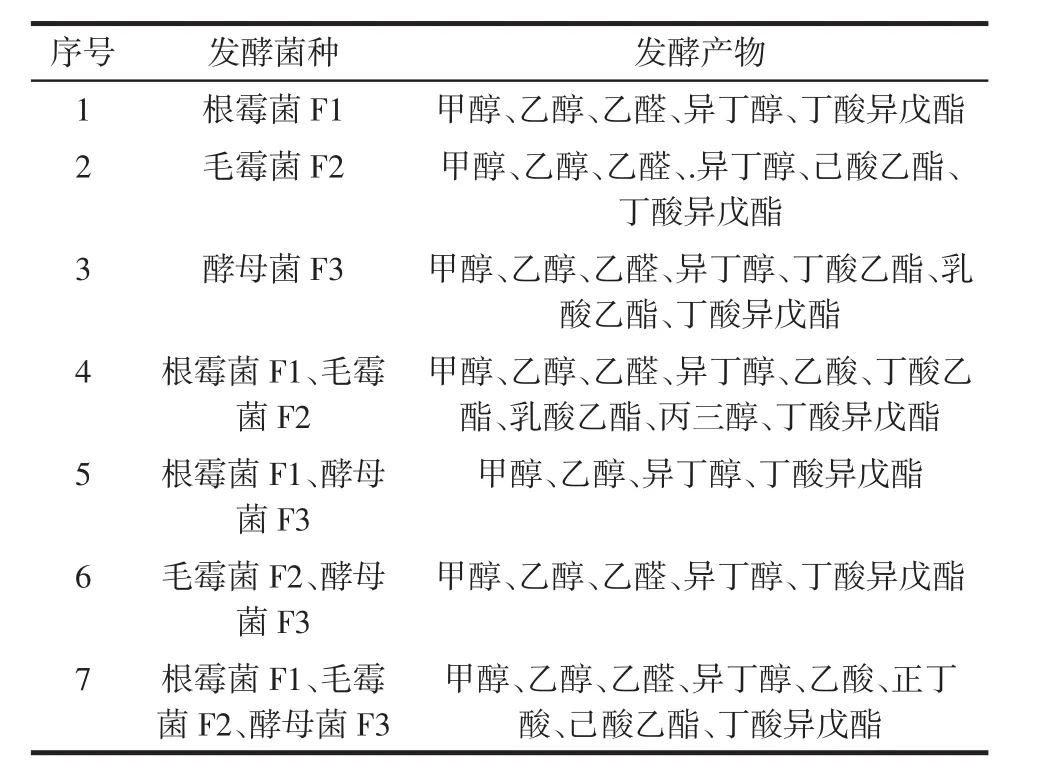
表1 优势菌种发酵产物测定结果Table 1 The results of products in dominant strains fementation
3 结论
研究以米酒酒曲中3株优势功能菌根霉菌F1、毛霉菌F2和酵母菌F3为出发菌株,分别通过单菌和混菌发酵,检测其发酵过程发酵液中pH值、还原糖、乙醇含量的变化及发酵液中酒体成分,进一步揭示米酒酒曲中优势霉菌和酵母菌的发酵规律。检测结果显示,单菌和混菌发酵过程中pH值变化不大,波动在5~7之间;单菌发酵时,酵母菌F3残留还原糖含量较高,但发酵产乙醇含量最低。混菌发酵时,菌株F1和F3的混菌组合残留还原糖含量较高,菌株F2和F3的混菌组合所产乙醇含量较高。在白酒酿造过程中,微生物间的生长代谢紧密相关,随发酵的进行,微生物会出现此消彼长,通过各种复杂的物质能量代谢,发酵产物会不断发生变化[16-19]。由F1、F2和F3 3株优势菌种单菌及混菌发酵液酒体成分气相色谱测定结果可知,三菌混菌发酵的酒体成分更丰富,包括了醇、醛、酸及酯四大类,更有利于发酵生产风味佳、品质高的米酒。
米酒酿造基本属于固态发酵,在实验室条件下模拟米酒酒曲中优势功能菌的发酵工艺,可能存在发酵、菌体生长、营养物质吸收和代谢产物分泌不均匀的特性,给发酵参数的检测和控制带来困难[20]。本试验在尽可能还原米酒固态发酵的基础上对米酒酒曲中优势功能菌单菌和混菌发酵相关参数进行检测,其检测结果显示米酒酒曲中优势菌种在单独发酵和多菌种共发酵情况下发酵特性不尽一致,混菌发酵时菌种间会在生长代谢等方面有抑制或促进的相互作用,甚至会改变菌种的代谢途径进而影响发酵产物的产量及成分,这对米酒生产具有指导意义,可为米酒酿造工艺的优化提供参考依据。
