紫球藻多糖免疫调节作用初步探究
2018-11-22雷金丽黄永梅谢文熙詹静婷张海涛罗辉
雷金丽,黄永梅,谢文熙,詹静婷,张海涛,4,*,罗辉,3,*
(1.广东医科大学化学教研室,广东湛江524023;2.广东医科大学湛江市环北部湾海洋微生物研究开发重点实验室,广东湛江524023;3.广东医科大学海洋医药研究院,广东湛江524023;4.广东医科大学生物化学与分子生物学研究所,广东湛江524023)
多糖是一类由多个单糖结合形成的结构复杂且庞大的糖类物质。多糖在自然界中分布广泛,对生物体具有重要作用,是生物体维持生命活动的基本物质之一。多糖具有广泛的药理作用,如抗肿瘤[1],抗菌[2],抗氧化[3]和免疫调节[4]等。一些多糖衍生物如琼胶,芦荟胶,透明质酸,卡拉胶等已经被应用到生产中。
紫球藻(porphyridium creuntum)是一类重要的海洋微藻,是红藻门中唯一的单细胞类群。其生长进入稳定期后,会向胞外分泌大量的多糖,多糖的含量可达生物量的50%。该糖主要由半乳糖,葡萄糖,木糖等单糖构成。紫球藻多糖具有独特的胶体性能,水溶液黏度大,与卡拉胶类似,在pH 1~12,温度20℃~90℃范围内稳定。紫球藻多糖的活性已经取得多方面的研究进展,例如抗氧化作用[5];抗菌与抗病毒作用[6];抗肿瘤[7]等。有关紫球藻多糖对体外免疫细胞免疫功能的研究较少,本文主要从细胞水平初步研究紫球藻多糖对免疫细胞的免疫调节作用,以期为今后紫球藻多糖开发为免疫调节剂提供理论与实践基础。
1 材料与方法
1.1 材料与试剂
1.1.1 藻种与细胞株
紫球藻:广东恒兴南方科技有限公司;小鼠巨噬细胞样细胞株RAW264.7(ATCC TIB-71):上海细胞研究所。
1.1.2 试剂
脂多糖(lipopolysaccharide,LPS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(商品名:噻唑蓝)(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,thiazolyl blue tetrazolium bromide,MTT)粉末:美国sigma公司;DMEM培养基、胎牛血清、Penicilin Streptomycin双抗:美国Gibco公司;小鼠肿瘤坏死因子-α试剂盒、小鼠白细胞介素-6试剂盒:杭州联科生物技术有限公司;一氧化氮检测试剂盒:上海碧云天生物技术有限公司;无水乙醇:天津市富宇精细化工有限公司;丙酮:天津化学试剂有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、冰醋酸:天津市富宇精细化工有限公司。
1.2 仪器与设备
240i CO2培养箱、1300series A2 超净台、30011031酶标仪:美国Thermo公司;596489荧光倒置显微镜:日本Nikon公司。
1.3 方法
1.3.1 紫球藻多糖的制备
将收集的藻液离心,藻泥经单蒸水洗涤后冷冻干燥成藻粉,取适量藻粉放入索氏提取器中脱脂,将脱油脂的藻粉按照1∶50(g/mL)放入单蒸水中,加复合蛋白酶75 mg,于50℃的恒温磁力搅拌器中酶解4 h,沸水浴灭酶10 min,4 000 r/min离心20 min后,弃沉淀,上清液调pH值至7.0,透析,再经旋转蒸发浓缩大约至原体积的1/3,向其中加入3倍体积的95%乙醇4℃冰箱过夜沉淀,沉淀后的溶液经离心弃上清,沉淀用无水乙醇和丙酮依次洗涤2次后冷冻干燥,得干燥粗多糖。试验前将称取8 mg的粗多糖,溶于10 mL的灭菌水中得到浓度为800 μg/mL的多糖溶液,用0.22 μm滤膜过滤备用,使用时再依次稀释得到400、200、100、50、25、12.5 μg/mL 的溶液。
1.3.2 RAW264.7细胞活力的测定
收集细胞,调整细胞浓度为5×105个/mL,接种于96 孔板中,100 μL/孔,置 37 ℃,5%CO2培养箱培养。设计空白组,紫球藻多糖组,LPS阳性对照组,每孔加入已经稀释好的不同浓度紫球藻多糖溶液100 μL,继续培养24 h;将板取出,每孔加入终浓度为0.5 mg/mL MTT 20 μL,继续培养 4 h,弃上清,每孔加入 150 μL DMSO,低速震荡10 min使结晶紫完全溶解,490 nm处的吸光值。
1.3.3 细胞上清液中NO含量测定
制备细胞浓度为1(106个/mL的巨噬细胞悬液,接种于 96 孔板中,100 μL/孔,置 37 ℃,5%CO2培养箱培养。如1.3.2分组与加药,继续培养24 h后,从每孔上清液吸取50 μL到新的96孔板中,用Griess法测定NO的含量。
1.3.4 巨噬细胞吞噬中性红能力的检测
制备细胞浓度为1(106个/mL的巨噬细胞悬液,接种于 96孔板中,100 μL/孔,置 37 ℃,5%CO2培养箱培养。如1.3.2分组与加药,培养24 h后,加入0.05%的中性红100 μL/孔,继续培养5 min,倾掉中性红,用温PBS洗3次,每孔加入细胞裂解液(无水乙醇:冰醋酸=1∶1(体积比)200 μL。4℃冰箱静置 2 h~3 h,待细胞裂解后,540 nm处测定吸光值,并计算吞噬指数。
1.3.5 酶联免疫吸附法(enzyme-linked immunosorbent,ELISA)试剂盒检测细胞因子释放情况
制备细胞浓度为1(106个/mL的巨噬细胞悬液,接种于 96 孔板中,200 μL/孔,置 37 ℃,5%CO2培养箱培养。如1.3.2分组与加药,培养24小时后,收集细胞上清液,3 000 r/min离心10 min。取上清并按照小鼠TNF-α与IL-6试剂盒操作。用酶标仪进行双波长检测,450 nm处测最大吸收波长,570 nm作为参考波长,最后的OD用最大波长OD值减去参考波长的OD值。
1.3.6 数据统计分析
数据均采用SPSS21.0进行统计分析,数据用x±s表示,采用单因素方差检验法处理,方差齐时用LSD方法进行组间的比较,方差不齐时,用Dunnett T3比较,P<0.05认为有统计学意义。
2 结果与分析
2.1 紫球藻多糖对细胞活力的影响
紫球藻多糖对细胞活力的影响见图1。

图1 不同浓度紫球藻多糖对细胞活力的影响Fig.1 Effects of different concentrations of porphyridium creuntum polysaccharide on cell viability
采用MTT法检测细胞活力时,用细胞相对增殖率表示药物对细胞活力的影响,样品组的吸光值与空白组的吸光值之比的百分率即为细胞相对增殖率。当细胞相对增殖率大于100%时,表明细胞增殖,活力上升,药物对细胞无毒性;当细胞相对增殖率小于100%时,细胞生长受到抑制,活力下降,药物对细胞有抑制作用。如图1所示,加药培养24 h与48小时后,细胞相对增殖率几乎都是100%,与空白对照组相比,均无统计学意义,说明紫球藻多糖浓度在12.5 μg/mL~400 μg/mL范围内不影响细胞活力,对细胞无毒性。
2.2 紫球藻多糖对巨噬细胞释放NO的影响
紫球藻多糖刺激巨噬细胞释放NO情况见图2。

图2 不同浓度紫球藻多糖刺激巨噬细胞释放NO情况Fig.2 Effects of different concentrations of porphyridium creuntum polysaccharide on the release of NO of mirophage cell
从图2可以看出,LPS和不同浓度的紫球藻多糖均能够促进细胞释放NO,与空白组相比均具有统计学意义(P<0.05),NO的释放量与紫球藻多糖浓度呈剂量依懒性。
2.3 紫球藻多糖对巨噬细胞吞噬作用的影响
紫球藻多糖对巨噬细胞吞噬能力的影响见图3。

图3 不同浓度紫球藻多糖对巨噬细胞吞噬能力的影响Fig.3 Effects of different concentrations of porphyridium creuntum polysaccharide on the phagocytosis of mirophage cell
与正常对照组相比,LPS与各浓度紫球藻多糖均能够促进巨噬细胞吞噬中性红,紫球藻多糖在12.5 μg/mL~400 μg/mL 质量浓度范围内具有显著性差异(P<0.05)。
2.4 细胞因子TNF-α与IL-6的分泌情况
紫球藻多糖对巨噬细胞分泌TNF-α的影响见图4。

图4 不同浓度紫球藻多糖对巨噬细胞分泌TNF-α的影响Fig.4 Effects of different concentrations of porphyridium creuntum polysaccharide on the secretion of TNF-α of macrophages
由图4可知,与空白组相比,不同浓度的紫球藻多糖和LPS均能够促进TNF-α的分泌,有显著性差异(P<0.05)。TNF-α的分泌呈现先上升后下降的趋势,质量浓度从 12.5 μg/mL~50 μg/mL时,分泌量上升,100 μg/mL~400 μg/mL 范围内,分泌量下降。50 μg/mL的浓度促进作用最强。
紫球藻多糖对巨噬细胞分泌IL-6的影响见图5。
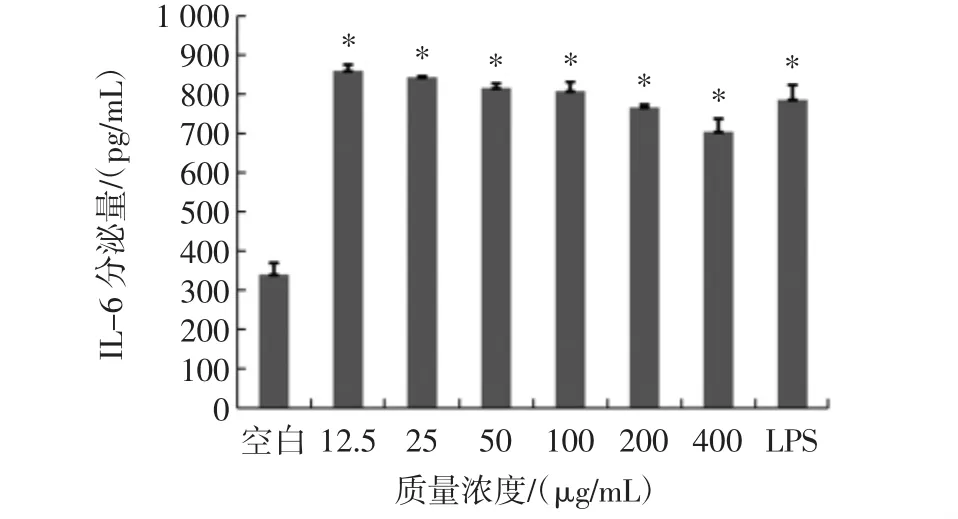
图5 不同浓度紫球藻多糖对巨噬细胞分泌IL-6的影响Fig.5 Effects of different concentrations of porphyridium creuntum polysaccharide on the secretion of IL-6 of macrophages
不同浓度的紫球藻多糖和LPS均能够促进IL-6的分泌,但是IL-6的分泌量随着紫球藻多糖浓度的增加出现降低的趋势,但是仍然有统计学意义(P<0.05)。在12.5 μg/mL时促进效果最佳。
3 讨论与总结
巨噬细胞来源于单核细胞,是一种重要的免疫细胞,参与非特异性防御与特异性防御过程。巨噬细胞具有强大的吞噬能力,吞噬能力是巨噬细胞发挥免疫调节的通路之一。巨噬细胞通过其表面的受体识别入侵的病原微生物等抗原性异物,将异物进行吞噬或者胞饮作用传递到细胞内,成为吞噬体,在吞噬体内通过自身的灭菌系统将异物清除,同时巨噬细胞还可以作为提呈细胞,将吞噬的异物提呈给T淋巴细胞,启动免疫应答。另一方面一些细胞因子如TNF-α,IL-6等与活性效应分子如NO的释放均可以促进巨噬细胞识别抗原性异物,提高巨噬细胞吞噬能力,增强机体的抵抗力。
细菌感染主要是由革兰阴性菌引起的,LPS是革兰阴性菌细胞壁的成分,它对宿主有毒性作用,可引起发热,内毒素休克等。LPS特异性的与细胞表面的TLR-4受体结合,促进巨噬细胞分泌TNF-α、IL-6、NO等细胞因子来抵抗外来入侵,发挥免疫调节作用。研究表明,多糖调节机体的免疫功能,表现为增强细胞的吞噬能力,刺激免疫细胞产生细胞因子如TNF-α、IL-6、NO等。如Song等[8]发现柴胡多糖通过促进NO和细胞因子TNF-α的产生来提高机体的免疫力。liu等[9]建立了环磷酰胺诱导小鼠免疫低下模型,给予黄芪多糖治疗,结果发现黄芪多糖能够增强小鼠巨噬细胞的吞噬能力,且能使免疫低下组小鼠的TNF-α、IL-2等细胞因子恢复到正常水平。Jose等[10]研究了硫酸化扇藻多糖对RAW264.7细胞的免疫调节作用,结果表明扇藻硫酸多糖通过促进RAW264.7细胞的增殖,增加NO的释放,提高TNF-α,IL-6等细胞因子来发挥免疫调节作用。ren等[11]探究了羟乙基化猴头菌多糖对巨噬细胞RAW264.7的免疫调节作用,试验表明,羟乙基化猴头菌多糖通过刺激TNF-α、IL-6、NO的分泌来提高免疫活性。
NO是一种重要的免疫调节因子[12],各种外界的刺激,如LPS等均可以诱导巨噬细胞释放NO。NO对机体的免疫调节十分广泛且复杂,是巨噬细胞发挥免疫调节作用的基础,且参与杀害病原微生物,杀害肿瘤细胞,并介导一系列的免疫应答过程。
TNF-α是一种主要由巨噬细胞和单核细胞产生的促炎细胞因子,并参与炎症反应与免疫反应。TNF-α也是一种关键的炎症因子,在宿主防御过程中起着重要作用。IL-6可以诱导成熟的CD4+T分化为Th2细胞并促进B细胞对免疫球蛋白和急性期球蛋白的分泌。
本试验基于小鼠腹腔巨噬细胞RAW264.7,初步探究了紫球藻多糖对其存活率,吞噬能力,NO释放能力以及细胞因子TNF-α和IL-6分泌能力的影响。由于LPS能够很好的激活巨噬细胞,是探究巨噬细胞免疫调节作用常用的阳性对照药物,因此本试验选择LPS作为阳性对照,通过免疫调节的相关的指标,共同探究其与紫球藻多糖对巨噬细胞免疫调节作用规律。结果表明:紫球藻多糖作用24 h时,与空白对照组相比,无统计学意义,对细胞存活力无影响,但是作用48小时后,细胞存活率相对于空白组虽没有统计学意义,但是细胞活力相比于24 h稍微有点降低,说明药物作用24 h时效果较好。因此为了排除药物本身对试验的干扰,本文所采取药物作用时间为24 h。在本试验中,不同浓度的紫球藻多糖与LPS均可以刺激细胞释放NO,紫球藻多糖组的NO释放量均低于LPS组,但紫球藻多糖组与LPS组的释放量均高于空白组,且相对于空白组都具有统计学意义(P<0.05);这与Zheng Pimiao等[13]研究的结果一致。说明紫球藻多糖能够激活巨噬细胞。Zheng Yi等[14]研究川芎多糖对免疫抑制小鼠功能改善作用,研究结果发现川芎多糖可以提高免疫抑制小鼠吞噬细胞的活性,川芎多糖浓度越大,吞噬能力越强,呈剂量依赖性。类似的,本文的实验结果表明不同浓度的紫球藻多糖都能够增强巨噬细胞的吞噬能力,且吞噬能力随着紫球藻多糖浓度的增加而增强,相比于空白组都具有显著性差异(P<0.05)。在12.5 μg/mL~50 μg/mL 浓度范围,吞噬能力增强的比较明显,但是小于LPS的增强作用;浓度在100 μg/mL~400 μg/mL时,虽然吞噬能力随着紫球藻多糖浓度增大而增强,且高于LPS的刺激,但是增强能力趋于平缓。说明低浓度范围的紫球藻多糖能较好的增强巨噬细胞的吞噬能力,而这一点与Zheng Yi的报道有所区别。有研究表明多糖受体主要是Ш型补体受体,属于整合素家族,主要存在于巨噬细胞,自然杀伤细胞和多形核中性粒细胞表面。多糖与受体结合有一下几个特点:可逆性、饱和性,特异性且存在活性中心。基于此,紫球藻多糖与巨噬细胞的作用可能作用存在一个饱和值,这个饱和值可能与细胞膜表面受体有关,所以导致浓度升高,巨噬细胞的吞噬能力增强的效果不明显。因此有关紫球藻多糖与巨噬细胞表面受体的相互作用机理有待进一步的研究。不同浓度的紫球藻多糖均可以刺激巨噬细胞释放TNF-α,与空白对照组相比,都具有显著性差异(P<0.05)。但是TNF-α释放量呈先上升后下降的趋势,最佳释放量对应的紫球藻多糖浓度是50 μg/mL。各浓度的紫球藻多糖同样可以刺激IL-6的释放,但是IL-6的释放量随着紫球藻浓度的增加反而出现降低的趋势,但是相比于空白对照组,仍具有显著性差异(P<0.05)。紫球藻多糖浓度在12.5 μg/mL~100 μg/mL 区间内,对 IL-6 释放量的促进作用比较明显,且各组间的释放量相差不大,而浓度在 200 μg/mL~400 μg/mL 区间促进作用明显低于12.5 μg/mL~100μg/mL该区间的促进作用。因此综上紫球藻多糖浓度为50 μg/mL时,是促进TNF-α与IL-6释放的最佳浓度。据文献报道Liu Wei等[15],Liu Xin等[16],多糖通过刺激TNF-α与IL-6分泌来提高免疫水平,且随着多糖浓度的升高,TNF-α与IL-6的分泌量上升。然而本研究结果并未与文献报道的结果相一致,这可能与紫球藻多糖复杂的结构,其与细胞表面受体作用特点,其巨大的分子量有关,因此紫球藻多糖剂量与TNF-α与IL-6的分泌量的关系仍需要更进一步的研究。
本试验首次探究紫球藻多糖对两种重要细胞因子TNF-α与IL-6分泌的影响,并且取得了良好效果。综上,本研究初步证明,紫球藻多糖通过增强巨噬细胞的吞噬能力,促进NO、TNF-α与IL-6的释放来参与免疫应答,提高机体的免疫力。
