食品接触材料中3种致病菌的多重荧光PCR检测
2018-11-22
(福建省产品质量检验研究院国家加工食品质量监督检验中心(福州),福建福州350000)
近年来,食品安全问题备受关注,其中食品接触材料受致病菌污染也是引起食源性疾病的重要原因之一[1]。我国对食品接触材料的定义为:在正常使用条件下,各种已经或预期可能与食品或食品添加剂(以下简称食品)接触、或其成分可能转移到食品中的材料和制品,包括食品生产、加工、包装、运输、贮存、销售和使用过程中用于食品的包装材料、容器、工具和设备,及可能直接或间接接触食品的油墨、黏合剂、润滑油等[2]。由此可见食品接触材料范围广、种类多,不再是单纯的食品容器和包装材料,且与食品直接接触,食品接触材料中的致病菌可能会迁移入食品中。在监测与检测食源性致病菌方面,也急需建立针对食品接触材料的特异性好且灵敏度高的快速检测方法。
金黄色葡萄球菌、沙门氏菌和副溶血性弧菌是3种常见的食源性致病菌。传统的微生物检测和鉴定方法一般要经过增菌、分离培养、生化试验和血清学鉴定等多个步骤,试验周期长,操作繁琐。多重实时荧光聚合酶链式反应(polymerase chain reaction,PCR)技术是在荧光PCR技术基础上增加多于两对的引物和相应的探针,实现在同一个反应体系中对多个目标序列的有效扩增,并因其快速高效等优点被应用到致病微生物检测工作中[3]。
本文参照相关文献[4-5],以金黄色葡萄球菌谷氨酰胺合成酶家族蛋白编码基因gltS、沙门氏菌属菌毛蛋白基因fimY和副溶血性弧菌毒力表达调控基因toxS为靶基因,建立检测3种致病菌的多重实时荧光PCR方法,为建立和完善食品接触材料中3种食源性致病菌快速检测技术提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株
试验中所用菌株共6株,其中目标菌株金黄色葡萄球菌(ATCC25923)、副溶血性弧菌(ATCC17802):北京陆桥技术有限责任公司;鼠伤寒沙门氏菌(CGMCC1.1174):中国工业微生物菌种保藏管理中心;其余3种供试菌种表皮葡萄球菌(ATCC12228)、大肠埃希氏菌(ATCC25922):北京陆桥技术有限责任公司;创伤弧菌(ATCC27562):广东环凯微生物科技有限公司。所有菌株均保存于福建省产品质量检验研究院食品所微生物室菌种保藏库。
1.1.2 食品接触材料
食品接触材料种类繁多,为了便于材料的高压灭菌及人工制备细菌污染样品,随机抽取某食堂的清洗消毒后的不锈钢餐具碗,标记为食品接触材料S。
1.1.3 主要试剂
细菌基因组DNA提取试剂盒、溶菌酶(50 mg/mL):天根生化科技有限公司;10×PCR缓冲液、25 mmol/L MgCl2、10 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleotidetriphosphates,dNTPs)、TaqDNA 聚合酶(5U/μL):上海生工生物工程股份有限公司。
脑心浸出液肉汤(brain heart infusion broth,BHI)、Baird-Parker琼脂培养基、营养琼脂(nutrient agar,NA)平板、缓冲蛋白胨水(bufferedpeptonewater,BPW)、7.5%NaCl肉汤、3%NaCl碱性蛋白胨水、硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose agar culture medium,TCBS):北京陆桥技术有限责任公司;沙门氏菌显色平板、金黄色葡萄球菌显色平板、副溶血性弧菌显色平板:法国科玛嘉公司。
引物和探针:以金黄色葡萄球菌谷氨酰胺合成酶家族蛋白编码基因gltS、沙门氏菌属菌毛蛋白基因fimY和副溶血性弧菌毒力表达调控基因toxS为靶基因设计特异性引物和探针,见表1。各引物探针均由上海生工生物工程股份有限公司合成。
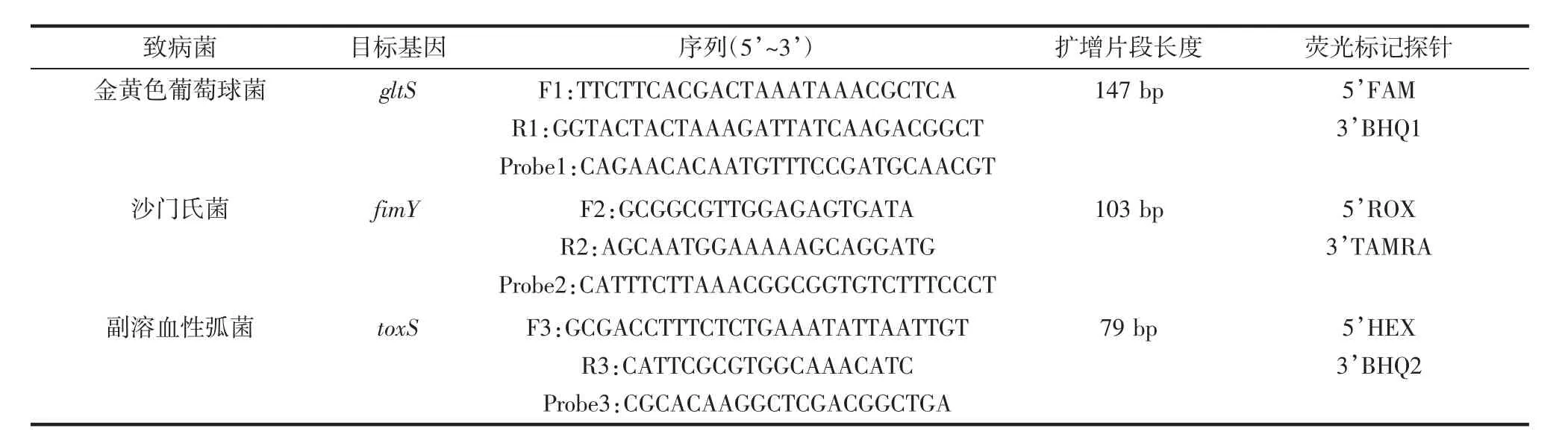
表1 引物和探针序列Table 1 Sequences of primers and probes
1.1.4 主要仪器
ABI 7500实时荧光定量PCR仪:美国Life Tech公司;Minispin台式离心机:德国Eppendorf公司;IKAMS3 basic涡旋混合器:上海琪特分析仪器有限公司;SterilGARDⅢAdvance生物安全柜:美国Baker公司;HVE50高压灭菌锅:日本Hirayama公司。
1.2 方法
1.2.1 菌种培养及细菌DNA提取
所有菌株经BHI肉汤活化及纯化培养后取1 mL细菌纯培养液或样品增菌液,13 000 r/min室温离心5 min,弃去上清,使用溶菌酶37℃处理1 h,用细菌基因组DNA提取试剂盒提取细菌DNA,以BHI培养基提取物为阴性对照。
取金黄色葡萄球菌、沙门氏菌和副溶血性弧菌经BHI肉汤活化后的菌液用无菌生理盐水梯度稀释至10-6。分别取10-5、10-6稀释液0.2 mL涂布于各自的选择性平板培养计数,每种菌每个稀释度涂布两个平板。同时采用细菌基因组DNA提取试剂盒提取各个稀释度的细菌DNA。
1.2.2 单重荧光PCR反应
分别以金黄色葡萄球菌、沙门氏菌和副溶血性弧菌的基因组DNA为模板进行扩增。单重荧光PCR反应体系:10×PCR Buffer 5 μL,25 mmol/L MgCl24 μL,10 mmol/L dNTPs 1 μL,10 μmol/L 上下游引物各 2 μL,探针1μL,5U/μLTaqDNA聚合酶1μL,模板DNA3μL,ddH2O补足至50 μL。反应参数:94℃预变性10 min;94℃变性15 s,60℃退火并延伸60 s,45个循环,在每个循环的退火延伸阶段收集荧光信号。所有PCR试验均以BHI培养基提取物为阴性对照,以无菌超纯水为空白对照。
1.2.3 多重实时荧光PCR反应的建立和优化
以 50 μL 反应体系中 10 × PCR Buffer 5 μL、25 mmol/L MgCl24 μL 和 10 mmol/L dNTPs 1 μL 为基础,对3株目标菌株的引物、探针和Taq DNA聚合酶的使用量进行优化,确认最优多重实时荧光PCR反应体系。设立培养基提取阴性对照和无菌水空白对照。
1.2.4 特异性试验
将金黄色葡萄球菌、沙门氏菌、副溶血性弧菌和其他3种供试菌种的基因组DNA提取液等量混合,依据1.2.3优化后的体系进行三重荧光PCR检测,验证方法特异性。设立培养基提取阴性对照和无菌水空白对照。
1.2.5 灵敏度试验
以金黄色葡萄球菌、沙门氏菌和副溶血性弧菌各个稀释度的细菌DNA提取液为模板分别进行多重实时荧光PCR检测,确定方法的灵敏度。设立培养基提取阴性对照和无菌水空白对照。
1.2.6 模拟阳性样品检测
将食品接触材料S于121℃高压蒸汽灭菌30 min,获得无菌样品,用于人工污染菌液。待材料表面干燥后,将金黄色葡萄球菌、沙门氏菌和副溶血性弧菌3种菌株培养液各取0.2 mL滴加到同一材料的食品接触表面,轻轻转动材料使菌液尽可能覆盖与食物接触的内壁表面。
用1 mL无菌生理盐水湿润10张2.0 cm×2.5 cm(5 cm2)灭菌滤纸片(总面积为 50 cm2)[6]。选择材料与食物接触的内壁表面,贴上10张湿润的灭菌滤纸片。30 s后取下,置于相应的液体培养基内,37℃增菌18 h~24 h,用细菌基因组DNA提取试剂盒提取细菌DNA,依据1.2.3优化后的体系进行三重荧光PCR检测,并设立培养基阴性对照和无菌水空白对照。
2 结果与分析
2.1 单重实时荧光PCR
金黄色葡萄球菌、沙门氏菌、副溶血性弧菌的单重荧光PCR扩增,结果见图1至图3。由图1~图3可知,金黄色葡萄球菌、沙门氏菌和副溶血性弧菌的单重荧光PCR扩增效果良好。3对引物探针的退火温度基本一致,扩增片段长度差异不大,扩增效率较好,适合构建多重实时荧光PCR体系。
2.2 多重实时荧光PCR

图1 金黄色葡萄球菌的单重荧光PCR扩增图Fig.1 A single real-time PCR assay of Staphylococcus aureus
3株目标菌的三重荧光PCR扩增结果见图4。通过试验比较,3对引物探针之间不会产生非特异性扩增,可构建三重荧光PCR体系。对体系进行优化后确定最佳反应体系为:10×PCR Buffer 5 μL,25mmol/L MgCl24 μL,10 mmol/L dNTPs 1 μL,10 μmol/L 上下游引物各 1.5 μL,探针各 1 μL,5 U/μL Taq DNA 聚合酶1.5 μL,模板 DNA 3 μL,ddH2O 补足至 50 μL。反应参数:94℃预变性10 min;94℃变性15 s,60℃退火并延伸60 s,45个循环,在每个循环的退火延伸阶段收集荧光信号。
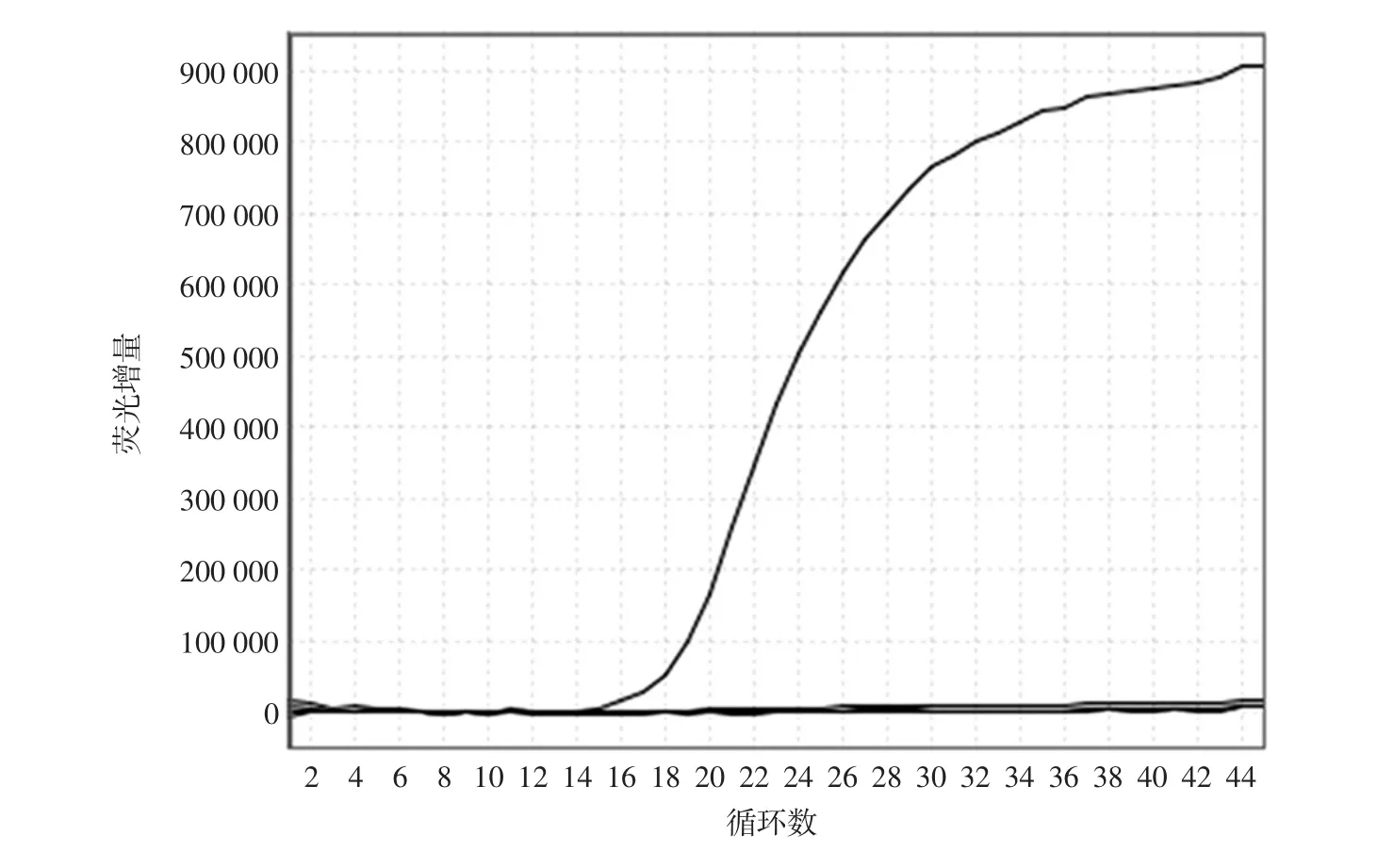
图2 沙门氏菌的单重荧光PCR扩增图Fig.2 A single real-time PCR assay of Salmonella

图3 副溶血性弧菌的单重荧光PCR扩增图Fig.3 A single real-time PCR assay of Vibrio parahaemolyticus
2.3 特异性试验
3株目标菌的多重实时荧光PCR的特异性检测结果见图5。根据优化后的多重实时荧光PCR方法,同时扩增金黄色葡萄球菌、沙门氏菌、副溶血性弧菌、表皮葡萄球菌、大肠埃希氏菌和创伤弧菌6种基因组DNA,结果显示金黄色葡萄球菌、沙门氏菌和副溶血性弧菌3株目标菌有扩增曲线,而表皮葡萄球菌、大肠埃希氏菌和创伤弧菌3株非目标菌无扩增曲线,证明该方法具有良好的特异性。
2.4 灵敏度试验
3株目标菌的多重实时荧光PCR灵敏度检测结果见图6至图8。金黄色葡萄球菌、沙门氏菌和副溶血性弧菌经平板计数,菌液浓度分别为4.8×107、6.2×107、4.4×107CFU/mL,以 1×107CFU/mL 为起始进行 10 倍系列稀释,共7个稀释度,以各个稀释度的细菌DNA提取液为模板进行多重实时荧光PCR检测。结果显示金黄色葡萄球菌、沙门氏菌和副溶血性弧菌的PCR检测灵敏度均达到103CFU/mL。

图4 多重实时荧光PCR扩增图Fig.4 Multiplex real-time PCR assay
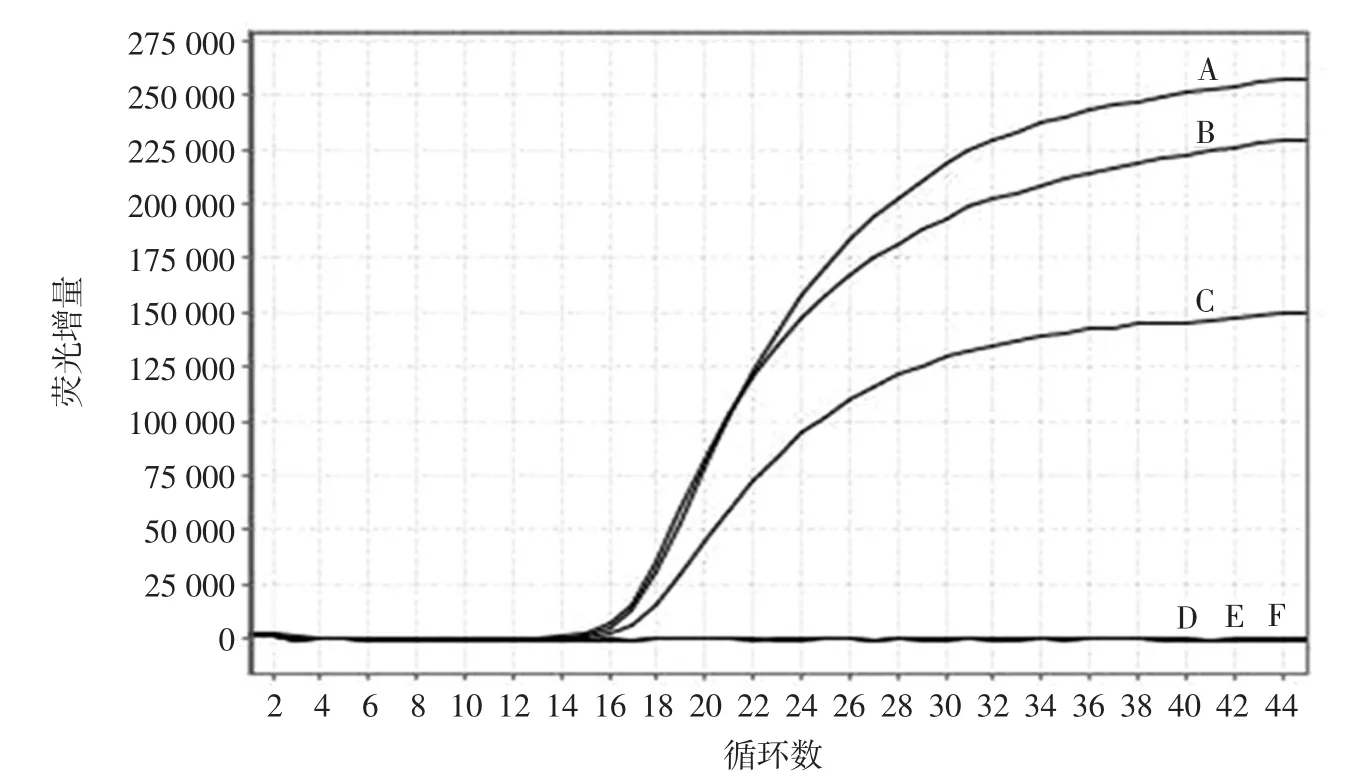
图5 多重实时荧光PCR的特异性检测结果Fig.5 The specificity of multiplex real-time PCR assay

图6 金黄色葡萄球菌多重实时荧光PCR的灵敏度检测结果Fig.6 The sensitivity of multiplex real-time PCR for detecting Staphylococcus aureus

图7 沙门氏菌多重实时荧光PCR的灵敏度检测结果Fig.7 The sensitivity of multiplex real-time PCR for detecting Salmonella

图8 副溶血性弧菌多重实时荧光PCR的灵敏度检测结果Fig.8 The sensitivity of multiplex real-time PCR for detecting Vibrio parahaemolyticus
2.5 食品接触材料模拟阳性样品的检测
食品接触材料S经高压灭菌后人工污染致病菌模拟阳性样品,其多重实时荧光PCR检测结果见图9。结果显示3株目标菌的扩增曲线良好,特异性强,与预期相符,说明在检测食品接触材料中的金黄色葡萄球菌、沙门氏菌和副溶血性弧菌3种致病菌方面,本方法具有较好的特异性和实用性。
3 结论与讨论
目前针对食品接触材料中致病菌检测的研究较少,本研究成功建立了食品接触材料中金黄色葡萄球菌、沙门氏菌和副溶血性弧菌3种致病菌的多重实时荧光PCR检测方法,具有良好的特异性,检测灵敏度均达到103CFU/mL,荧光信号不会互相干扰。
现行的食品微生物检测国家标准为分离培养法,该传统方法相对成熟,假阳性率低,但检测步骤包括前增菌、选择性增菌、菌落分离、生化鉴定等步骤,检测周期一般需要3 d~7 d,检测灵敏度相对也较低[7-10]。随着分子生物学的发展,基于PCR技术的多种检测方法也得到了广泛应用,其中多重实时荧光PCR技术采用多对引物和相应的探针在同一反应中能同时扩增出多个目标序列,应用至食源性致病菌的检测方面快捷高效,针对性强,国内外已有不少相关研究[11-15]。但也有文献报道,多重PCR技术可能出现假阳性结果或交叉扩增现象,这可能是由于样品中含有大量死菌或干扰检验的复杂成分[16-17]。在实际操作中,食品接触材料中的致病菌含量并不是很高,因此无论是传统培养法还是PCR法检测都需要增菌过程,去除因样品中的死菌或特殊成分造成的影响,提高检测准确率[18]。此外,在检验工作中可以将多重实时荧光PCR法与传统培养法相结合,对于PCR阳性样品进行病原菌分离培养和生化鉴定等验证,排除假阳性结果,对于PCR阴性样品则可以直接判定。
因此,应用多重实时荧光PCR法检测食品接触材料中的食源性致病菌是行之有效的,未来还可针对更多食品接触材料相关的致病菌建立多重实时荧光PCR快速检测方法,并随着其他检测技术的更新换代得到更广泛的应用[19]。
