血管性痴呆大鼠海马中神经递质囊泡转运体的表达
2018-11-20曹岩菁吴佳丽李鹏林萍冯莉王琴任谦谢晓峰
曹岩菁,吴佳丽,李鹏,林萍,冯莉,王琴,任谦,谢晓峰
(杭州市第三人民医院 全科医学科,浙江 杭州 310009)
血管性痴呆(vascular dementia,VaD)是由血管因素引起的第二大类型的痴呆,是以行为、运动异常、帕金森病样步态障碍、构音障碍和自主神经功能障碍以及认知功能障碍为主的一组综合征。而神经递质,如谷氨酸(glutamic,Glu)、乙酰胆碱(acetylcholine,ACh)、γ-氨基丁酸(γ-aminobutyric acid,GABA)等在认知功能障碍的过程中扮演重要的角色。Glu是存在于哺乳动物体内主要的兴奋性神经递质,其功能主要与突触的适应性、记忆以及神经和胶质细胞的死亡有关。以往的研究表明,在AD患者中上述神经递质常有明显的变化[1],而在VaD中这项研究较少。通过建立全脑缺血状态下的VaD的动物模型,检测其行为学及不同递质的囊泡转运体[谷氨酸囊泡转运体(glutamic vesicle transporters,vGluTs)、乙酰胆碱囊泡转运体(acetylcholine vesicle transporters,vAChT)、γ-氨基丁酸囊泡转运体(γ-aminobutyric acid vesicle transporters,vGAT)]在大鼠海马CA1-3区中的表达,为研究全脑缺血所致的VaD疾病发生的病理生理机制提供理论基础。
1 材料和方法
1.1 材料 选取SD大鼠36只,购自上海斯莱克实验动物有限公司,动物许可证号:SCXY(沪)2012-0002。雄性18只,雌性18只,年龄19个月,体质量230~270 g。实验前,大鼠适应性喂养7 d,室温控制在25~28 ℃,相对湿度50%~60%,12 h明暗交替光照,排除有游泳障碍的大鼠。
1.2 分组及造模 将SD大鼠编号,随机分为正常组、对照组、痴呆组。痴呆组模型的建立:腹腔内注射硝普钠(2.0 mg/kg),钝性分离双侧颈总动脉(common carotid crtery,CCA);夹闭双侧CCA 10 min,再通5 min,再夹闭10 min,再通,连续3次,青霉素预防感染,保温饲养。对照组:步骤同上,仅分离双侧CCA,不阻断血流。术后缝合消毒,保温饲养。正常组:不做处理。于术前8~12 h禁食,不禁水。
1.3 Morris水迷宫实验 正常组、对照组、痴呆组在术后63~68 d行Morris水迷宫实验检测空间学习记忆能力。
1.4 T-迷宫延迟交替实验 为了检测大鼠工作记忆能力,水迷宫实验后3 d,所有大鼠均进行T-迷宫延迟交替实验。
1.5 Western blot检测 术后12周大鼠完成所有的行为学测试后,选取每组9只大鼠断头取脑,行Western blot检测。BCA法测定蛋白浓度,根据标准曲线计算样品的蛋白浓度。将PVDF膜置于保鲜膜上,取适量ECL试剂盒中等体积的A液和B液混合,混匀后加在膜的表面,移入凝胶成像分析仪中,化学光敏模式曝光显影。照片以TIFF格式导出后在ImageJ软件下分析各条带光密度。
1.6 免疫组织化学检测vGluTs、vAChT及vGAT的表达 另取每组3只大鼠,断头取脑,冰上分离海马,行免疫组织化学检测。显微镜下观察,随机选择4个不同的视野(×200),判读阳性表达强度和阳性率。
1.7 统计学处理方法 采用SPSS17.0进行统计学分析。计量资料均用表示,多组比较采用单因素方差分析,组间两两比较用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组Morris水迷宫实验结果 随训练次数的增加,3组大鼠第1天逃避潜伏期的时间差异无统计学意义(P>0.05)。第2~第5天,痴呆组大鼠与正常组及对照组相比,逃避潜伏期的时间明显延长,差异有统计学意义(P<0.05),见图1A;探索实验中,与正常组及对照组相比,痴呆组大鼠穿越平台的次数明显减少,差异有统计学意义(P<0.05),见图1B。与其他2组比,痴呆组大鼠在目的象限中游行距离占总游行距离的百分比明显缩短,差异有统计学意义(P<0.01),见图1C。而3组大鼠的游泳速度差异无统计学意义(P>0.05)。
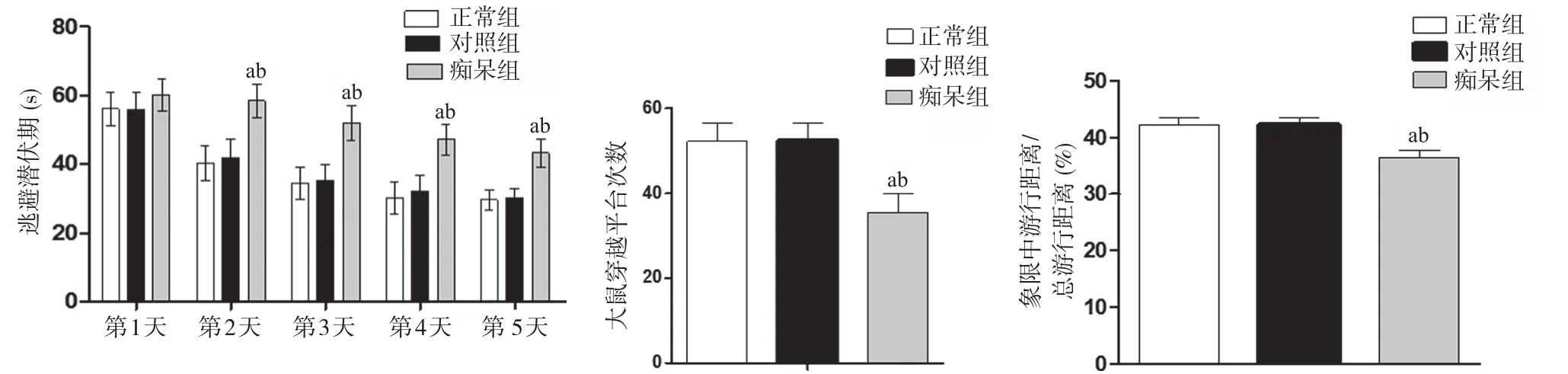
图1 3组Morris水迷宫试验结果
2.2 3组T-迷宫延迟交替实验结果 第1天3组大鼠之间延缓交替作业的正确率差异无统计学意义(P>0.05);与正常组及对照组相比,第7天痴呆组大鼠延缓交替作业的正确率下降,错误率增加,差异有统计学意义(P<0.01)。见图2。
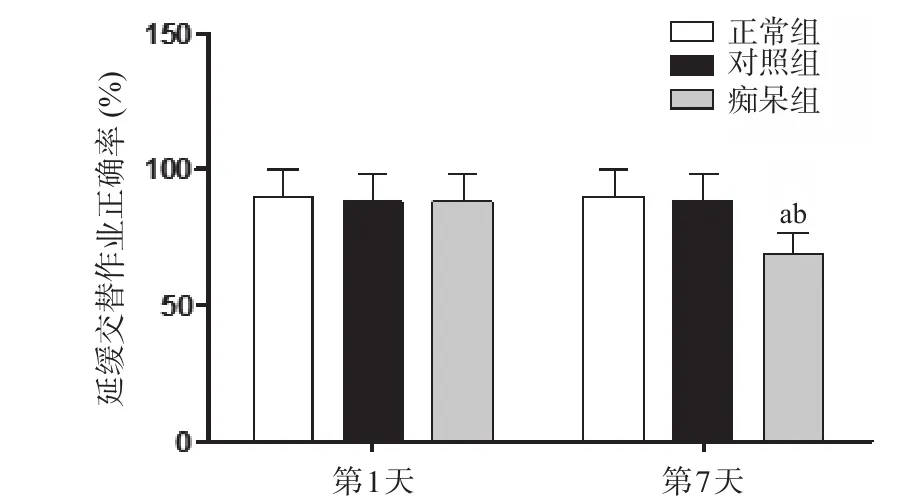
图2 3组T-迷宫延迟交替实验结果
2.3 3组vGluTs、vAChT及vGAT Western blot检测结果 与正常组及对照组相比,痴呆组大鼠海马vGluT1、vGluT3和vAChT的表达下降,差异有统计学意义(P<0.01);而vGluT2和vGAT的表达,3组间差异无统计学意义(P>0.05),见图3。
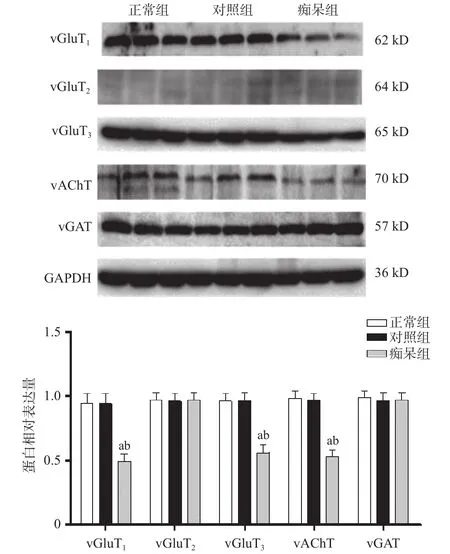
图3 3组大鼠海马中vGluT1、vGluT2、vGluT3、vAChT和vGAT的蛋白表达量
2.4 3组海马CA1-3中vGluT1阳性神经元的表达水平 与正常及对照组相比,痴呆组大鼠海马CA1-CA3区中vGluT1阳性神经元的水平降低,差异有统计学意义(P<0.01),见图4。
2.5 3组海马CA1-3中vGluT3阳性神经元的表达水平 与正常组及对照组相比,痴呆组大鼠海马CA1-CA3区中vGluT3阳性神经元的数量下降,差异有统计学意义(P<0.01);且CA1区下降明显最明显,差异有统计学意义(P<0.01),见图5。
2.6 3组海马CA1-3中vAChT阳性神经元的表达水平 与正常组及对照组相比,痴呆组大鼠海马CA1-CA3区中vAChT阳性神经元的表达水平明显下降,差异有统计学意义(P<0.01);且CA1区下降最明显,差异有统计学意义(P<0.01),见图6。
3 讨论
Glu经vGluTs摄取后,贮存于相应突触的囊泡内[2]。而GABA则是存在于中枢神经系统内主要的抑制性神经递质,除了能够调节记忆和睡眠觉醒的周期外,还可以调节因神经功能紊乱引起的GABA突触效能的变化。ACh是另一种与学习记忆关系最为密切的神经递质,通常情况下,vAChT能够特异地定位在胆碱能神经突触囊泡膜上,快速专一的转运ACh神经递质进人囊泡,维持正常ACh神经元发挥作用,因此,vAChT也被看做是特异性较高的胆碱能神经递质标志物[3-4]。
Morris水迷宫是评价啮齿动物空间学习记忆的最常用模型之一[5]。通过让动物不断地练习,动物可以充分利用环境中所提供的标记物与隐匿的平台之间的关系,再次判断水中平台的位置,最终在动物脑内形成稳定的空间认知。Morris水迷宫实验结果发现,痴呆组大鼠与正常及对照组相比,其逃避潜伏期的时间明显延长。在空间探索实验中:与正常组及对照组相比,痴呆组大鼠穿越平台的次数明显减少,且在象限中游行距离占总游行距离的百分比也明显缩短。除此之外T迷宫实验中,与正常组及对照组相比,第7天痴呆组大鼠延缓交替作业的正确率明显下降,错误率明显增加,提示在慢性全脑缺血状态下,痴呆组大鼠存在着多种学习和记忆能力的缺损。

图4 3组海马CA1-3区vGluT1阳性神经元表达水平(免疫组织化学染色,×200)
通过间断对大鼠双侧颈总动脉进行闭塞(BCCAO),成功地建立了VaD的动物模型。以往的研究表明,BCCAO易导致动物脑区发生低灌注,从而导致脑代谢变化、学习及记忆功能障碍、神经信号传导障碍等[6]。除此之外,BCCAO导致的慢性脑低灌注还可引起更加严重的氧化应激和胆碱能功能的障碍[7]。研究表明,ACh是一种具有多种功能的神经递质的有机分子,在记忆形成的过程中扮演极其重要的作用,且在胆碱能神经元的胞质及神经末梢中广泛存在。通常,其通过ChAT合成,然后由vAChT转运到突触小泡中储存[3]。中枢胆碱能的缺乏会导致AD患者的学习和记忆障碍[8];然而,关于上述的这些变化的机制如何目前仍然存在争议。以往的研究表明,Glu在突触囊泡中的聚集需要vGluT1、vGluT2和vGluT3的共同作用[9],因此vGluTs常被看作Glu转运的关键性功能标志物[10]。不仅如此,Glu还可以与其他经典神经递质一起释放产生协同作用,如胆碱能脊髓运动神经元释放的Glu能够和兴奋其他运动神经元[11]。然而,关于兴奋性Glu和抑制性GABA神经递质的共释放的学说却一直备受争议[12]。本研究发现慢性全脑缺血3个月后,痴呆组大鼠海马vGluT1和vGluT3水平表达明显降低。而vGluT2和vGAT的水平与正常组及对照组相比却无明显变化。除此之外,vAChT神经元的数量在VaD大鼠海马中的表达也明显下降。这与慢性脑灌注不足可能引起的BCCAO/AD大鼠海马中枢胆碱能功能障碍的研究结果[1]一致。在脑内,锥体细胞表达vGluT1并组成了哺乳动物大脑皮层70%的神经元,而海马vGluT1神经元数量的明显下降也从另一个层面反应了大脑皮层Glu能神经末端的严重受损,即Glu能系统的严重损坏。而这种损害大大降低了Glu能神经递质的传递强度,损坏的区域同别的皮层及皮层下的区域产生断连,于是大鼠的认知功能产生了障碍。本研究还发现,痴呆组大鼠vAChT和vGluT3神经元的数量在海马及其亚区中同步下降,这与vGluT3与胆碱能纹状体中间神经元之间的解剖有关,缺乏vGluT3在一定程度上会导致纹状体ACh的释放能力降低[13]。换句话说,囊泡ACh的摄取和释放是需要Glu的共同协同作用的,因此当慢性缺血导致海马中的vGluT3的水平下降时,这种协同作用也会降低,于是纹状体ACh的释放功能也随之下降。
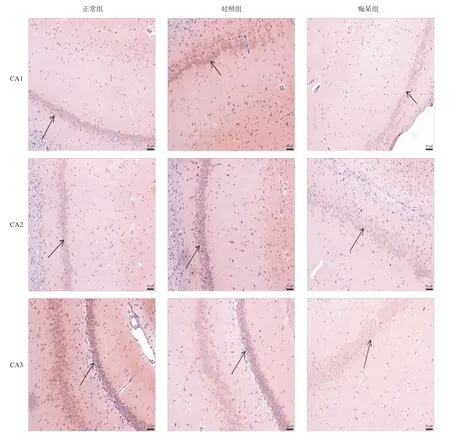
图5 3组大鼠海马CA1-3区vGluT3阳性神经元表达水平(免疫组织化学染色,×200)
海马是支持和产生记忆功能的网络中心。在神经病理事件如缺血中,海马是受其影响最大、最脆弱的脑区之一[14]。通常海马主要是由齿状回(DG)和Ammon角(cornu ammonis,CA)组成,且分为4个字段:即CA1、CA2、CA3和CA4[15]。以往的研究表明,CA1和CA2的神经元的体积在血管性痴呆、AD和混合性痴呆的患者中明显减少。而神经元体积的减少是导致海马网络功能紊乱,认知功能障碍产生的原因之一。同样,CA3和CA4神经元中的锥体神经元也会产生类似于CA1和CA2的病理性损伤,因为它们都有着在相似的解剖结构[14]。本研究中发现,在慢性全脑缺血致认知功能障碍的状态下,大鼠海马CA1-3亚区中vGluT1和vGluT3的阳性神经元的数目明显降低,且CA1区较CA2,CA3区下降更加明显。同样,大鼠vAChT阳性神经元的数量在海马CA1-3亚区中表达也有明显降低。原因可能是随着脑缺血、缺氧或毒性、炎症反应程度的加重,海马各亚区神经元细胞逐渐发生坏死,不同海马亚区解剖及血管机制的差异使得CA1区神经元的数量较CA2及CA3亚区[14]明显降低,于是大鼠脑内信息流输入及输出出现偏差,近期记忆形成障碍,储存和提取功能缺损,最终出现认知功能障碍。通常认知功能的启动和维持不仅需要各脑区和神经核团的共同参与,还需要全脑神经的网络对所获信息进行全面处理、加工和整合,神经元之间,各脑区神经回路之间及神经网络之间的正常联系也是记忆产生的必要条件,而这些联系的产生通常依赖于突触的存在和完整性。突触一旦丢失,尤其是广泛丢失,信息就将无法进行传递,正常的记忆也随之丢失,于是出现认知功能障碍,且随着大脑缺血时间的延长,症状逐渐加重。
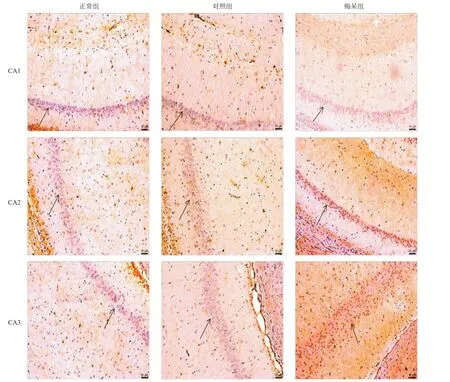
图6 3组大鼠海马CA1-3区中vAChT阳性神经元表达水平(免疫组织化学染色,×200)
谷氨酸胆碱能囊泡装运体功能的缺陷,谷氨酸中枢胆碱能递质之间的不平衡,海马CA1、CA2以及CA3信息环路的损坏是慢性全脑缺血大鼠认知功能障碍产生的主要原因。
