儿童氨基糖苷类药物性耳聋基因快速无创检测法的应用
2018-11-20张琼敏李斯斯陈君朱翌
张琼敏,李斯斯,陈君,朱翌
(1.温州医科大学附属第一医院 耳鼻咽喉科,浙江 温州 325015;2.深圳大学总医院 耳鼻咽喉科,广东 深圳 518000)
耳聋是困扰人类健康的一种常见疾病。全世界范围内每1 000名婴儿出生就有1~3名聋儿诞生[1]。根据2006年中国残疾人调查统计数据显示,我国听力言语残疾者已达2 780万,其中听力障碍儿童约13.9万,并且每年新生聋儿约3万人[2]。耳聋是儿童语言形成和发展的巨大障碍,严重影响了患儿身心健康发育。因此,在婴幼儿听力筛查的基础上开展耳聋基因检测来防治耳聋是至关重要的。遗传和环境是引起耳聋的两大主要因素[3]。80%的患者除耳聋外不伴有其他症状,称为非综合征型耳聋[4]。氨基糖苷类药物性耳聋是一种由氨基糖苷类抗生素如链霉素、庆大霉素引起的常见的非综合征型遗传性耳聋[5]。线粒体12S rRNA基因位点A1555G和C1494T突变是导致该类药物性耳聋最主要的遗传性基础。据文献报道在婴幼儿药物性耳聋患者群体中这两个突变位点的发生率约为11.5%[6]。该两个位点的快速有效检测对氨基糖苷类药物性耳聋具有重要的防治意义。目前采集患儿静脉血进行Sanger测序是检测基因突变的金标准[7]。该法技术成熟,准确率极高,但费时费力,且血液采集是一项侵入式操作,对婴幼儿造成一定程度的痛苦。为缩短检测周期并减轻患儿痛苦,本研究尝试采集患儿口腔黏膜拭子进行多重等位基因特异性PCR(multiplex allele-specific PCR,MAS-PCR)来检测A1555G和C1494T的突变,探索一种更为快速、无创的药物性耳聋基因检测方法。
1 对象和方法
1.1 对象 收集2015年5月至2017年5月温州医科大学附属第一医院耳鼻喉科门诊诊断为非综合征型感音神经性耳聋患儿共126例,男65例,女61例,年龄为2~15周岁。入选标准:经门诊确诊为非综合征型耳聋、年龄在2~15岁的儿童患者;排除标准:①综合征型耳聋患者;②有外耳及中耳先天性畸形及病变的患者(声导抗及耳声发射异常);③有全身性疾病及传染病的患者。每例患儿采集口腔黏膜拭子3根及静脉血3 mL,并接受听力学检查包括声导抗、耳声发射、测听[包括小儿电反应测听(2~3周岁)、小儿行为测听(3~6周岁)、纯音测听(6~15周岁)]等来判断是否符合入选标准及评估听力损伤程度。本研究经温州医科大学附属第一医院伦理委员会批准,患儿监护人均签署知情同意书。
1.2 方法
1.2.1 试剂与仪器:Universal Genomic DNA提取试剂盒、TakaRa ExTaq、TakaRa 100 bp plus marker DNA标记物、DMSO及质粒小量抽提盒;QIAamp DNA minikit(50)试剂盒购自德国QIAGEN生物公司,引物合成由大连宝生物工程有限公司完成,紫外分光光度计购自上海仪电科学仪器股份公司,PCR扩增仪购自美国BioRad公司,DYY-III-8B稳压稳流电泳仪购自北京六一仪器厂,紫外凝胶系统购自美国SynGene公司。
1.2.2 口腔黏膜拭子的采集及口腔脱落黏膜细胞DNA的提取:取普通医用棉签在患儿口腔颊部刮拭黏膜10次,力度适中,采集拭子3根,干燥处理后置入标本袋保存。用QIAamp DNA minikit试剂盒进行口腔黏膜脱落细胞的DNA提取,并用紫外分光光度计检测DNA的浓度及纯度。
1.2.3 MAS-PCR:将提取的口腔黏膜脱落细胞中微量的DNA进行MAS-PCR反应,PCR反应引物设计参考文献[8]。将引物分为2组:N组(C1、N1、N2、C2)和M组(C1、M1、M2、C2)。前者用于检测野生型A1555G/C1494T;后者用于检测突变型A1555G/C1494T。将微量DNA模板均分成2份,分别进行含N组引物的A管PCR反应和含M组引物的B管PCR反应。反应体系如下:总体积共25 μL,其中含50~100 ng DNA模板、8 pmol引物(M1、M2/Nl、N2)、4 pmol引物(Cl、C2)、1 U Taq酶、1.5 μL 4×d NTP(各0.0025 mol/L)、2.5 μL 10×PCR缓冲液、2.5 μL MgCl2(0.025 mol/L)、4 μL二甲基亚砜。PCR程序设定:94 ℃预变性5 min;94 ℃变性40 s,63 ℃退火40 s,72 ℃延伸30 s,10次循环(每次循环退火温度较上一循环降低1 ℃);94 ℃变性40 s,55 ℃退火30 s,72 ℃延伸30 s,共35~40次循环;最后72 ℃延伸5 min。将最终得到的PCR产物在2%浓度的琼脂糖凝胶中进行电泳,经溴化乙啶染色后用凝胶成像系统观察并记录结果。结果见表1。

表1 MAS-PCR琼脂糖凝胶电泳结果(bp)
1.2.4 直接测序法检测基因突变位点A1555G及C149AT:采集每位受检患儿静脉血3 mL,EDTA抗凝管保存,用Universal Genomic DNA提取试剂盒提取静脉血中DNA,将获得的DNA进行普通PCR扩增,将PCR产物送上海华大基因公司进行直接测序,测序结果用DNASTAR软件分析比对并记录结果。
1.3 统计学处理方法 采用SPSS19.0软件进行统计分析。口腔黏膜拭子来源DNA浓度、纯度与静脉血来源DNA浓度、纯度的比较采用两独立样本t检验。口腔拭子来源DNA经MAS-PCR的检出率与传统金标准法检出率的比较采用kappa一致性检验。当kappa≥0.75表示2种方法检出率一致性较好;当kappa<0.4表示两者一致性较差;kappa在0.4与0.75之间时表示两者一致性一般;P<0.01为差异有统计学意义。
2 结果
2.1 2种样本来源DNA浓度与纯度的比较 口腔黏膜拭子来源DNA的浓度与静脉血来源DNA浓度差异无统计学意义(P<0.05);口腔黏膜拭子来源DNA纯度较静脉血来源DNA小,差异有统计学意义(P<0.05)。见表2。
2.2 快速检测法检测结果 口腔黏膜拭子来源DNA进行MAS-PCR后经琼脂糖凝胶电泳快速诊断A1555G及C1494T突变情况(见图1),本研究126例感音神经性耳聋患儿中检测出A1555G突变者7例,C1494T突变者1例,检出率为6.35%。
2.3 快速检测法与传统金标准检测法检测结果的比较 静脉血来源DNA在通过传统金标准方法得到的结果显示:126例感音神经性耳聋患儿中检测出A1555G突变者7例,C1494T突变者1例,测序比对结果见图2,该法检出率为6.35%。2种方法检出率的一致性较好(kappa=1,P<0.01),并且2种方法检出的阳性标本为相同患者来源。
表2 口腔黏膜拭子来源DNA与静脉血来源DNA浓度及纯度的比较(

表2 口腔黏膜拭子来源DNA与静脉血来源DNA浓度及纯度的比较(
样本来源 n DNA浓度(µg/mL)DNA纯度(A260/A280)口腔黏膜拭子 126 50.6±23.4 1.70±0.15静脉血 126 52.5±22.8 1.80±0.12 t-5.73 -4.58 P<0.001 0.009
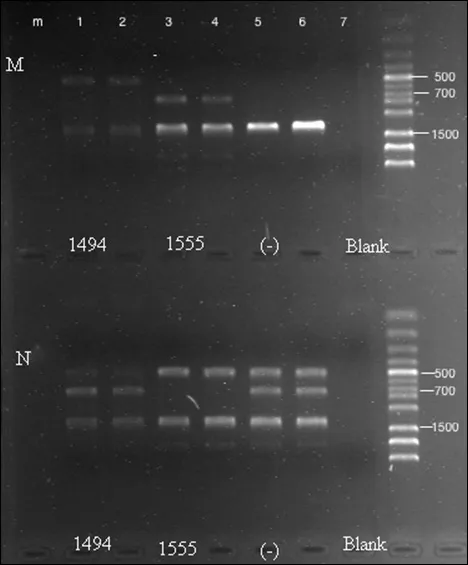
图1 MAS-PCR检测患儿药物性耳聋基因突变电泳图

图2 氨基糖苷类药物性耳聋患儿Sanger法基因测序结果
2.4 携带A1555G及C1494T位点突变患儿的临床资料回顾分析 对8例阳性结果患儿临床病史资料总结归纳后发现:7例携带A1555G突变患儿中,4例为男童,3例为女童;1例携带C1494T突变患儿为女童。他们均来自偏远欠发达地区,出生时通过了听力筛查,曾服用氨基糖苷类药物如链霉素、庆大霉素等,均为感音神经性耳聋,双耳听力损伤程度为重度到极重度。
3 讨论
随着全面二孩政策的实施,新生儿数量的增加,我国新生聋儿的数量也日渐增多,防治耳聋的任务愈显沉重。新生儿听力筛查已在我国各大医院普遍开展[9]。但一部分遗传性耳聋具有迟发性或者在环境因素如药物的影响下才出现[10],单纯的新生儿听力筛查无法筛出这部分患儿,这使得耳聋基因检测成为新生儿听力筛查的必要补充手段[11]。近年,线粒体基因12S rRNA上A1555G及C1494T位点突变引起的药物性耳聋成为研究热点[12-14]。这两个突变位点携带者在使用氨基糖苷类药物后会出现不可逆转的感音神经性耳聋[15]。如果对新生儿展开A1555G及C1494T位点的检测可很大程度上避免该类耳聋的发生[16],具有重大的防治意义。
目前临床上对A1555G及C1494T位点的检测主要是通过抽取患者静脉血,经DNA提取及PCR后将产物送生物公司进行Sanger测序来完成。该法准确性极高,但周期长,费用高[17]。另外抽血是一项有侵入性的操作,对患者尤其是婴幼儿造成了一定程度的痛苦。为了降低成本,减少痛苦,缩短检测周期,本课题组致力于药物性耳聋基因诊断中标本取材及检测方法两方面的探索。关于耳聋基因检测方法,近几年国内外在基因诊断技术方面不断地探索,先后出现了聚合酶链反应-限制性片段长度多态性、荧光定量PCR、高效液相色谱分析、高分辨率熔点曲线分析、质谱技术、基因芯片技术等等[18],各种不同的基因诊断技术各有其利弊。本课题组着眼于简便、快速、经济的优势,在SCRIMSHAW等[19]的A1555G突变检测方法和RODRÍGUEZ-BALLESTEROS等[20]的C1494T突变检测方法的基础上建立了可同时检测A1555G及C1494T突变位点的MAS-PCR技术,对静脉血来源的DNA可快速准确地判断A1555G及C1494T位点的突变情况。而本研究进一步尝试将口腔黏膜拭子来源的DNA进行MAS-PCR,探索简便、快速、无创的药物性耳聋基因诊断方法。采集汗液、唾液、精液来获得取微量DNA在法医领域司空见惯[21-23],临床上采用口腔黏膜拭子提供DNA来作为常规检测标本却并不多见。然而一部分特殊群体如婴幼儿、精神病患者等难以提供静脉血,此时无创的口腔黏膜拭子便可提供另一途径的标本取材[24]。人类口腔黏膜细胞为复层鳞状上皮细胞,具有更新快、易脱落的特点,刮拭口腔颊黏膜可获得大量脱落细胞。在本研究中单根口腔黏膜拭子大致可提供800~1 200 ng DNA量,大致与1 mL静脉血所提取的DNA含量相当。而口腔黏膜拭子来源DNA的纯度不及静脉血DNA,这是由于人类口腔中定植了大量的细菌、病毒等微生物。由此可见,口腔黏膜拭子DNA具有量少,纯度不高的特点。根据模板质量的不同MAS-PCR反应体系需调整其中的各影响因素及程序设定。比较前期已建立的MAS-PCR,本研究中以口腔黏膜拭子DNA为模板的PCR反应条件也随之产生变化。在反应体系中,我们在浓度阶梯式的试探后,适当地提高了引物浓度及DMSO浓度并降低了Taq酶、dNTP、及MgCl2的浓度。在程序设定中,我们增加了变性、退火、延伸的循环次数。反复多次调整后的MAS-PCR有了较高的特异性与稳定性,可较清晰地形成预判结果的条带。MAS-PCR在数小时内便可提供氨基糖苷类药物性耳聋相关位点A1555G及C1494T突变情况的诊断结果,较直接测序法大大地缩短了基因诊断周期,有着明显的时间效率优势。因此应用口腔黏膜拭子来源DNA进行多重等位基因特异性PCR可快速、无创、准确地检测药物性耳聋基因。
本研究对象为感音神经性耳聋的儿童患者,临床资料显示携带A1555G及C1494T突变位点的这部分患儿均有氨基糖苷类药物如庆大霉素、链霉素的用药史,而他们均通过了新生儿听力筛查。本研究探索的通过MAS-PCR检测口腔黏膜DNA药物性耳聋基因突变位点的方法正是对新生儿听力筛查的有力补充手段,对降低氨基糖苷类药物性耳聋发病率具有十分重要意义。
