多重实时荧光PCR快速检测转基因大豆及其加工产品
2018-11-19王凤军叶素丹包永华周晓红
王凤军 叶素丹 包永华 周晓红 凌 云
(浙江经贸职业技术学院,杭州 310018)
大豆是世界最主要的油料作物,是人类优质蛋白和油脂的主要来源,自20世纪60年代以来,世界大豆生产迅速发展[1]。2016年转基因大豆的播种面积高达9 140万公顷,占全球转基因作物总种植面积的一半[2-3]。从全球单个作物的种植面积来看,2016年转基因大豆的应用率为78%,高于转基因棉花、玉米和油菜的应用率。抗虫/耐除草剂大豆(IntactaTM)在2003—2015年的应用带来了24亿美元的经济效益,为全球74亿人口提供了可获得的粮食和营养[2]。从世界范围来看,大豆种植的集中度非常高,主要集中在北美洲的美国、南美洲的巴西和阿根廷、亚洲的和印度等少数几个国家。以上五个主产国大豆种植面积占全世界的85% ~90%,总占全世界的85% ~90%,单产高出世界平均水平5% ~10%[2]。
由于转基因大豆产品可能存在潜在的环境污染,食用安全及生态风险,对人类健康和自然环境带来不利影响,因此,需要加强对转基因大豆产品的有效监督、监测和管理[4]。欧盟、日本、韩国、挪威等国明确规定转基因产品的限量标准并制定相应法规实行转基因产品标签标识制度。我国农业转基因生物标识管理办法也对包括大豆在内的5大类17种市场流通的主要转基因农产品要求必须加贴标识[5]。而转基因生物标识管理制度必须以有效的外源基因检测技术为基础[6-7]。转基因大豆产品大量投放市场已经成为不可抗拒的潮流,建立适当的方法对转基因大豆产品进行检测就显得尤为重要。如蔡颖等[8]使用LAMP检测方法对转基因大豆A5547-127品系成分进行鉴定;芦春斌等[9]使用普通定性PCR对广州市农贸市场中转基因大豆进行检测;吴影等[10]使用实时荧光PCR技术对转基因大豆进行定量筛查检测和品系鉴定。但这些方法检测范围窄,效率低,迫切需要开发高通量的快速转基因检测技术。
多重实时荧光PCR技术(Real-time Quantita-tive PCR Detection System)是指在PCR反应体系中加入序列特异性的多个荧光探针,探针根据靶序列设计,5’端含有不同波长的报告荧光基团,3’端含有非荧光的猝灭基团,与扩增的靶序列特异性结合。Taq酶的外切核酸酶活性将探针的荧光报告基团与淬灭基团相分离,发出荧光信号,使荧光信号的积累与扩增产物的形成完全同步。在实验设计过程中,不同探针可以用不同报告基团(不同颜色的荧光信号)标记,实现在一个反应体系中同时对多个靶标基因的定性、定量检测,且相互间无信号干扰[11-12]。如Koppel等开发了可同时检测启动子和终止子的二重实时荧光PCR筛查检测转基因产品[13-14]。本课题组前期也建立了可同时检测番茄内源基因和三个外源基因的四重实时荧光PCR方法,可实现对转基因番茄产品的高效准确检测[15]。
本实验通过提取样品核酸,检索与筛选外源靶标基因,设计与验证特异性引物及多重荧光探针,优化反应条件和反应体系,分析特异性、重复性和灵敏性等,开发建立了可同时检测内源基因Lectin和外源基因CaMV35S、nos的多重荧光定量PCR检测技术。本方法的建立将对大豆及其深加工制品中转基因成分的全程监测和快速监控,确保食品安全有重要意义。
1 材料与方法
1.1 材料
转基因阳性样品:CNAS T025-24转基因大豆粉(辽宁出入境检验检疫局技术中心组织的PTCT025能力验证),FAPAS GeMSU 56A/56B转基因玉米粉(英国FAPAS组织GeMSU 56能力验证),CNAS T0659-23/79/104/175转基因大豆粉(沈阳产品质量监督检验研究院组织的CNAS T0659能力验证),3%Bt11、5%MON810、10%MON863 转基因玉米标准品和10%Roundup Ready转基因大豆、转基因棉花标准品:深圳安莱尔科技公司。
转基因阴性样品:CNAS T025-30非转基因大豆粉(辽宁出入境检验检疫局技术中心组织的PTC-T025能力验证)、CNAS T0659-74非转基因大豆粉(沈阳产品质量监督检验研究院组织的CNAS T0659能力验证)。经验证为转基因阴性的9份豆腐、5袋豆奶粉、9袋豆奶、9份素鸡、1份腐乳、1瓶大豆蛋白粉样品均购于杭州市农贸市场。
1.2 试剂与设备
基因组DNA提取试剂盒(Koning)和AceTaq®DNA聚合酶(Vazyme)分别购自于杭州百迈生物股份有限公司和南京诺唯赞生物科技公司;探针与引物委托美国Invitrogen公司合成;ABI7500实时荧光定量PCR仪;ND2000C核酸蛋白分析仪。
1.3 方法
1.3.1 基因组DNA的提取
称取干重样品(如豆奶粉)40 mg或湿重样品(如豆腐、素鸡、腐乳)150 mg,豆奶取1 mL离心后留沉淀物,按照Qiagen(69104)植物DNA提取试剂盒说明书进行操作。大豆蛋白粉使用德国Congen Sure-Food PREP Plant X(S1006)进行提取,加入50 μL灭菌双重蒸馏水洗脱2次。用核酸蛋白分析仪检测DNA提取的纯度和浓度并计算拷贝数。
1.3.2 引物和探针设计
通过上海交通大学的转基因数据库(http://ncmcg.sjtu.edu.cn) 等转基因数据库(http://www.cera-gmc.org),比较分析商品化生产的转基因大豆外源基因信息。比较分析发现,这些转基因大豆品种大多采用CaMV35S启动子和nos终止子为调控元件。选定常用的CaMV35S和nos为靶标外源基因。在NCBI网页检索大豆单拷贝内源基因Lectin序列和CaMV35S启动子和nos终止子,使用Primer Express 3.0软件设计多重引物和荧光探针。探针分别使用荧光基团VIC、FAM和Cy5作为发光基团,使用BHQ和MGB作为非荧光淬灭基团。在DNAstar软件上评价引物和探针的特异性,在 BLAST 网页(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上比对扩增产物的特异性。
1.3.3 单重荧光PCR反应
在200 μL光学PCR反应管中依次加入:灭菌蒸馏水14.75 μL、10 ×PCR Buffer 2.5 μL、dNTP(10 mmol/L each)0.5 μL、引物(10 μmol/L)0.4 μL、探针(10 μmol/L)0.2 μL、5 U/μL Taq DNA 聚合酶 0.25 μL 和DNA模板1 μL,反应混合液在实时荧光PCR仪中进行扩增。反应条件设置为95℃预变性15 s;95℃变性15 s,60℃退火延伸1 min,进行40个循环。定量中设置重复实验和阴性对照实验,阴性对照中不加模板DNA,而以灭菌蒸馏水代替,用于检验是否存在PCR污染和较高的引物二聚体污染。
1.3.4 多重荧光PCR反应
20 μL多重荧光定量PCR反应体系中包括3组检测引物和探针,Taq酶,dNTP,基因组DNA等成分(具体见表1),荧光定量PCR扩增条件同1.3.3。设置三个复孔的重复和非模板空白对照。实验结果应用ABI 7500 software v2.3进行分析处理。

表1 多重荧光定量PCR的反应混合液组成
1.3.5 重复性和特异性检测
提取CNAS T0659-104转基因大豆样本以及CNAS T0659-74非转基因大豆样本基因组DNA,使用上述多重荧光定量PCR体系进行转基因成分检测,验证方法的特异性。
1.3.6 灵敏性检测
提取10%Roundup Ready转基因大豆样本基因组DNA,按照10倍浓度稀释5个梯度,稀释介质为基因组DNA提取时所用的洗脱液。根据大豆的单倍体基因组分子质量约为1.15×10-12g。稀释后标准品每个反应分别为 24 000、2 400、240、24、2.4拷贝。对5个梯度的标准品进行实时荧光定量反应,每个浓度设置3个重复,验证方法的灵敏性。以拷贝数的自然对数值为横坐标,以Ct值为纵坐标做内源基因Lectin和外源基因CaMV35S和nos的标准曲线。
1.3.7 样本检测
采用大豆转基因成分多重荧光定量PCR检测方法分别对大豆深加工产品和市场上购买的流通产品进行检测。同时对实验室收集的转基因玉米、大豆、棉花等转基因标准品,以及中国合格评定国家认可委员会(CNAS)组织的能力验证样品进行检测,验证方法的适用性。
2 结果与分析
2.1 样品DNA提取结果
按1.3.1方法提取的基因组DNA 260/280 nm OD 比值大多为1.7~1.9,0.7%琼脂糖凝胶电泳检测条带清晰,完整性好,经测试其含量为190~220 ng/L,纯度良好,统一稀释成100 ng/L,可满足后续实验要求。
2.2 引物和探针特异性检测
按照1.3.2中的方法针对转基因大豆常用的CaMV35S启动子和nos终止子、内源基因Lectin各设计2-3对引物和探针,然后测试引物和探针扩增情况,选出特异性好的引物和探针用于后续实验。筛选的引物和探针信息见表2。

表2 转基因大豆特异性检测的引物和探针序列
2.3 特异性检测结果
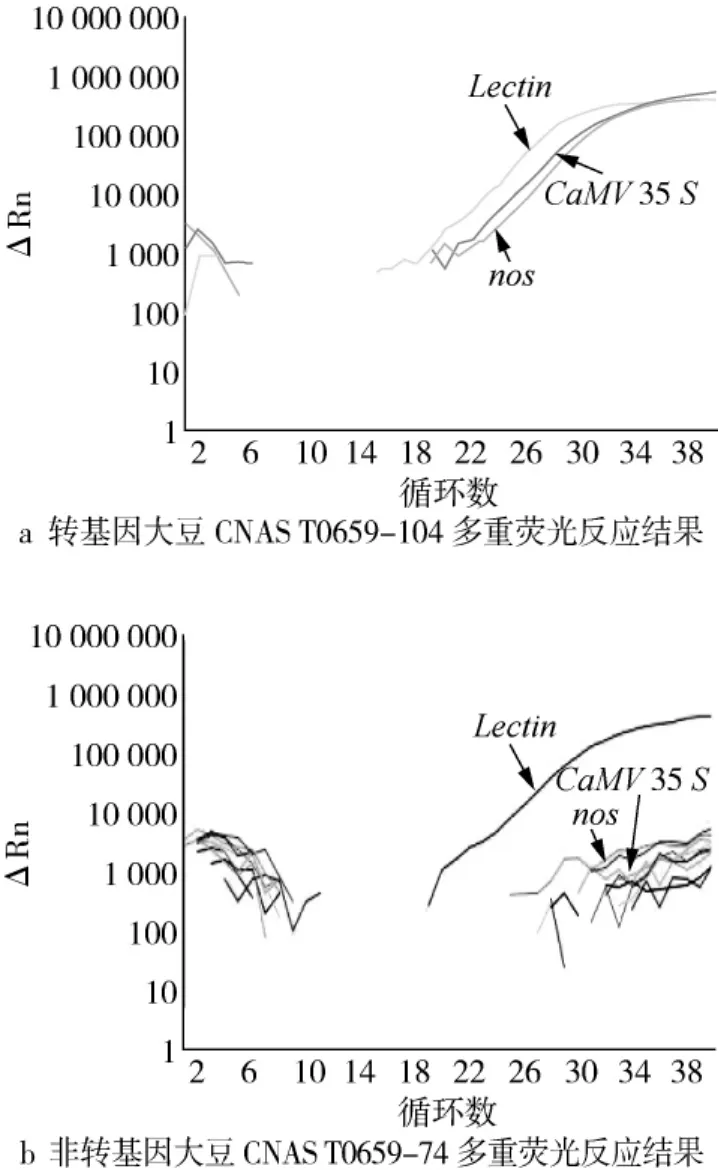
图1 不同基因多重荧光PCR反应的扩增曲线图
提取转基因大豆CNAS T0659-104和非转基因大豆CNAS T0659-74样本基因组DNA,使用上述多重荧光定量PCR体系进行转基因成分检测,验证方法的特异性。图1为转基因大豆CNAS T0659-104和非转基因大豆CNAS T0659-74多重反应的结果,内源基因Lectin均产生了明显的S型扩增曲线,Ct值小于临界值。外源基因CaMV35S和nos在转基因大豆中检出,且扩增曲线呈现明显的S型,而非转基因大豆中不检出,空白对照无信号,检测基因之间无信号干扰,外源基因的反应结果与期望结果一致,表明引物探针的设计及反应体系的设置具有特异性,可用于大豆转基因成分的筛查检测。
2.4 重复性和灵敏性检测
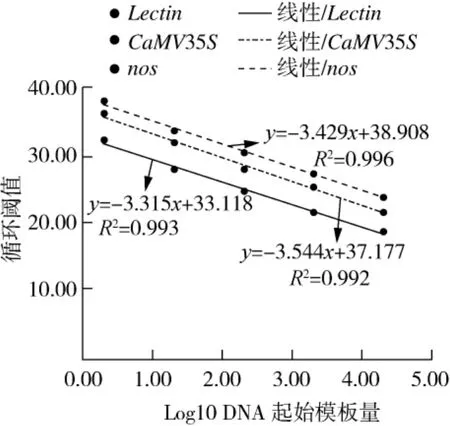
图2 不同基因多重荧光PCR反应的标准曲线图
由梯度稀释的DNA扩增的标准曲线(图2),得出 R2为0.992 ~0.996。对 Ct值统计分析(表 3),同一参照样品重复间Ct值变异较小,Lectin基因Ct值变化范围在 19.00~32.90之间,标准偏差在0.066 ~0.477,R2为0.993,扩增效率为 101%;外源基因CaMV35S的 Ct值变化范围在21.57~36.89,标准偏差在 0.237 ~0.547,R2为 0.992,扩增效率为91%;外源基因nos的 Ct值变化范围在23.76~38.78,标准偏差在 0.065 ~0.510,R2为 0.996,扩增效率为96%,表明该方法具有较好的重复性和稳定性,使用该多重荧光定量PCR检测大豆转基因成分的最低检测限为每20 μL反应2.4个拷贝,最低定量限为每20 μL反应24个拷贝。
2.5 样品检测结果
对市场上购买的流通产品共34个批次进行检测。同时对实验室收集的转基因玉米、大豆、棉花等转基因标准品,以及中国合格评定国家认可委员会(CNAS)和英国FAPAS分析实验室组织的能力验证样品进行检测。结果见表4。同时按照标准SN/T 1204—2003中所述的引物和探针以及荧光定量PCR方法对上述检测结果进行验证[16],结果多重荧光PCR方法与标准确定的方法的检测结果一致,表明本实验研究开发的多重荧光PCR反应体系对大豆转基因成分筛查检测的适用性较高,可用于大豆及其深加工制品的转基因成分的快速检测。

表3 转基因大豆多重荧光定量PCR灵敏性检测Ct值分析表
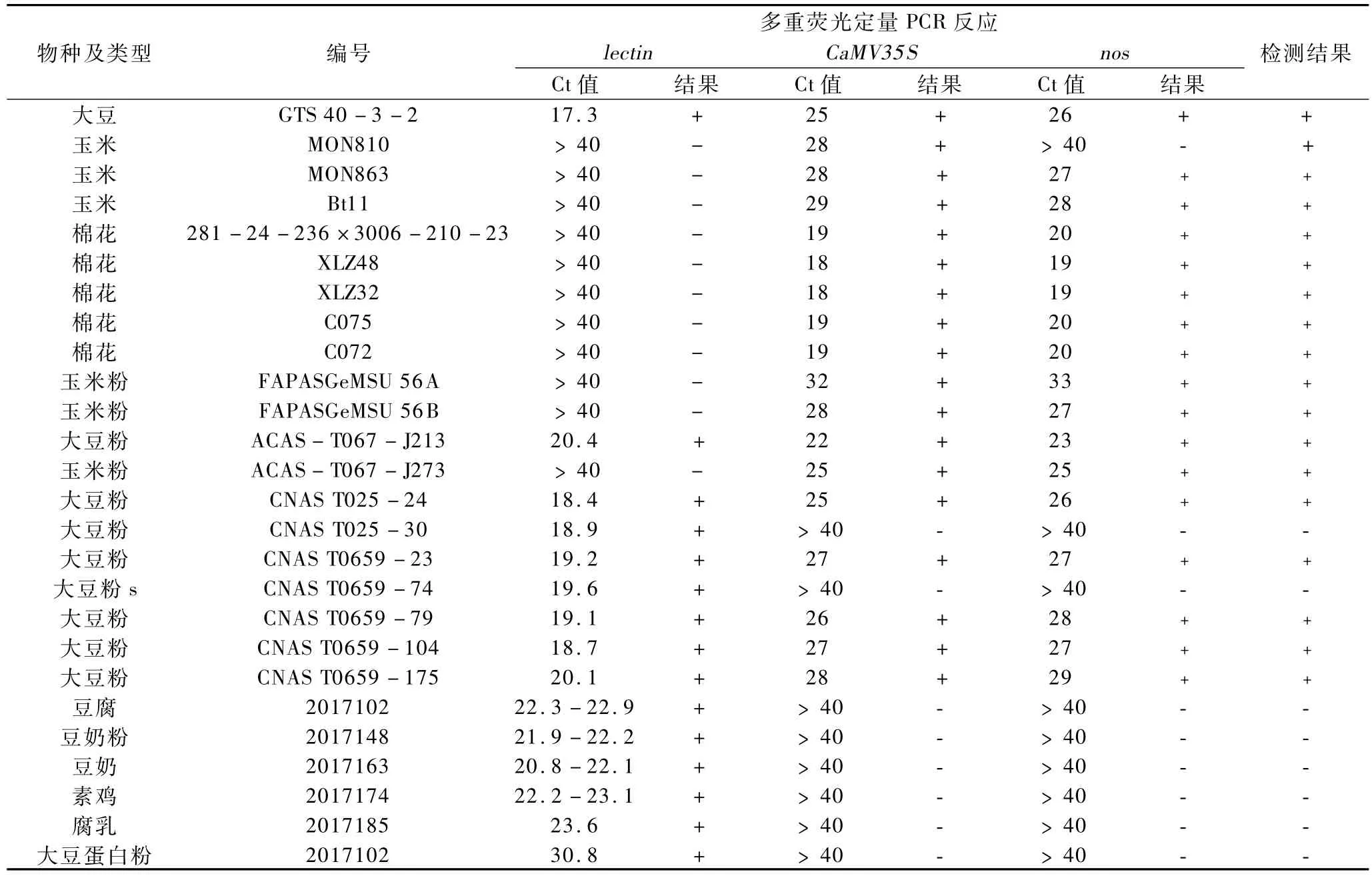
表4 多重荧光定量PCR反应对转基因大豆、玉米、棉花标准品和CNAS/FAPAS能力验证样品的筛查检测结果
3 讨论
设计多重荧光PCR的荧光探针最好为同一类型:如同时为Taqman探针或同时为MGB探针、或同时为Beacon探针。但目前商品化的VIC和NED荧光探针仅以MGB标记,故本实验使用了两条Taqman探针和一条MGB探针。MGB探针较短(14~20 bp),容易找到所有排序序列的较短片段的保守区,而且加上MGB后,Tm值将提高10℃,更容易达到荧光探针Tm值的要求。
由于目前不同荧光定量PCR仪的原理和提供的检测光谱范围的差异,因此在选择探针的发光基团和淬灭基团时要在所用仪器型号设置的荧光信号范围内选择,本实验使用ABI 7500荧光定量PCR仪,共设置5个检测通道,有五色光源滤光片结合荧光滤光片组成的滤光系统。本实验根据发射光谱范围选择 FAM(522 nm)标记 CaMV35S,VIC(553 nm)标记 Lectin,Cy5(666 nm)标记 nos,3’端以BHQ或MGB为非荧光淬灭标记。
为了能够在同一反应管中检测3个靶标基因,并保持较高的反应效率,需对反应体系和条件进行优化。主要优化的参数有退火温度、引物和探针浓度、模板浓度以及扩增试剂的用量等,通过退火温度梯度实验,确定了该多重荧光定量PCR反应的最佳退火温度为60℃,通过十字交叉法和荧光标记的强弱与荧光信号之间的关系进行了引物和探针浓度优化,最终确定了最佳引物和探针浓度。
多重荧光定量PCR法融合了PCR的灵敏性和光谱技术定量精确的优点,特异性强、敏感度高,操作方便、快速,整个扩增和产物分析过程均在密封单管内完成。不需电泳和紫外或染色观察,并通过微机控制,实现了对 PCR扩增产物进行实时动态检测和自动分析结果。不需要对阳性对照、阴性对照、空白对照和待检样本分别进行内外源基因反应管的检测,可实现一管多检,提高了检测的通量性和可操作性。为确保该方法相对于实时荧光PCR,LAMP检测方法和普通定性PCR检测方法有较大优越性,各方法对比分析如表5所示。
本实验建立的多重荧光PCR技术可同时对CaMV35S和nos两个外源基因进行检测,为保证方法的准确性,通过了特异性、重复性和灵敏性的验证,确保了该方法在同时检测两个靶标基因时,无荧光信号的相互干扰,不会出现假阳性结果;多重扩增体系中设置了内源基因的检测,可以判断核酸提取和扩增反应的有效性,避免出现假阴性反应结果。

表5 多重荧光定量PCR技术、实时荧光PCR技术,LAMP检测方法和普通定性PCR检测方法的对比分析
4 结论
通过对比优化实验,摸索出多重荧光定量PCR检测的最佳反应体系:95℃预变性5 min;95℃变性30 s,60℃退火并延伸1 min,40个循环,扩增效率在90%~110%之间。通过梯度标准品稀释建立的标准曲线相关系数R2≥0.98,确定了最低检测限为每20 μL反应2.4个拷贝,最低定量限为每20 μL 反应24个拷贝。该多重荧光PCR技术可以实现一管多检的实际需要,降低试剂成本,缩短检测时间,为大豆及其深加工产品转基因成分的快速检测提供了有效方法,为促进农产品和食品出口提供技术保障。
