前列腺癌超声造影低增强结节的病理学基础探索
2018-11-19赵云歆姚广力梅将军俞家顺
赵云歆,江 怡,姚 敏,王 健,王 颖,姚广力,梅将军,俞家顺
1. 上海市浦东新区浦南医院超声科,上海 200125;2. 上海市浦东新区浦南医院病理科,上海 200125;3. 上海市浦东新区浦南医院泌尿科,上海 200125
约70%前列腺癌(prostate cancer)起源于外腺[1],发病率高,不易早期诊断,严重影响老年人群的生命健康。研究发现,相比于正常前列腺组织,前列腺癌组织中血管生成明显增多[2]。超声造影诊断前列腺癌并指导前列腺穿刺活检已成为研究热点。在实践中发现,超声造影显示前列腺癌结节除呈高增强外,部分可呈低增强或不均匀增强。目前,对前列腺癌结节在超声造影上出现低增强或不均匀增强现象的病理学基础尚无一致意见[3]。本研究拟采用CD34免疫组织化学法,比较前列腺外腺癌结节超声造影高增强组与低增强/不均匀增强组的血管密度,探索前列腺癌超声造影低增强结节的病理基础,同时研究前列腺癌血管密度与Gleason评分的相关性。
1 资料和方法
1.1 一般资料
选取2015年10月—2018年2月上海市浦东新区浦南医院门诊及住院,经直肠超声造影有异常发现的前列腺外腺结节,且病理证实为前列腺癌的48例患者,年龄54~87岁,平均为(65.5±6.4)岁。
本研究经医院伦理委员会批准同意,超声造影和穿刺活检前每位患者均签署知情同意书。
1.2 仪器
美国GE公司生产的LOGIQ E9型彩超仪,宽频IC5-9-D腔内探头,探头频率5~9 MHz(经直肠前列腺超声造影:增益21,机械指数0.13),配备造影谐波成像技术。日本东芝公司生产的Aplio 500型彩超仪,宽频PVT-781VT腔内探头,探头频率3~11 MHz(经直肠前列腺超声造影:增益78,机械指数0.08),配备造影谐波成像技术。配有专用金属穿刺引导架,18G BARD一次性全自动活检枪。
1.3 试剂
超声造影剂SonoVue(意大利Bracco公司)主要成分为六氟化硫(SF6)微泡。一支造影剂(剂量为59 mg)加入5 mL 0.9% NaCl溶液,剧烈振荡,配成混悬液。
1.4 方法
1.4.1 超声造影及前列腺穿刺活检
穿刺前做好直肠清洁准备,患者以左侧卧位躺于检查床上,露出臀部,两腿蜷曲,用乳胶套包裹探头后将探头轻缓放进肛门进行检查,对前列腺外腺可疑结节行超声造影。将超声造影剂混悬液2.4 mL经左肘部浅静脉团注,随后注入5 mL 0.9%NaCl溶液,观察前列腺外腺可疑结节区造影剂增强情况,确定穿刺部位。以周围正常前列腺组织为参照,根据前列腺癌结节增强强度,分为高增强组和低增强组,高增强组为整体增强,低增强组包括低增强和不均匀增强。
采用6+X穿刺法取材,穿刺和超声造影处于相同切面水平,对可疑结节相应增加穿刺针数(1~2针)。将每一条活检标本置于已标记部位的玻璃瓶内,用10%甲醛溶液固定,进行病理常规检查,对入选对象进行CD34免疫组织化学染色。
1.4.2 免疫组织化学法
选取活检石蜡标本,以4 µm厚度切片,脱蜡,水化,H-E染色。应用单克隆抗体CD34对所有标本行免疫组织化学染色,采用EnVision二步法[4]。
1.4.3 血管密度值计算
CD34染色阳性的各级血管(包括单个内皮细胞或一簇内皮细胞作为1个微血管),排除边缘反应区,在高倍视野下(×400)计数3~5个血管密度最高的癌灶区域(热点)血管数目,平均值即为癌灶活检组织的血管密度值(血管/HP)。CD34免疫组织化学染色结果中,大于35个血管/HP为富血管, 0~35个血管/HP为少血管[5]。
1.4.4 Gleason分值
将48例前列腺癌根据Gleason分值高低,分为Gleason低分值组(Gleason评分≤3+4) 和Gleason高分值组(Gleason评分≥4+3)[6]。
1.5 统计学处理
2 结 果
2.1 超声造影表现
48例前列腺外腺癌患者中,超声造影呈高增强结节36例(占75%);低增强/不均匀增强结节12例(占25%),其中低增强结节9例,不均匀增强结节3例。
超声造影高增强结节以富血管为主(图1),高增强组富血管例数占比高于低增强/不均匀增强组,差异有统计学意义(P=0.017);高增强组Gleason高分值例数占比高于低增强/不均匀增强组,但差异无统计学意义(P=0.061)。结果详见表1。
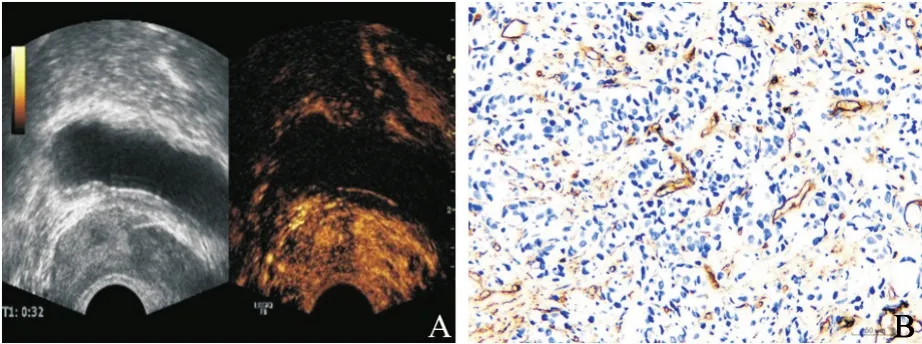
图1 高增强结节前列腺癌超声造影和CD34免疫组织化学染色
前列腺癌Gleason高分值组血管密度高于Gleason低分值组,差异有统计学意义(P=0.046)。结果详见表2。
9例低增强结节中5例(55.6%)表现为富血管,3例不均匀增强结节中2例(66.7%)表现为血管丰富。结果详见表3。
2.2 低增强和不均匀增强前列腺癌结节的病理学检查及CD34免疫组织化学染色分析
9例低增强结节中,2例肿瘤细胞以大腺泡结构为主(图2),2例肿瘤细胞排列以筛孔状腺腔为主,间质均较少,血管数量少,所以超声造影呈低增强,Gleason评分均≤3+4。3例呈富血管结节(图3),但血管管腔小,部分呈闭合状、芽状及裂隙状,或由单个细胞围成,Gleason评分均≥4+3。2例血管较多,但血管呈灶性分布,少部分血管开放,大部分血管闭合, Gleason评分均≤3+4。
3例不均匀增强结节中,2例富血管,血管呈灶性分布,且其中部分血管开放,部分血管闭合,Gleason评分均≥4+3。1例少血管,结节内有灶性坏死(图4),间质水肿,Gleason分值最高,达5+5=10。

表1 前列腺癌结节超声造影不同增强强度组的组织血管密度和Gleason评分的比较
表2 不同 Gleason评分前列腺癌结节组织血管密度比较
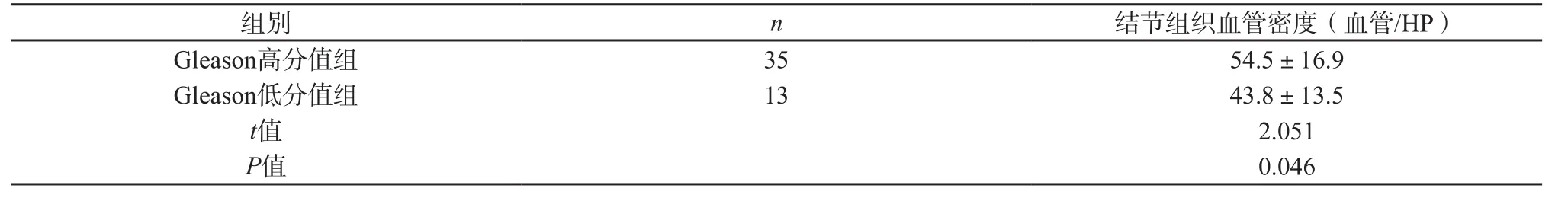
表2 不同 Gleason评分前列腺癌结节组织血管密度比较
?

表3 低增强与不均匀增强前列腺癌结节组织病理学特征分析表(n)
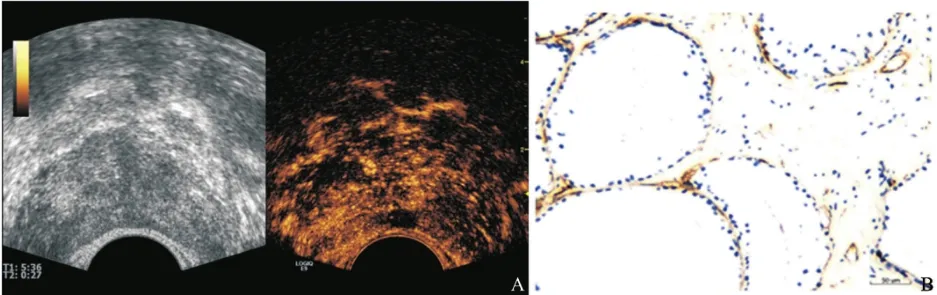
图2 低增强前列腺癌结节超声造影和CD34免疫组织化学染色(一)
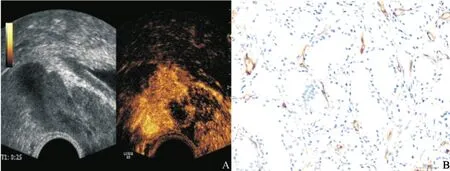
图3 低增强前列腺癌结节超声造影和CD34免疫组织化学染色(二)

图4 不均匀增强前列腺癌结节超声造影、CD34免疫组织化学染色和H-E染色
3 讨 论
前列腺癌结节的超声造影增强强度与其内血流灌注有关。Kay等[2]研究认为,前列腺癌组织比正常前列腺组织的血管生成水平高得多,而且随着肿瘤分化程度降低,其组织内微血管生成增多,血供丰富程度增大,这是前列腺癌结节超声造影呈高增强的形成机制。前列腺癌结节超声造影除通常看到的呈高增强外,部分也会呈低增强/不均匀增强,原因尚存争议[3]。Trojan等[7]研究认为,CD34免疫组织化学染色适用于观察前列腺良恶性组织血管密度。本研究针对超声造影呈低增强/不均匀增强的前列腺癌结节,观察结节内CD34免疫组织化学染色的程度变化,探讨其病理学基础。
本研究结果显示,前列腺癌超声造影呈高增强的结节,以富血管为主。Gleason高分值组血管密度高于Gleason低分值组,差异有统计学意义(P<0.05),与文献报道Gleason分值较高的前列腺癌血管密度较高相符[8]。高增强组Gleason高分值例数占比高于低增强/不均匀增强组,但差异无统计学意义(P = 0.061),表明前列腺癌结节是否增强与Gleason分值高低的相关性不密切。但本研究中低增强/不均匀增强结节组病例数较少,需要积累病例进一步证明。
本研究病理学检查显示,9例超声造影呈低增强的前列腺癌结节中,2例肿瘤细胞以大腺泡结构为主,2例肿瘤细胞排列以筛孔状腺腔为主,间质均较少,血管数量少,所以超声造影呈低增强,Gleason评分均≤3+4。尽管其中3例低增强癌结节呈现富血管的病理学表现,但血管管腔细小,甚至部分呈闭合状、芽状及裂隙状,或由单个细胞围成,提示可能是由于仅部分血管有血流灌注而造成超声造影呈低增强的表现,此3例患者Gleason评分均≥4+3。2例富血管结节,血管呈灶性分布,少部分血管开放,大部分血管闭合,Gleason评分均≤3+4。1例少血管不均匀增强癌结节,结节组织内有灶性坏死,Gleason分值高达5+5=10。前列腺癌很少伴有出血、坏死及溃疡形成等恶性肿瘤常见的大体病理改变[9],可能伴出血、坏死及溃疡的前列腺癌其分化程度更低。
本组超声造影呈低增强/不均匀增强的前列腺癌结节,并非都呈少血管的病理学改变,一部分为少血管结节,另一部分虽然病理基础为富血管结节,但结节内血管发育程度低和血管未开放等原因造成超声造影呈低增强和不均匀增强;极少数原因可能是前列腺癌结节伴出血、坏死,而伴出血、坏死的前列腺癌结节的Gleason分值高,分化程度低。因此,不能仅靠超声造影增强强度评估低增强/不均匀增强前列腺癌结节的恶性程度。
综上所述,前列腺癌超声造影呈高增强的结节多富血管。低增强/不均匀增强结节部分为少血管结节,部分为富血管结节,富血管结节呈低增强可能与血管发育程度低、血管未开放有关[8,10]。极少数低增强/不均匀增强可能与前列腺癌组织出血、坏死有关。由于本研究所取组织为穿刺活检组织,尚不能完全反映前列腺癌结节全貌,如果能得到根治术后完整的癌结节标本,将更具有说服力;本组病例数也不够多,需积累更多病例资料以进一步证实。
