动态增强MRI在乳腺癌保乳手术中的应用价值
2018-11-19罗娅红
赵 丹,罗娅红
中国医科大学肿瘤医院,辽宁省肿瘤医院医学影像科,辽宁 沈阳 110042
我国乳腺癌的发病率及死亡率逐年增加,仅2012年全国乳腺癌发病187 213例,死亡47 984例[1]。面对如此严峻的形势,早诊断早治疗是关键。随着人们健康意识的加强及检查技术的不断进步,早期乳腺癌的检出率不断提高,使得更多乳腺癌患者获得了保乳手术的机会,从“根治性、扩大性”治疗模式转变为更注重生活质量的“微创型”保乳手术治疗模式。
保乳术前的评估依赖各种医学影像学检查手段,特别是增强磁共振成像(magnetic resonance imaging,MRI)检查越来越广泛地应用于临床乳腺疾病诊断以来,其更高的检测灵敏度、对多中心病变较高的检出率及对乳腺癌更为准确的术前分期,使其日益受到临床医师的青睐。本研究对行保乳手术的乳腺癌患者的病变影像进行术前评价,对比临床及病理学参数,探讨动态增强MRI检查在乳腺癌保乳手术中的应用价值。
1 资料和方法
1.1 临床资料
选取2008年1月—2014年12月辽宁省肿瘤医院乳腺科收治的行保乳手术的乳腺癌患者54例,均为女性,中位年龄48岁。所有患者术前均行动态增强MRI检查,同时行X线摄影及超声检查。
1.2 检查方法与图像分析
动态增强MRI检查采用1.5 T HD MRI机,Vibrant 8通道胸部阵列线圈。患者取俯卧位,双侧乳房自然悬垂于洞穴内。行常规双侧乳腺矢状位FSE T2WI脂肪抑脂序列和轴位STIR序列扫描。扫描参数:L/R-sag FSE T2WI(抑脂),重复时间(repetition time,TR)/回波时间(echo time,TE)=4 640 ms/85.0 ms,层厚5 mm,视野(field of view,FOV)20 cm,层间距1 mm;OAX STIR TR/TE=6 000 ms/48.2 ms,反转时间(inversion time,TI)=150 ms,层厚5 mm,FOV 32 cm,层间距1 mm。本组患者均采用Vibrant技术行双侧乳腺无间距连续动态增强扫描。扫描参数为:TR=6.1 ms,TE=2.9 ms,TI=13.0 ms,层厚3 mm,FOV 36 cm。连续动态扫描8个时相。
在ADW 4.3型图像工作站,采用Functool功能软件绘制病灶感兴趣区的时间-信号强度曲线。由2名诊断医师联合阅片,对MRI平扫及增强影像上病灶的数量、大小、位置、形态、边缘情况及强化类型进行分析。
乳腺X线摄影使用全数字化乳腺钼铑双靶X线机。常规行双侧乳腺头尾位(craniocaudal,CC)和内外侧斜位(mediolateral oblique,MLO)摄影,必要时加摄切线位和局部放大相,由2名诊断医师联合阅片及乳腺查体。
乳腺彩色多普勒超声检查使用Logiq 9彩色超声诊断仪,探头频率10~12 MHz。重点观察病灶的数量、位置、大小、形态及血流动力学改变等。
1.3 病理学检查
本组患者术后均取得相应乳腺癌大体标本,记录病灶的数目、大小、位置、形态和淋巴结等,显微镜下观察乳腺癌病灶的分化程度。免疫组织化学结果采用专人单盲阅片,观察c-erbB-2(HER-2)的表达情况。
1.4 统计学处理
使用SPSS 21.0软件进行数据分析。符合正态分布的计量资料以表示,两变量采用线性相关分析,对多个独立样本频率分布的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 动态增强MRI在保乳术前对病灶的检出及定位情况
手术病理发现54个病灶。各象限分布:外上象限31个,外下象限5个,内上象限15个,内下象限3个。与病理结果相对照,动态增强MRI和X线摄影对病灶的检出及定位情况见表1。结果显示,动态增强MRI对病灶的检出率为100%,乳腺X线摄影的检出率为83.33%,动态增强MRI对病灶的定位与病理学检查结果完全符合。
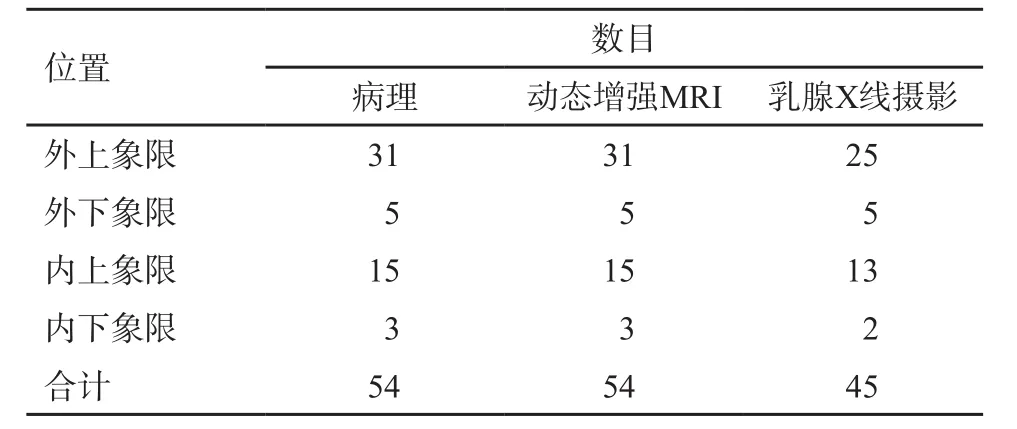
表1 动态增强MRI和X线摄影检查对病灶的检出及定位情况
2.2 动态增强MRI对病灶大小的判定
以病理学检查所测肿瘤最大径作为病灶大小的标准,将动态增强MRI与乳腺超声检查测量病灶的最大径分别与病理学检查结果进行对照(表2)。结果显示,动态增强MRI的测量值与病理学测量值之间具有一致性(P<0.05,图1)。

表2 动态增强MRI和U超声测量病灶的最大径与病理结果对照
图1 动态增强MRI测量病灶大小
2.3 病灶强化类型与分化程度及c-erbB-2表达的关系
本组患者病理学检查发现病灶的分化程度如下:低分化16例,中分化21例,高分化17例。动态增强MRI显示的病灶强化类型与病理分化程度及c-erbB-2表达之间的对照见表3。结果显示,不同强化类型的病灶病理类型分布差异有统计学意义(χ2=40.760,P<0.001),不均匀强化的病灶多为低分化癌(13/19);不同强化类型的病灶c-erbB-2分布差异无统计学意义(χ2=1.418,P=0.492)。
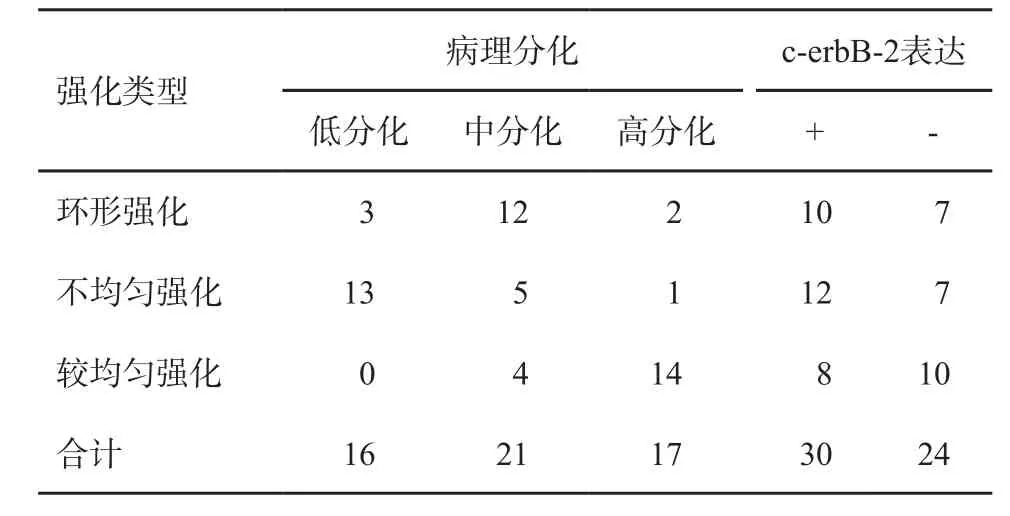
表3 病灶强化类型与病理分化程度及c-erbB-2表达之间的对照
3 讨 论
本研究中,动态增强MRI对病灶检出率为100%。回顾性分析发现,对于致密型乳腺中的小病灶,乳腺X线摄影易漏诊,而动态增强MRI对小病灶的检出具有较高的灵敏度。乳腺癌病灶内富含供血微小动脉和大量动静脉短路,是增强MRI诊断乳腺癌的病理生理基础,动态增强MRI及三维最大密度投影重建可以很好地显示病灶的血供情况[3]。本研究采用的Vibrant乳腺动态增强扫描技术,弥补了传统动态增强检查的不足,能够得到统一的均匀的脂肪抑制图像,使病灶得以更清楚地显示[4]。与此同时,动态增强MRI还能发现多发灶及多中心病灶,更好地显示病灶与周围组织的关系。然而,乳腺X线摄影对微小钙化灶的显示具有较高的灵敏度,Fischer等[5]报道全数字化乳腺X线摄影对簇状微小钙化的灵敏度为95%。因此,对于以钙化形式存在的局灶性的小的导管原位癌,乳腺X线摄影检查非常重要,尤其在乳腺癌早期筛查中是必要手段。
保乳术前对病灶的定位至关重要。本研究显示,动态增强MRI对病灶的定位与病理学检查结果完全符合。其中X线摄影定位在外上象限中的4例,病理学定位在外下象限;定位在外下象限中的4例,病理学定位在外上象限;定位在内上象限中的2例,病理学定位在内下象限;定位在内下象限中的1例,病理学定位在内上象限。通过分析,发现距离乳腺中央区较近的病灶会显示在乳腺X线摄影图像上,位置有所差异。乳腺X线摄影MLO摆位时,会将乳腺向外上方推挤,使得整个腺体及胸大肌前缘暴露于观察视野范围内,这样乳腺中央区周围的病灶在外力作用下位置有所移动,特别是对于较大的乳房。与乳腺X线摄影相比,动态增强MRI检查时乳房自然悬垂于专用线圈内,不受外力影响,且动态增强MRI能够在三维成像上很好地显示病灶的位置,为保乳手术及整复术提供精准的术前定位。
乳腺癌病灶的大小是决定能否采用保乳手术方式的关键因素。本研究显示,动态增强MRI对病灶大小的测量值与术后病理学测量值之间具有一致性(P<0.05)。与乳腺X线摄影、超声检查相比,动态增强MRI检查时双乳不存在外力压迫,乳腺内病灶处于相对自然的状态,与术后病变状态相似,加之动态增强MRI扫描能很好地区分癌灶与正常乳腺组织,勾勒出相对真实的病灶范围,所以测量结果较精确,可为保乳手术切缘达到阴性提供较为准确的信息[6]。
动态增强MRI使无创性评估乳腺癌血管生成成为可能。由于肿瘤内血管分布的多样性,乳腺癌病灶的强化类型也不同。本组患者按强化类型,分为环形强化、不均匀强化和较均匀强化。对照病理学检查结果,环形强化者多为中分化癌(12/17),不均匀强化者多为低分化癌(13/19),较均匀强化者多为高分化癌(14/18),差异有统计学意义。有文献报道,动态增强MRI显示病变的强化类型与病理类型有一定的关联[7]。乳腺癌增强方式反映了肿瘤内部的血流特点,低分化癌增殖活跃,易出现小的坏死灶,常表现为高度强化和不强化区交替,即不均匀强化;高分化癌增殖能力弱于前者,肿瘤细胞的增殖速度趋于同步,出现坏死较少,常表现为较均匀强化;中分化癌的增殖能力介于两者之间,中心部出现坏死较少而表现为较均匀,外周部因增殖所需血供丰富而表现为明显强化,强化方式常表现为环状。
c-erbB-2(HER-2)是临床评估乳腺癌生物学行为及预后的重要指标,常联合雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及Ki-67增值指数评价预后及新辅助治疗效果。本组患者中,多数不均匀强化病灶c-erbB-2表达阳性(12/19),但由于样本量较小,不同强化类型病灶的c-erbB-2分布差异无统计学意义。尽管依据临床保乳手术标准对符合标准的病灶进行手术并取得了较好疗效,但仍有2例于保乳术后1年内复发。回顾性分析发现,这2例均为不均匀强化的低分化腺癌,且c-erbB-2表达为强阳性。因此,选择保乳手术时,应重视乳腺癌的增强扫描影像特征。对于增强扫描表现为不均匀强化的乳腺癌,即使具备临床保乳手术指征,也应慎重选择,并在术后密切随访。本研究纳入例数尚少,今后需扩大样本量,从而为术前评估提供重要信息。
随着乳腺癌临床诊疗技术的不断进展,保乳手术是近年来广泛开展的整复术,由于能在不影响临床疗效的前提下最大限度地保持患者乳房美观和良好的心理状态而日益受到重视[8-10]。很好地掌握保乳手术的适应证是保乳手术成功的关键。动态增强MRI在保乳手术前可用于确定病灶位置、范围,从而在使切缘达阴性方面发挥重要作用,特别是其对病变范围的判定与病理结果有较高的一致性,因此在乳腺癌保乳手术的术前评价和预后评估中具有相当大的临床应用价值。
