125I标记美妥昔单抗在不同肿瘤模型中的显像研究
2018-11-19许晓平张建平罗建民程竞仪章英剑
许晓平,刘 成,张建平,罗建民,马 光,程竞仪,章英剑
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学生物医学影像研究中心,上海 200032;3.上海分子影像探针工程技术中心,上海 200032;4.上海市质子重离子医院核医学科,上海 201315;5.核物理与离子束应用教育部重点实验室,上海 200433
CD147分子是一种免疫球蛋白超家族(immunoglobulin superfamily)的跨膜糖蛋白,又被称为细胞外基质金属蛋白酶(matrix metalloproteinase,MMP)诱导因子。已有研究表明,CD147分子广泛表达于多种肿瘤细胞表面,并可能改变肿瘤生长微环境,刺激成纤维细胞分泌MMP,引起细胞外基质降解,从而促进肿瘤细胞的侵袭和转移[1-2]。因此,CD147是一个极具吸引力的肿瘤诊断和治疗的潜在靶点。
美妥昔单抗是一种特异性靶向CD147分子的单克隆抗体,其与放射性核素131I偶联形成的利卡汀(licartin)已被中国国家食品药品监督管理局批准上市,用于肝癌的治疗,对中晚期肝癌和预防肝癌根治术后复发表现出良好的干预效果[3-5]。鉴于CD147广泛高表达于多种肿瘤,美妥昔单抗是否可以进一步应用于其他肿瘤的诊疗,到目前为止尚未见公开报道。本研究以125I标记美妥昔单抗,利用小动物SPECT/CT在活体动物中持续观察美妥昔单抗在荷人胰腺癌、肺癌肿瘤模型中的摄取变化,以初步评估美妥昔单抗用于肝癌以外其他肿瘤诊断和治疗的可行性。
1 材料和方法
1.1 试剂和材料
美妥昔单抗HAb18F(ab’)2由空军军医大学细胞生物工程研究中心提供,N-溴代丁二酰亚胺(N-bromosuccinimide,NBS)购自上海百灵威化学技术有限公司;人血清白蛋白(human serum albumin,HSA)购自荷兰Nordic Immunology公司;磷酸二氢钠、磷酸氢二钠、碘化钾及丙酮购自国药集团化学试剂有限公司(上海);RPMI-1640培养基、10%胎牛血清购自美国Gibco公司;双抗(青霉素-链霉素)、0.25%胰酶购自法国Biowest公司;Na125I溶液购自上海欣科医药有限公司。
雌性BALB/c裸小鼠,3只,18~20 g,无特定病原体(specific pathogen free,SPF)级,由上海斯莱克实验动物有限公司提供,于复旦大学动物实验中心二、三级清洁级动物房饲养;人肝癌细胞SMMC-7721、人胰腺癌细胞SW1990和人肺癌细胞A549由中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库提供。
1.2 实验仪器
小动物SPECT/CT购自美国Bioscan公司;放射性薄层色谱仪(Radio-TLC)购自德国Raytest公司。
1.3 125I放射性标记HAb18F(ab')2
改进参考文献[6]的方法,将100 μL HAb18F(ab’)2(5 mg/mL溶于0.1 mol/L磷酸盐缓冲液溶液)加入2 mCi Na125I溶液,再加入20 μL NBS(1 mg/mL溶于0.1 mol/L磷酸盐缓冲液),室温下反应1 min,最后加入100 μL HSA(10 mg/mL溶于0.1 mol/L磷酸盐缓冲液)终止反应。使用Radio-TLC分析125I-HAb18F(ab’)2的放射化学纯度。
1.4 肿瘤模型建立
将SMMC-7721、SW1990和A549细胞系传代后接种于50 cm2培养瓶中,加入RPMI-1640培养基,在37 ℃、CO2体积分数为5%的培养箱内贴壁生长至融合状态,使用0.25%胰酶消化,传代扩增至所需用量,在倒置显微镜下进行细胞计数,至细胞总数为5×107个,收集细胞,用50%的基质胶制成密度为1×107/mL的单细胞悬液,取0.2 mL快速皮下接种于BALB/c裸小鼠四肢。将肝癌细胞系SMMC-7721作为对照接种于右上肢,胰癌细胞系SW1990接种于左上肢,肺癌细胞系A549接种于左下肢。裸小鼠在复旦大学动物实验中心培养4~6周,待实体瘤长至7~8 mm时用于显像。
1.5 小动物显像实验
显像前3 d,荷瘤小鼠饮用水中加入碘化钾以封闭甲状腺。其中1只作为对照观察,1只尾静脉注射约1 mCi/100 μL的125I-HAb18F(ab’)2,另1只尾静脉注射相同剂量的125I-纳米-HAb18F(ab’)2,均于第1、4 h,以及第1、2、3、6、9天时进行SPECT/CT显像。显像时以1.5%异氟烷/氧气将小鼠麻醉、固定,数据重建后利用仪器配置的InVivo Scope软件勾画感兴趣区,进行数据分析,计算肿瘤/肌肉(tumor-to-muscle,T/M)比值,比较不同肿瘤对125I-HAb18F(ab’)2的摄取情况。
2 结 果
2.1 125I-HAb18F(ab’)2质量分析
标记结束后,用毛细管点样于GF254硅胶板上,用丙酮展开,经Radio-TLC测定,125I-HAb18F(ab’)2的标记率和放射化学纯度均大于99%。其Radio-TLC谱图见图1。
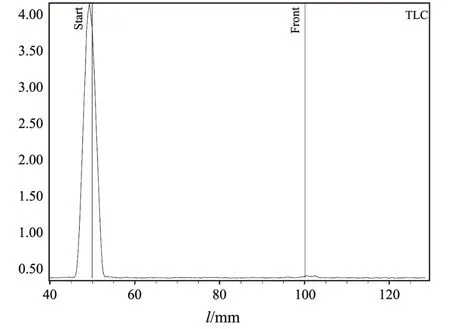
图1 125I-HAb18F(ab’)2标记液Radio-TLC谱图
2.2 小动物SPECT/CT显像研究
为减少个体差异,本研究于同一只BALB/c裸小鼠接种3种肿瘤,包括肝癌、胰腺癌和肺癌细胞系,以评估125I-HAb18F(ab’)2在不同肿瘤模型中的分布和肿瘤摄取情况。尾静脉注射125I-HAb18F(ab’)2后不同时间点归一化后的肿瘤SPECT/CT显像见图2,体内放射性分布特点见图3。
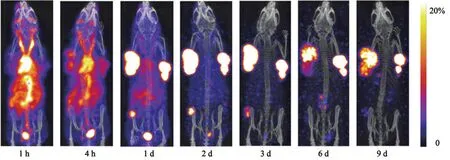
图2 不同时间点肿瘤125I-HAb18F(ab’)2的SPECT/CT成像
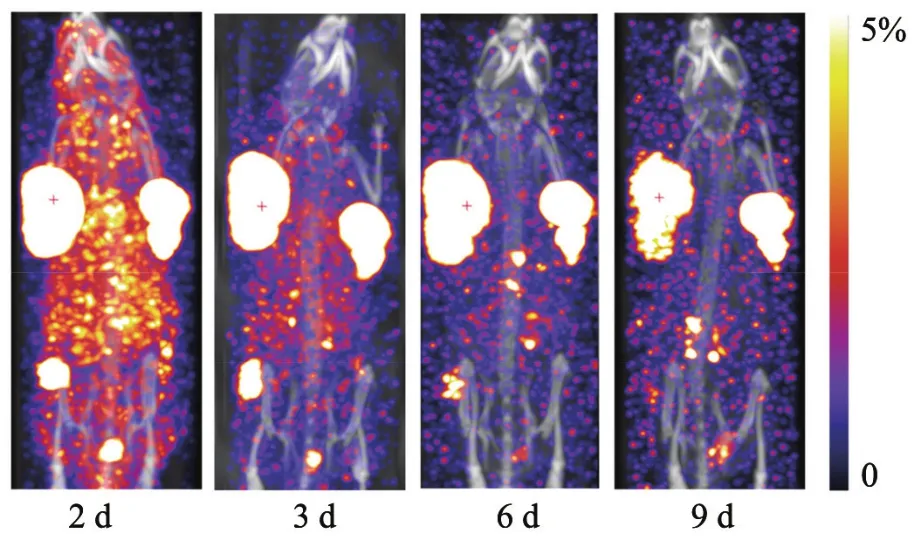
图3 不同时间点125I-HAb18F(ab’)2在荷瘤小鼠体内放射性分布
图2清晰呈现了125I-HAb18F(ab’)2大分子单抗体内清除慢的特点,尾静脉注射1 h后主要分布于血液中,心脏呈现高度放射性浓集,肿瘤未见明显放射性摄取。注射4 h后,125I-HAb18F(ab’)2在血液中的分布仍然处于高水平,但较1 h时已有明显下降,同时放射性开始浓集于肿瘤部位。注射1 d后,125I-HAb18F(ab’)2在血液中还有部分残留,未清除干净,但3种肿瘤均已呈现出异常高的放射性摄取,并远高于血液中的放射性。注射2 d后,125I-HAb18F(ab’)2只浓集于3个肿瘤部位,全身其余部位放射性接近本底。注射3 d后,3种肿瘤对125I-HAb18F(ab’)2的摄取发生改变,肺癌A549病灶的放射性摄取开始降低、注射9 d时已无明显放射性分布;胰癌SW1990病灶则与肝癌SMMC-7221一样,虽有下降,但在注射后第9天仍有明显摄取。图3可见放射性主要经泌尿道排泄,胃肠有极少量的放射性分布,甲状腺封闭良好,未见放射性碘积聚。
利用仪器自带的InVivo Scope软件勾画肿瘤以及右下肢肌肉为感兴趣区,计算不同时间点的T/M比值。结果显示,胰腺癌SW1990和肝癌SMMC-7221的T/M比值均在注射125I-HAb18F(ab’)2后6 d左右达到峰值,分别高达234和432(图4);而肺癌A549的T/M比值则在注射3 d左右达到峰值(26)。

图4 3种肿瘤不同显像时间点T/M比值
3 讨 论
CD147分子在许多实体肿瘤如肝癌、肺癌、胰腺癌、乳腺癌、结肠癌及恶性黑素瘤中高表达[7]。CD147进一步可与其效应细胞(癌周成纤维细胞)相结合,诱导MMP产生,提高肿瘤组织中的MMP含量和活性,导致间质成分和血管基底膜胶原蛋白过度降解,肿瘤细胞从而可以穿过基底膜和结缔组织屏障不断侵袭扩散,与肿瘤的发生、转移和预后密切相关[8-9]。因此,CD147可作为肿瘤浸润和转移的潜在实用标志物,为恶性肿瘤的诊疗提供一个新策略。
美妥昔单抗高度特异性靶向CD147分子,其与131I核素偶联而成的利卡汀是全球第1个批准上市的用于治疗中晚期原发性肝细胞肝癌的放射免疫靶向药物,在临床应用中取得了令人鼓舞的疗效。然而,到目前为止临床上该单抗的研究仅限于肝癌,在其他肿瘤中的应用尚未见报道。本研究以肝癌为对照,探讨美妥昔单抗是否可能用于其他肿瘤,采用小动物SPECT/CT长期动态可视化观察其靶向胰腺癌和肺癌的能力,并利用设备自带软件对其进行半定量分析。
基于125I化学性质同131I,但物理半衰期远长于131I,达60 d,其粒子植入局部控制肿瘤效果显著,本研究选择核素125I标记美妥昔单抗以长期观察其靶向性和全身分布,其中标记方法选择氧化能力较为温和的NBS方法,以避免氧化剂对单抗结构的破坏,影响其生物学活性。结果显示,该标记方法十分有效,标记率>99%(优于已有文献报道[6,10]),因此125I-HAb18F(ab’)2无需纯化,可以直接使用;此外,其生物活性良好(肝癌、胰癌模型中抗原-抗体结合能力达9 d以上),这对寻找亚临床病灶有利,并会对原发灶和播散转移灶均产生持续的内照射治疗,同时因射程有限,血液、骨髓等非靶器官分布和肠道内脱落碘极低,不会产生明显的不良反应;最后,还有利于HAb18F(ab’)2的推广应用。
采用氧化法标记的碘标志物容易在体内脱碘,因此本研究于显像前3 d在显像动物的饮用水中加入1%碘化钾以封闭甲状腺,以提高SPECT/CT影像质量[11]。尽管HAb18F(ab’)2已经是抗体片段,但是其相对分子质量仍然达到97 000,显像结果也清晰显示这一点,1、4 h时放射性主要分布在血液中,心脏和主要血管均呈现高度放射性分布,1 d后血液中仍然残留125I-HAb18F(ab’)2,可以较为清晰地分辨心脏和主动脉,同时3种肿瘤都呈现出明显放射性摄取,并且影像对比度高,完全满足肿瘤诊断要求。125I-HAb18F(ab’)2在正常肝组织快速代谢,未见明显放射性滞留,进一步证明了利卡汀在肝癌治疗中的应用潜力。肺癌A549移植瘤的T/M比值在第3天(峰值26)后下降,说明125I-HAb18F(ab’)2与A549肿瘤表面CD147分子的结合在3 d后开始脱落(并非脱碘),第6天时A549瘤灶已无明显放射性分布。胰腺癌与肝癌一样,第6天后开始脱落,但T/M比值高达234和432。本研究通过小动物分子影像的临床前研究初步探索了肝癌放射性药品类似物125I-HAb18F(ab’)2的质量及其靶向胰腺癌、肺癌的能力,其在胰腺癌中高比度内照射长达9 d以上,提示可用于治疗尝试,以拓展美妥昔单抗的应用。
致谢
衷心感谢空军军医大学陈志南院士馈赠美妥昔单抗HAb18F(ab’)2供本研究使用。
