鼻咽癌组织RANK/RANKL/OPG通路信号表达与肿瘤侵袭转移的相关性分析
2018-11-16王江涛文兆明肖仁斌
王江涛 黎 殷* 彭 辉 文兆明 肖仁斌 吴 娟
(1 湘雅萍矿合作医院(萍矿总医院),江西 萍乡 337000;2 萍乡卫生职业学院,江西 萍乡 337000)
鼻咽癌是中国南方常见的一种恶性肿瘤[1],大部分患者因颈部肿物等临床体征而就诊穿刺或活检被确诊鼻咽癌时,患者已经处于中晚期,此时已发现了颈部淋巴结发生转移,甚至大部分患者已发生骨转移[2]。研究[3]报道鼻咽癌常见的转移部位是骨、肺、肝、纵隔及腹腔内淋巴结,根治性放化疗后,鼻咽癌远处转移中骨转移高达75%。提高鼻咽癌的疗效和治愈率及避免其骨转移,深入探究其分子机制探究,己经成为鼻咽癌研究中最关键的问题之一,对于有效控制骨痛和减少骨折相关事件也极为重要。RANK-RANKLOPG基因构成的RANK/RANKL/OPG轴直接参与了机体破骨细胞的活性及功能调节,在破骨细胞表达和调控中占主导地位,对骨组织的生理、病理学改变也具有极大作用[4]。既往研究[5]表明,RANK/RANKL/OPG轴不仅与原发性的骨肿瘤有关联,而且还涉及许多恶性肿瘤如乳腺癌、前列腺癌等的骨转移,特别是介导了肿瘤骨转移部位溶骨(或成骨)性破坏,导致肿瘤性骨破坏的发生。近年来,对RANK/RANKL/OPG轴在肿瘤发生发展和转移机制的研究,仅仅在局限在乳腺癌、前列腺癌及肺癌等的报道[5-6],RANK/RANKL/OPG轴在鼻咽癌的研究进展机制仍是空白。本研究旨在观察RANK/RANKL/OPG基因通路表达高低与临床鼻咽癌骨转移之间的关系,探索RANK/RANKL/OPG基因通路在人鼻咽癌发生、发展过程和骨转移中的临床意义和作用机制。
1 材料与方法
1.1 实验材料:选取2016年7月至2018年7月江西省萍乡市湘雅萍矿合作医院的耳鼻喉科,50例经病理诊断确诊为鼻咽癌的患者,取其癌组织、癌旁组织(距离肿瘤3~5 cm的组织);所有入选患者术前均未接受过放疗、化疗或生物治疗等干预措施;50例鼻咽癌患者中(男27例,女23例),年龄42~72岁,平均年龄(61.15±6.21)岁;TNM分期依据国际抗癌联盟第7版标准进行,其中Ⅰ期11例,Ⅱ期10例,Ⅲ期13例,Ⅳ期16例。所有患者行鼻咽和颈部MRI检查(GE公司,1.5T)。
1.2 标本制备:每例新鲜标本的一部分固定在中性福尔马林液中,并通过脱水、透明、浸蜡与石蜡包埋保存,备用于免疫组化实验。另一部分置于冻存管中放入液氮冷冻,以备用于RT-PCR实验。
1.3 实验试剂及材料:即用型免疫组化Envision染色试剂盒、重组OPG和人类RANKL单克隆抗体AMG-162,购自福州迈新生物技术开发有限公司;氯仿分析纯(浙江迪耳药业有限公司)、DEPC(SIGMA AND AMERSCO)、异丙醇分析纯(浙江杭州双林化工试剂厂);琼脂糖(Agarose)(OXLOD)、溴化乙锭(EB)(上海生工生物工程技术服务有限公司)、Goldview、溴酚兰(上海赛百胜公司)、Trizol(Invitrogen)、 AMV逆转录酶(Promega)、Taq酶(Promega)、Oligod(T) Primers(Promega)、RNase Inhibitor(Promega)、dNTP(M.W)、Trisbase(Amersco)、arc(Amersco)、bis-arc(Amersco)、100 bp marker(Takara)、二甲基苯氰(Amersco)、MTT(Amersco)、L-谷氨酰胺(Amersco)、L-脯氨酸(Amersco)、以下引物均根据primer premier 5.0软件设计,引物由上海生工有限公司合成 (β-actin上游:5’ACTGCCGCATCCTCTTCCTC 3’,β-actin 下游:5’ACTCCTGCTTGCTGATCCACAT 3’,598bp)。
1.4 实验方法与步骤
1.4.1 免疫组织化学分析:将所有组织标本续切成5 μm厚,进行免疫组织化学染色(按产品说明书进行染色步骤)。5 μm石蜡切片脱蜡和水化后,以3% H2O2处理5 min;将柠檬酸盐缓冲液在高压下煮沸15 min,在室温下冷却20 min以进行抗原修复;50 μL过氧化酶阻断溶液孵育15 min;50 μL正常非免疫动物血清孵育20 min;除去血清,加50 μL一抗体,4 ℃过夜;50 μL生物素标记的二抗体孵育20 min;与50 μL链霉菌抗生物素蛋白-过氧化物酶溶液一起孵育20 min;加100 μL新鲜配制的DAB溶液显色10 min;苏木精复染后脱水、透明封片,光镜下观察结果(以PBS溶液替代一抗做阴性对照;以已知阳性切片做阳性对照)。
1.4.2 总RNA 的提取:①取组织30 mg,加入600 μL的裂解液中,研磨匀浆(匀浆器置于冰上),室温下离心5 min,速度14000 xg;5提取上清液,加入等体积的70ā酒精混匀,将混匀的液体吸取750 μL转入Hi Bind RNA小柱子上,套上2 mL收集管(试剂盒提供),室温下离心1 min,离心速度10000 xg;③移弃离心液,将Hi Bind RNA小柱子套入新的2 mL收集管,室温下再离心1 min(加入300 μL RNA洗脱液),离心速度10000 xg;④再次弃去离心液,将Hi Bind RNA小柱子套回2 mL收集管,加入500 μL RNA洗脱液Ⅰ,室温下再离心1 min(离心速度10000 xg);⑤又移弃离心液,将Hi Bind RNA小柱子套入新的2 mL收集管,加入500 μL RNA洗脱液Ⅱ,室温下又离心1 min(离心速度10000 xg);⑥第4次弃去离心液,将Hi Bind RNA小柱子套回2 mL收集管,加入500 μL RNA洗脱液Ⅱ,室温下再离心1 min(离心速度10000 xg);⑦第5次移弃离心液,将Hi Bind RNA小柱子套回2 mL收集管,空柱子室温下再离心2 min(离心速度10000 xg);⑧将Hi Bind RNA小柱子套入1.5 mL离心管(DEPC水处理过),加入40 μL DEPC 水于Hi Bind RNA小柱子中心,静置1~2 min,室温下再离心1 min(离心速度10000 xg);⑨收集离心液,紫外分光光度计测定总RNA 纯度,计算其浓度。
1.4.3 RNA逆转录:①使用前轻轻混匀试剂盒中每个组分,然后以2000 rpm 离心20 s;②取灭菌且无核酸酶的0.2 mL 离心管,依次加入2~5 μg RNA、6 μL Oligo T(18) (10 μm)、 1 μL d NTPs(10 mmol/L) 及1 μL DEPC水至15.5 μL;③65 ℃保温5 min,然后冰浴5 min;④往3步骤中的0.2 mL 离心管依次加入下列组分:RNase抑制剂(40 U/μL)0.5 μL、10×M-MLV Reaction Buffer 2 μL DTT(mmol/L)1 μL及逆转录酶(M-MLV)1 μL;⑤轻轻混匀后,2000 rpm再离心20 s;⑥先在37 ℃保温1 h,然后70 ℃保温15 min;⑦上述产物立即进行下一步的real-time PCR反应或-20 ℃保存。
1.4.4 Real-time PCR定量检测与计算:①取灭菌且无核酸酶的0.2 mL离心管,依次加入2×Master Mix SYBR Green I (TaKaRa,日本) 10 μL,上游引物0.25 µmol/L,下游引物0.25 µmol/L;CDNA(RT反应产物)模板2 μL和灭菌双蒸水加dd H2O至20 μL。②轻轻震荡30 s后进行PCR 扩增,PCR 扩增条件:94 ℃预变性5 min,94 ℃变性10 s,退火15 s,72 ℃延伸20 s,35个循环72 ℃延伸10 min结束反应。③根据每个循环的熔解曲线来鉴定特异性 cDNA 产物。④用Roche Light Cycler 480 软件分析结果。相应的mRNA含量用2-Ct方法计算相对含量(RQ),每个样本重复测定3次。
1.5 统计分析:采用统计学软件spss23.0对取得的数据进行描述性统计、计量资料用t检验,计数资料用卡方检验,相关性采用spearman相关分析。检验水准α=0.05。P<0.05具有统计学差异。
2 结 果
2.1 鼻咽癌组织与癌旁组织RANK/RANKL/OPG的表达:50例患者癌组织RANK、RANKL、OPG阳性率分别为70.0%(35/50)、62.0%(31/50)与76.0%(38/50),癌旁组织RANK、RANKL、OPG阳性率分别为8.0%(4/50)、12%(6/50)与6%(3/50),差异具有统计学意义,χ2值分别为3.47、2.45与1.25,P值均小于0.05。癌组织与癌旁组织RANK/RANKL/OPG表达的定量分析比较亦均<0.05。见表1、2。
2.2 RANK/RANKL/OPG的表达与鼻咽癌临床病理特征的关系:50例鼻咽癌组织RANK、RANKL、OPG阳性表达与患者性别、肿瘤大小及分化程度无关,P>0.05;与年龄、浸润深度、淋巴结是否转移和TNM分期密切相关,P<0.05。其中浸润鼻咽癌浆膜下RANK、RANKL、OPG阳性表达均显著高于浸润鼻咽癌肌层和黏膜层+黏膜下层,随着TNM分期升高,RANK、RANKL、OPG阳性表达均依次升高,阳性淋巴结转移与远处转移的癌组织RANK、RANKL、OPG阳性表达均高于癌旁组织淋巴结转移与远处转移,差异均有统计学意义,P<0.05(表3)。癌组织颈部淋巴结受累数、淋巴结坏死、淋巴结最大径和锁骨上窝受累高于癌旁组织,差异均有统计学意义,P<0.05(表3)。
2.3 RANK/RANKL/OPG的表达的相关性:50例鼻咽癌中,34例癌组织RANK/RANKL/OPG表达均阳性,16例均阴性者,癌组织与RANK/RANKL/OPG表达呈正相关,r=0.705,P=0.000。
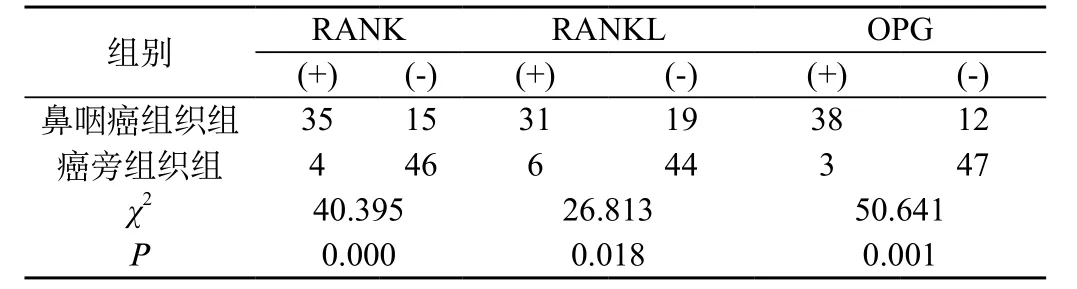
表1 鼻咽癌与癌旁组织RANK/RANKL/OPG表达率的分析
表2 鼻咽癌与癌旁组织RANK/RANKL/OPG表达的定量分析(±s)

表2 鼻咽癌与癌旁组织RANK/RANKL/OPG表达的定量分析(±s)
指标 鼻咽癌组织组 癌旁组织组 t P RANK 1.547±0.883 0.949±0.181 4.691 0.008 RANKL 1.364±0.594 0.766±0.129 6.956 0.003 OPG 1.126±0.442 0.813±0.171 4.670 0.009
3 讨 论
核因子κB 受体活化因子(receptor activator of NFκB,RANK)/核因子κB受体活化因子配体(receptor activator of NFκB ligand,RANKL)/骨保护素(osteoprotegerin,OPG)信号通路是成骨细胞与破骨细胞之间通讯的重要信号通路。核因子κB 受体活化因子/核因子κB受体活化因子配体/骨保护素(RANK/RANKL/OPG)信号通路是近些年来骨代谢领域的一项重大发现。前期,激素、细胞因子与生长因子通过作用于RANK、RANKL、OPG影响骨代谢,而导致骨代谢疾病如骨质疏松,溶骨性骨肿瘤及恶性肿瘤骨转移等[7-8]。在临床上Ⅰ期、Ⅱ期鼻咽癌多数为原位癌,无转移,属于早期癌,临床症状也较轻,而Ⅲ期、Ⅳ期则属于中晚期鼻咽癌,一般都存在器官或骨转移,所以准确的临床分期及合理治疗的选择,显得尤为重要[9]。本研究发现鼻咽癌癌组织中的RANK/RANKL /OPG信号通路的定性、定量表达都较癌旁组织高;且癌组织RANK、RANKL、OPG阳性表达与患者年龄、浸润深度、淋巴结是否转移和TNM分期密切相关;且随着鼻咽癌患者TNM分期的升高,RANK、RANKL、OPG阳性表达呈正向增高,阳性淋巴结转移与远处转移鼻咽癌RANK/RANKL /OPG信号高表达[10-11]。这均说明在鼻咽癌的早中晚要注意其骨代谢转移的发生,同时提示积极研发药物及其他治疗措施阻断RANK/RANKL /OPG信号通路的表达有可能是解决鼻咽癌骨转移的重要突破口。

表3 RANK/RANKL/OPG的表达与鼻咽癌临床病理特征的相关性分析
