大鼠骨髓间充质干细胞向血管平滑肌细胞分化过程中小窝蛋白-1表达增强
2018-11-14周芳亮何迎春闫庆梓张凯强廖端芳
周芳亮,何迎春,闫庆梓,张凯强,廖端芳*
(湖南中医药大学 1.生物化学与分子生物学教研室; 2.湘产大宗药材品质评价湖南省重点实验室干细胞中药调控与应用实验室, 湖南 长沙 410208)
血管平滑肌细胞(vascular smooth muscle cells, VSMCs)的表型转换和异常增殖是动脉粥样硬化等血管重塑性疾病形成和发展的重要环节[1-2]。研究表明血管重塑中的平滑肌细胞可来源于干细胞,并且参与血管重塑和新内膜增生过程[3- 4]。因此,研究干细胞分化为VSMCs的具体机制对于全面理解血管重塑疾病病理过程具有重要的意义。
小窝蛋白(caveolin-1)是形成细胞表面小凹结构的主要成分,在保持小凹的完整性、胆固醇结合、信号的传导中起着重要作用[5]。前期研究表明小窝蛋白-1在调节VSMCs增殖、表型转化方面起重要作用[6],然而其在干细胞向VSMCs分化中的作用尚不是十分清楚。本研究以骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)分化为VSMCs过程为研究对象,探讨小窝蛋白-1在该过程中的表达变化,为研究其在干细胞向VSMCs分化过程的具体机制提供基础。
1 材料与方法
1.1 材料
SPF级SD雄性大鼠(体质量50~70 g,湖南斯莱克景达实验动物有限公司,合格证号:43004700022681);DMEM低糖培养液、青霉素、链霉素和胰蛋白酶(Hyclone公司);胎牛血清(Gibco公司);干细胞成骨、成软骨及成脂诱导分化培养基(赛业生物科技有限公司);干细胞鉴定流式抗体(Ebiosience公司);阿利新蓝、茜素红和油红O(Sigma-Aldrich公司);TGF-β 1(Protech公司); SM-MHC抗体、SM22α和myocardin抗体(Abcam公司);caveolin-1抗体、tublin抗体、GAPDH抗体与辣根过氧化物酶标记羊抗兔(Cell Signaling Technology公司);BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配置试剂盒 (上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 BMSCs细胞的原代培养:颈椎脱臼处死大鼠,用75%乙醇充分消毒后无菌条件下迅速取出股骨,将表面的肌肉及筋膜剥离干净,剪去两端。用5 mL的注射器吸取DMEM低糖培养液从一端开口处插入骨中冲洗骨髓腔,从另一端收集冲洗液,反复冲洗,将冲洗液直接接种于25 mL的玻璃培养瓶中,于饱和湿度、37 ℃、5% CO2的条件下培养。48 h后换液去除未贴壁细胞,每3 d换液1次。细胞增殖至80%汇合时,弃去培养液,PBS清洗2次,0.1%的胰蛋白酶消化2 min后终止消化,用吸管轻轻吹打瓶底,利用 BMSCs 易脱落的特点将先被消化下来的BMSCs 与贴壁性较强的单核细胞、巨噬细胞等杂细胞分离。将细胞进行传代培养,倒置显微镜下观察细胞的增殖、形态变化并拍照。
1.2.2 细胞表面分子的鉴定:选择增殖良好的P3代细胞,消化后1 000 r/min离心4 min,弃上清液,加PBS洗2次,用PBS重悬细胞分装到0.5 mL离心管中,使每管的细胞量达到106个、 液体量为100 μL,加入5 μL抗体,避光室温孵育25 min,300 μL PBS重悬细胞,流式细胞仪对细胞表面标志物CD90、CD105、 CD45和CD11进行检测。
1.2.3 细胞分化能力的鉴定: 取第3代(P3)细胞,加入间充质干细胞成脂诱导液、间充质干细胞成骨诱导液,15、20 d后分别进行油红O、茜素红染色;加入间充质干细胞成软骨诱导液,细胞成团后石蜡包埋切片,阿利新蓝染色,倒置显微镜下观察染色情况并拍照。
1.2.4 TGF-β1诱导BMSCs分化:将增殖良好的对数期P3代BMSCs细胞消化后接种到2个6 cm培养皿中,24 h后分别用普通培养基(DMEM低糖培养液、10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)和诱导分化培养基(DMEM低糖培养液、10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素、5 ng/mL TGF-β1)培养10 d。
1.2.5 Western blot检测TGF-β1诱导BMSCs 后各组细胞小窝蛋白-1的表达:选择增殖良好的对数期P3代BMSCs细胞,消化后接种于3.5 cm培养皿中,贴璧24 h后,用5 ng/mL TGF-β1对其分别诱导0、3、9和12 d,用预冷PBS清洗细胞3次,吸尽残留的PBS,加入含1% PMSF的RIPA裂解液处理15 min,4 ℃条件下1 000×g离心5 min取上清,BCA法测定蛋白浓度。每组取30 μg总蛋白,10% SDS-PAGE分离蛋白,运用电转移法将蛋白转移至PVDF膜。含5%脱脂牛奶TBST封闭1 h后加入相应一抗,4 ℃孵育过夜,洗膜后孵育二抗1 h,化学发光法ECL显影。
1.3 统计学分析

2 结果
2.1 BMSCs的鉴定
镜下可见P3代BMSCs细胞呈漩涡样状增殖(图1),细胞经过诱导后,可向软骨细胞、脂肪细胞和骨细胞分化(图2)。BMSCs高表达细胞表面抗原CD90、CD105,低表达CD45、CD11(图3)。
2.2 体外诱导BMSCs分化为VSMCs
与正常未诱导组相比,5 ng/mL TGF-β1诱导BMSCs细胞10 d后,血管平滑肌细胞标记SM-MHC和SM22α的表达明显增加,同时caveolin-1的表达增加(图4)。

图1 吉姆萨染色BMSCs细胞Fig 1 Giemsa stained BMSCs(×200)

A.chondrogenic differentiation(Ali new blue staining ×100); B.adipogenic differentiation(Oil Red O staining ×200);C.osteoplastic differentiation(Alizarin red staining ×200)

图3 流式细胞仪鉴定BMSCs表面分子标志Fig 3 BMSCs surface molecules identified by flow cytometry
2.3 小窝蛋白-1在BMSCs向VSMCs分化过程中的表达变化
5 ng/mL TGF-β1诱导BMSCs不同时间后发现caveolin-1、SM-MHC的表达随TGF-β1诱导时间的延长而增强,同时myocardin的表达增强(图5)。
3 讨论
平滑肌细胞的增殖和迁移是血管重塑性疾病形成和发展的重要因素[2]。目前已证实VSMCs存在两种亚型:收缩型(cSMC)和增殖型(pSMC)。大量研究发现,在血管受损环境下,新生血管内膜中的pSMC数量明显增多[4]。普遍认为,VSMCs具有表型可塑性,血管内皮损伤时cSMC可去分化成为pSMC,pSMC从中膜迁移至内膜,增殖、分泌细胞外基质蛋白。即经典的“血管平滑肌细胞去分化理论”[7]。然而近年的研究发现干细胞的分化才是内膜下VSMCs的来源,也是导致心血管疾病的重要原因[3]。这对经典的收缩型平滑肌细胞“去分化理论”提出了严峻挑战并引起广泛关注。但同时众多血管生物学知名学者对VSMCs的干细胞源性提出了质疑,然而这些学者也同时认为在这一重要领域的进一步探索是必需的[8]。因此通过不同途径来证实干细胞向血管平滑肌细胞分化的存在及其调节机制,有助于明确VSMCs的来源,阐明动脉粥样硬化等血管重塑性疾病的发病机制。本研究验证了骨髓间充质干细胞可以体外诱导分化为平滑肌细胞,从侧面证实平滑肌细胞干细胞源性的可能性。
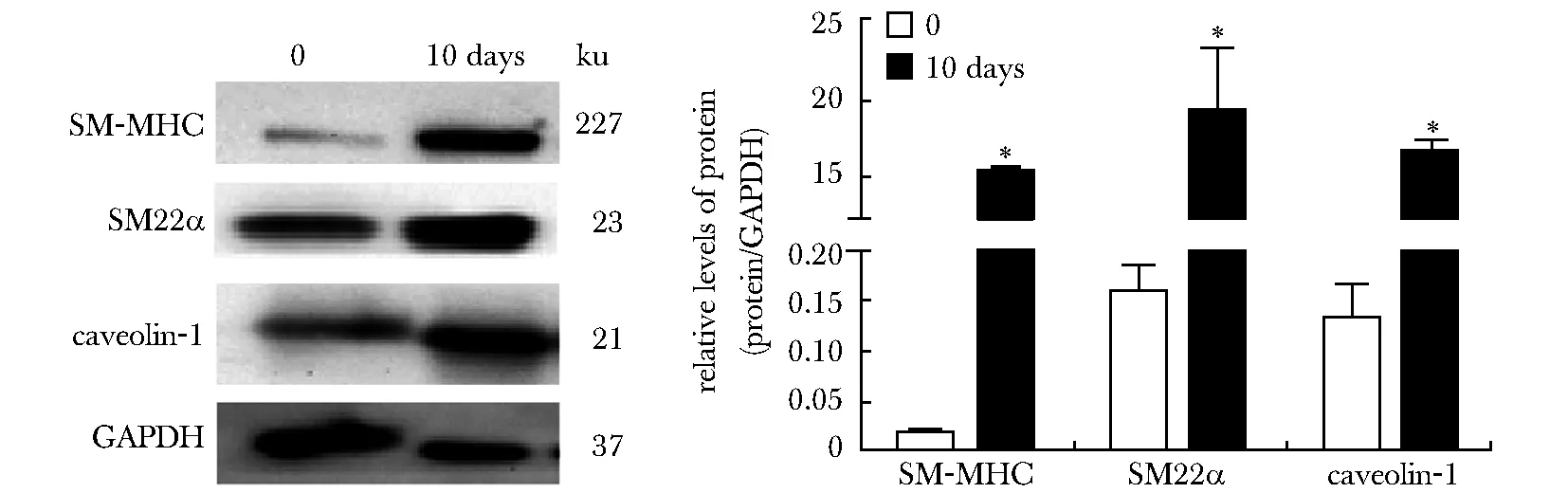
*P<0.05 compared with 0 day group
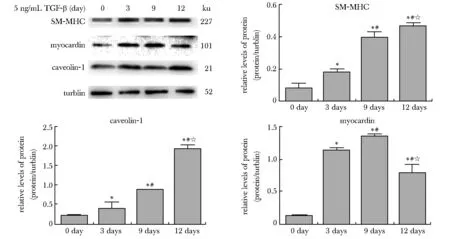
*P<0.05 compared with 0 day group; #P<0.05 compared with 3 days group; ☆P<0.05 compared with 9 days group
近年,小窝蛋白-1调节干细胞分化方面受到较多的关注。小窝蛋白-1表达增加是趋于衰老的人间质干细胞(hMSC)逐渐失去成脂细胞分化潜能的主要原因[9]。Baker N发现小窝蛋白-1可调控间质干细胞向成骨细胞分化[10]。而小窝蛋白-1在间充质干细胞向血管平滑肌细胞的分化过程的作用及机制尚待研究。本研究表明在BMSCs分化为VSMCs的过程中小窝蛋白-1表达的水平随TGF-β1诱导时间的延长而增强,提示小窝蛋白-1可能参与了干细胞来源的平滑肌细胞的形成。此外,在该过程中心肌素蛋白(myocardin)的表达增加,而心肌素蛋白是一种心肌和平滑肌特异性的血清应答因子(serum response factor, SRF)的辅助因子,是心肌和SMC发育和分化的关键决定因素[11]。心肌素蛋白进入细胞核后可与SRF结合促进CArG盒依赖性的收缩基因转录(如SMα-actin、SM-MHC和 SM22α等),从而促进pSMC分化为cSMC[12-13]。另有报道心肌素蛋白参与干细胞分化为平滑肌细胞的过程[14-15]。小窝蛋白-1是否可通过心肌素蛋白来调控干细胞的分化有待进一步研究验证。
综上所述, 本研究结果表明,BMSCs在向VSMCs分化过程中小窝蛋白-1表达增强,提示小窝蛋白-1与干细胞源性的VSMCs的形成有关。推测其可能通过心肌素蛋白来调控该分化过程,为进一步研究干细胞分化为血管平滑肌细胞的具体机制提供了基础。
