松材线虫果胶酶基因Bxpel1的克隆及其生物信息学分析
2018-11-10邱秀文周桂香王慧娟杨丽丽
邱秀文,周桂香,王慧娟,杨丽丽
松材线虫果胶酶基因1的克隆及其生物信息学分析
邱秀文1,2,3,周桂香1,2,3,王慧娟3,杨丽丽3
(1. 九江学院 鄱阳湖生态经济研究中心,江西 九江 332005;2. 九江学院 九江市流域管理与生态保护重点实验室,江西 九江 332005;3. 九江学院 化学与环境工程学院,江西 九江 332005)
以松材线虫转录本为模板,通过RT-PCR技术克隆果胶酶1基因。结果表明,松材线虫果胶酶1基因序列全长为795 bp,GC含量为50.44%,编码252个氨基酸。通过Blast比对克隆的1基因与已知序列(Gen-Bank ID:AB232908.1)的同源性达到98%。系统进化分析表明,1基因编码产物的氨基酸序列与拟松材线虫,燕麦真滑刃线虫的1蛋白序列具有高度同源性。1基因编码的产物的0 ~ 25序列有可能是跨膜结构域,而其他序列均位于膜外,其二级结构主要是以无规则卷曲和β-折叠为主,信号肽的剪切位点位于第17至第18位氨基酸之间,主要在细胞外发挥生物学作用。1基因的克隆及其生物信息学分析对进一步研究1基因在松材线虫致病过程中的功能具有重要意义。
松材线虫;1基因;克隆;生物信息学
松材线虫病(Pine Wilt Disease)是由松材线虫引起松属植物死亡的一种世界性森林病害[1-3]。果胶酶基因是松材线虫的重要致病因子,有研究表明,松材线虫入侵松树时会分泌大量果胶酶来破坏松属植物细胞壁进而侵入寄主细胞[4-5]。然而,目前关于果胶酶基因在松材线虫致病过程中的功能还不清楚。果胶由杂多糖和半乳糖醛酸构成,是植物细胞壁的主要成分之一。寄生生物在入侵植物的过程中会大量分泌果胶酶[6],导致植物细胞壁破坏,从而有利于其成功入侵和定殖寄主植物[7]。动物果胶酶基因(1)最早是在土豆胞囊线虫中被发现[8]。随后,越来越多报道显示许多植物病原性线虫均有1,如大豆胞囊线虫[9]和根结线虫spp.[10]等。目前关于1在松材线虫致病过程中的功能还不清楚,有关该基因在松材线虫致病形成的遗传进化机理也尚不明确。
生物信息学(Bioinformatics)是由结合统计学、数学、计算机与生物医学多学科的一门新兴学科,为功能基因的发现、基因表达及表达产物的功能研究提供了新思路。利用生物信息学与试验技术相结合研究基因结构及其编码产物的组织结构和信息结构越来越普遍[11]。本研究利用分子实验技术克隆了松材线虫果胶酶基因(1),并借助生物信息学相关软件预测和分析了其编码产物的理化性质、蛋白质二级和三级结构、序列特征及相关生物学功能,研究结果有助于从分子水平上理解果胶酶基因1的结构和功能,为进一步研究松材线虫果胶酶基因在松材线虫致病过程中的功能及其遗传进化机理奠定基础。
1 材料和方法
1.1 实验材料
供试松材线虫选用九江学院植物基因资源重点实验室分离保存的虫株JJU-BLD,该虫株于2015年8月从江西省九江市星子县白鹿洞书院一株病死黑松(胸径45 cm)上分离得到,将松材线虫接种至灰葡萄孢上,置于25℃生化培养箱中培养7 d,保存于4℃冰箱备用。
1.2 松材线虫总RNA提取
松材线虫总RNA采用Trizol细胞裂解液按常规方法(酚-氯仿)进行抽提,然后将抽提物溶解于适量DEPC(Diethyl pyrocarbonate)水中,取少量总RNA进行浓度及OD260/OD280比值测定,把合格的总RNA置于-80℃冰箱保存备用。
1.3 引物设计与合成
根据已公布的松材线虫1基因的序列(GenBank登录号为AB232909.1),利用分子生物学软件Primer Premier 5.0设计RT-PCR扩增引物。引物由上海生工生物工程技术服务有限公司合成,预期扩增产物的长度795 bp。引物序列为:上游引物P1:5'-TTTTGGCATTCTCAGTTGTAGC-3';下游引物P2:5'-CCATCTTGTCCCTGTTTGTAAG-3′。
1.4 反转录(Reverse transcription)
按照Transgen公司(中国)生产的EasyScript® First-Strand cDNA Synthesis SuperMix试剂盒说明书合成松材线虫cDNA,反应体系为:Total mRNA 500 ng,Random Primer(N9)(0.1 μg·μl-1)1 μl,2×ES Reaction Mix 10 μl,EasyScript® RT/RI Enzyme Mix 1 μl,添加RNase-free Water至10 μl,轻轻混匀后置于25℃孵育10 min,42℃孵育30 min,85℃加热5 min后冰上放置。
1.5 PCR扩增
以上述cDNA为模板进行PCR扩增,反应体系:Ex Tag Mix 25 µl,引物(10 µM)各1.0 µl,模板DNA 2.0 µl,补ddH2O至50 µl,反应条件为:95℃预变性5 min,95℃ 30 s,54℃ 30 s,72℃ 45 s,35个循环,最后72℃7 min。4℃保存PCR产物。
1.6 PCR产物的回收与纯化
PCR产物进行琼脂糖凝胶电泳后,利用凝胶成像系统在紫外灯下将目的片段切胶回收,用Axygen公司提供的AxyPrep DNA 凝胶回收试剂盒纯化目的片段,-20℃保存备用。
1.7 目的基因的克隆与测序
在T4 DNA连接酶作用下使PCR产物与pMD19-T载体连接,然后转染至大肠杆菌感受态细胞中,涂布在含有Amp 50 mg·L-1的X-gal/IPTG的LB培养基上,37℃培养16 h。挑选3个白色单菌落进行菌液PCR,扩增产物送华大基因测序公司进行测序鉴定。
1.8 生物信息学分析
根据1基因的克隆测序结果,利用BioEdit软件推导出1的氨基酸序列。利用ProtParam工具分析蛋白质的基本理化性质;利用Hopfield神经网络预测蛋白质的二级结构。利用Siss-model预测蛋白质的三级结构。利用SignalP v4.0,HMM 2.0和PSORTⅡ分别进行信号肽、蛋白质序列的跨膜区和亚细胞定位分析。从GenBank中下载其它物种的1基因序列,利用MEGA4软件将克隆所得到的序列与GenBank上已发表的拟松材线虫,燕麦真滑刃线虫,马铃薯腐烂茎线虫和链霉菌属等序列进行同源性分析,并构建系统进化树。
2 结果与分析
2.1 总RNA的提取
采用Trizol试剂法提取松材线虫总RNA,经紫外分光光度测定,其OD260/OD280比值为1.92,浓度为1 678 ng·μL-1,说明提取的总RNA质量合格,可以进行后续实验。
2.2 RT-PCR扩增
以提取的松材线虫总RNA为模板,反转录合成cDNA后进行PCR扩增,8 g·L-1琼脂糖凝胶电泳检测,结果见图1。由图1可知,在750 bp ~ 1 000 bp之间,靠近750 bp处有较亮的特异性条带,与预期的目的片段的大小(795 bp)一致。

图1 松材线虫果胶酶基因RT-PCR产物电泳
Figure 1 Electrophoresis of1 gene amplified by RT-PCR
2.3 阳性重组质粒测序结果比对及分析
将测序结果在NCBI中与松材线虫已知序列[12](Gen-Bank ID:AB232908.1)进行BLAST比对,结果二者之间的同源性为98%(图2),说明本实验成功克隆到松材线虫1基因。BioEdit软件分析表明,该序列GC含量为50.44%,编码252个氨基酸,与拟松材线虫的同源性为93%。
2.4 Bxpel1基因编码产物的理化性质
通过相关生物信息学软件(Bio-Edit)和在线网站(http://www.expasy.org)预测松材线虫1基因编码产物的理化性质。由1基因编码产物的氨基酸组成(图3)可知,1基因编码252个氨基酸,组分中最多的氨基酸是Gly(甘氨酸),占全部组分的12.7%。1基因编码的氨基酸理论等电点为8.43,理论分子质量约为26.68 ku。
2.5 Bxpel1基因编码产物的二级结构预测
通过Hopfield神经网络(HNN)预测松材线虫1基因编码蛋白的二级结构,结果如图4所示,上行为氨基酸序列,下行为其所对应的二级结构,其中h代表helix(α-螺旋),e代表extended(β-折叠),c代表coil(无规则卷曲)。从预测结果可知,1蛋白的二级结构中,α-螺旋占11.51%,β-折叠占35.32%,无规则卷曲占53.17%。
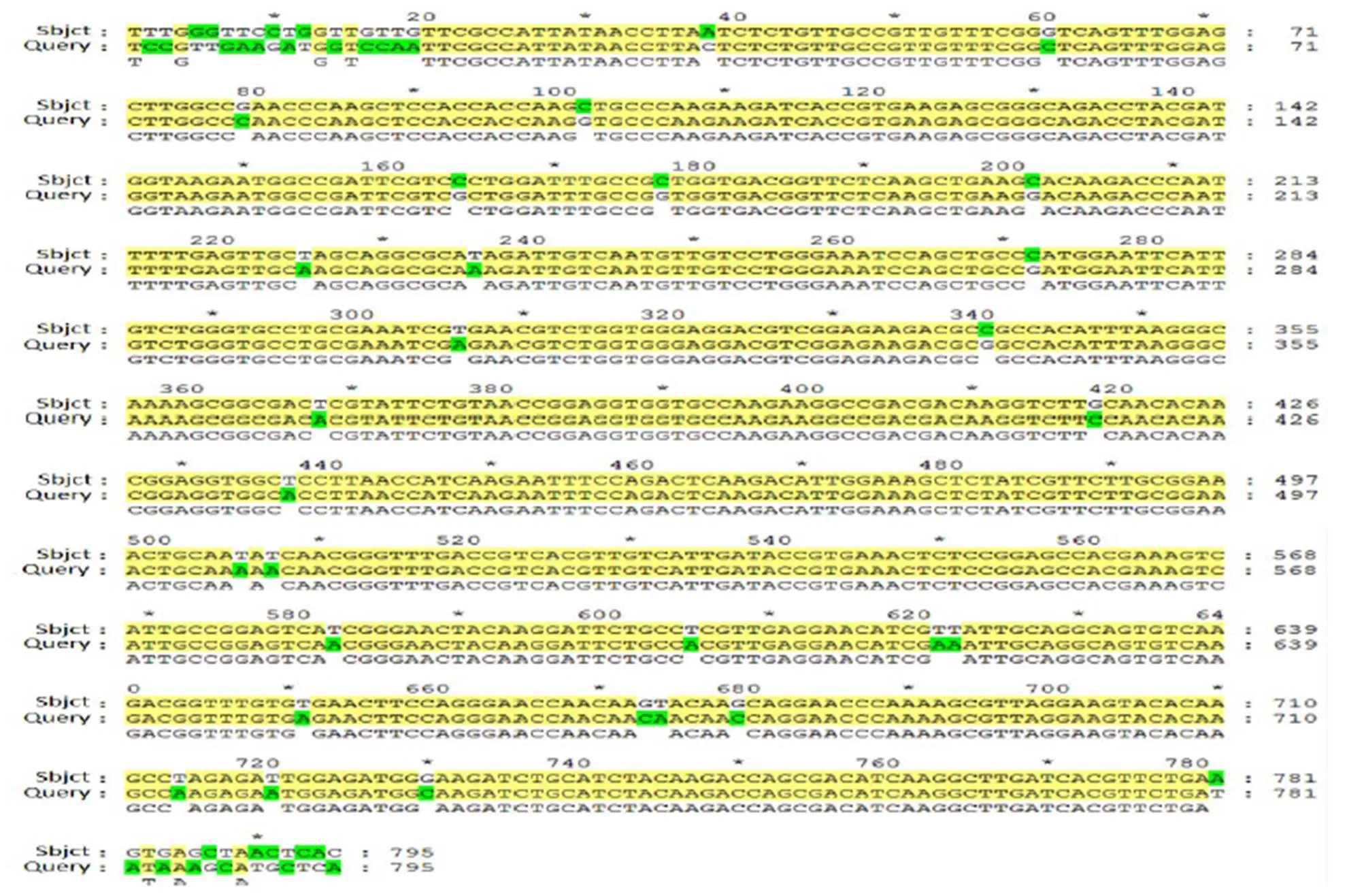
图2 测序结果与已知序列的比对
Figure 2 Comparison of sequencing result between1 and knowns

图3 Bxpel1蛋白氨基酸组成
Figure 3 Amino acid composition ofprotein

图4 Hopfield神经网络(HNN)Bxpel1蛋白二级结构预测
Figure 4 Prediction of secondary structure of1 protein based on HNN
2.6 Bxpel1基因编码产物的三级结构预测
蛋白质的三级结构是在α螺旋、β折叠、β转角和无规则卷曲等二级结构基础上通过侧链基团的相互作用进一步卷曲、折叠而形成特定的构象。本研究利用SWISS-MODEL在线预测1结构域区的三级结构,结果如图5显示,1结构域区构成圆柱状结构。
2.7 Bxpel1基因编码产物信号肽分析
通过在线蛋白质序列信号肽分析工具SignalP4.1对1基因编码产物的前70个氨基酸序列进行了分析,程序分别自动利用神经网络模型(NN)进行信号肽分析,并给出了3种C,Y,S-score计算结果。神经网络模型(NN)预测的信号肽结果如图6所示,松材线虫1编码产物的分值曲线非常典型,C值为0.599,Y值为0.746,S值为0.970,其切割点位于第17至第18位的氨基酸之间,基本可以判定1编码产物存在信号肽。
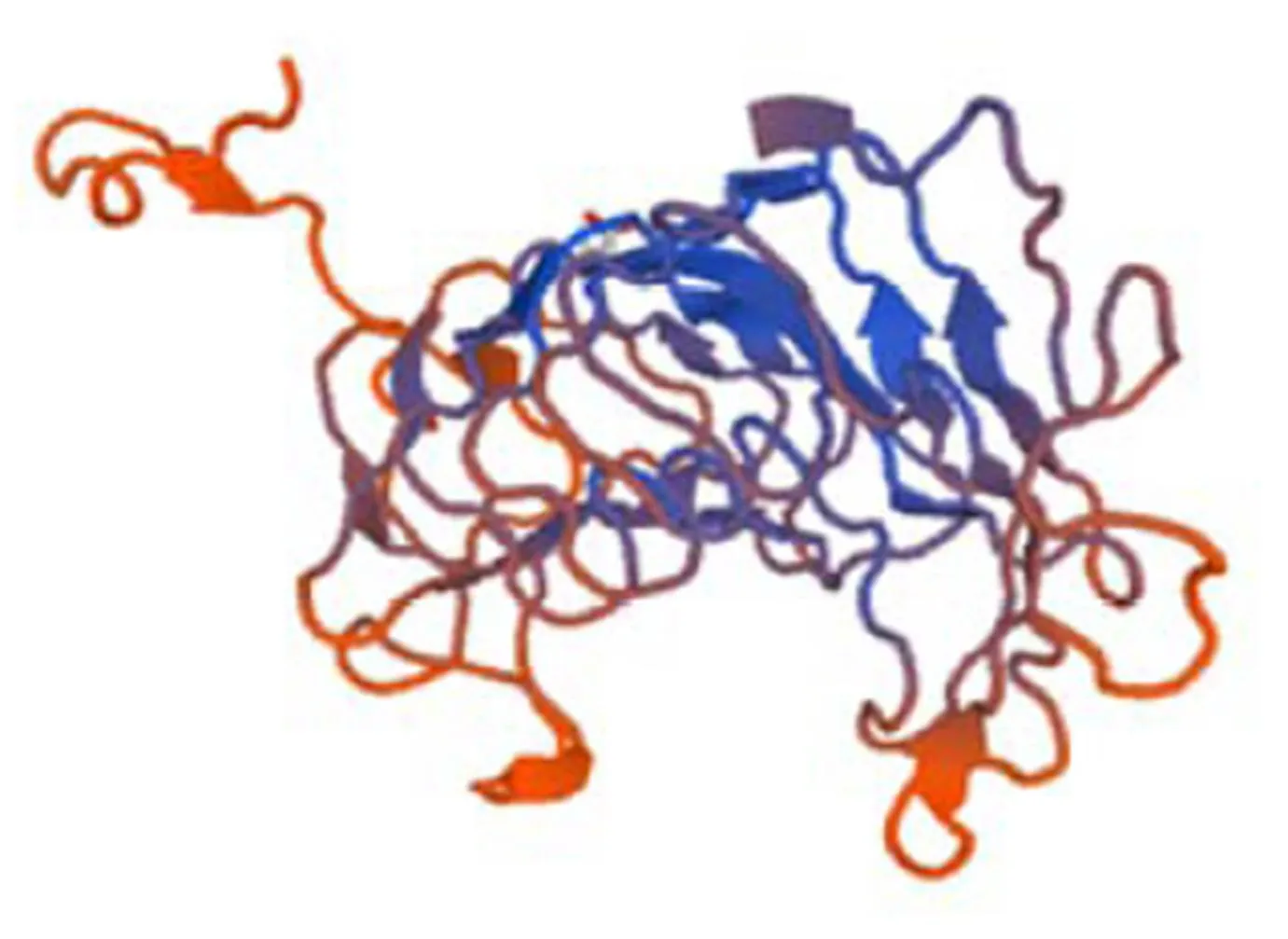
图5 Bxpel1蛋白结构域区三级结构预测
Figure 5 Prediction of tertiary structure domain of1 protein

图6 Bxpel1基因编码产物信号肽分析
Figure 6 The signal peptide analysis ofl1 gene encoding protein
2.8 Bxpel1基因编码产物跨膜结构的预测和分析
蛋白质的跨膜结构域一般由20 ~ 30个疏水氨基酸残基组成,形成一螺旋固着于细胞膜上起锚定作用。通过使用TMPRED在线预测和分析了松材线虫基因编码蛋白质序列的跨膜区域。由图7可知,1基因编码的产物的0 ~ 25序列有可能是跨膜结构域,而其他序列均位于膜外。
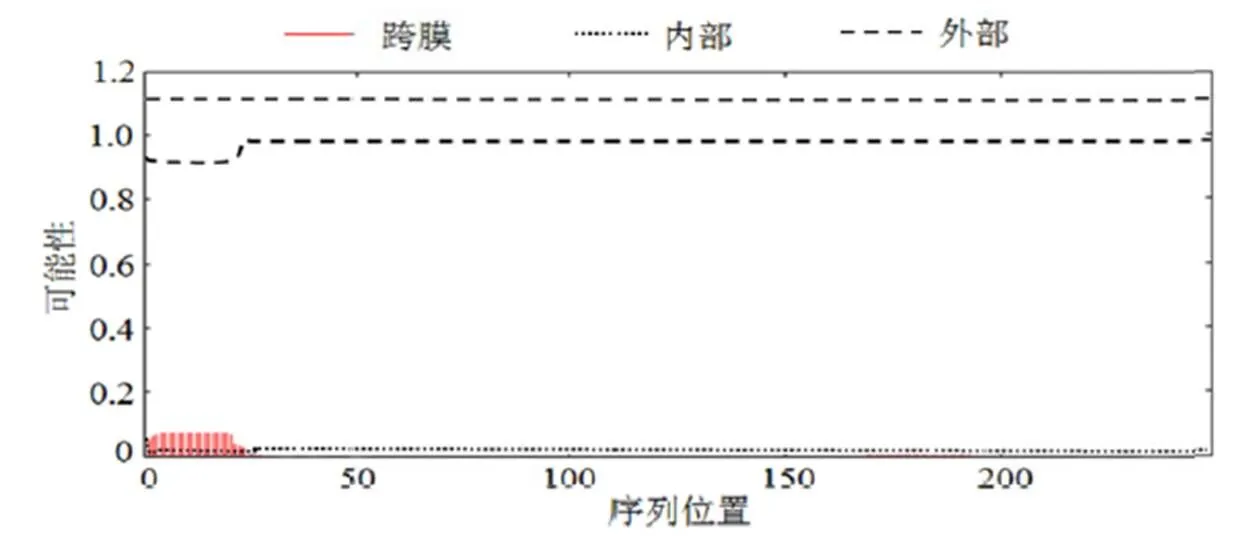
图7 Bxpel1蛋白跨膜区域分析
Figure 7 Transmembrane regional analyses of1 protein
2.9 松材线虫Bxpel1基因编码产物亚细胞定位分析
亚细胞定位的预测一般通过算法比较查询序列中所包含的特征参数与各类相应的亚细胞定位的相似度,然后以一组概率值的形式作出判断。通过工具PSORTⅡ预测,松材线虫1基因编码产物的亚细胞定位,见表1。从表1可知,其分布在细胞外的可能性为82.7%,分布在线粒体的可能性为4.3%,分布在内质网的可能性为4.3%,分布在细胞核的可能性为8.7%。因此可以推断,松材线虫1基因编码产物主要在细胞外发挥生物学作用。

表1 Bxpel1 编码产物的亚细胞定位分析
2.10 松材线虫Bxpel1基因编码产物的分子进化分析
在NCBI网站(https://www.ncbi.nlm.nih.gov/)下载拟松材线虫、燕麦真滑刃线虫、马铃薯腐烂茎线虫和链霉菌属的果胶酶基因的氨基酸序列,利用MEGA 4.0软件将其与松材线虫果胶酶基因编码产物进行系统进化分析,并构建系统进化树,如图8。由图8可知,松材线虫与拟松材线虫、燕麦真滑刃线虫具有高度同源性,分子进化距离最近,关系最为密切,而与马铃薯腐烂茎线虫和链霉菌属进化距离相对较远。

图8 Bxpel1基因编码产物的系统进化树
Figure 8 The phylogenetic tree of1
3 结论与讨论
果胶是植物细胞壁的主要构成成分之一,果胶酶基因广泛存在于植物寄生线虫基因组中,在线虫入侵植物的过程中发挥着重要作用[13-15]。松材线虫致病性相关的基因多是在食道腺细胞内表达,然后其产物通过口针分泌到寄主体内[16-20]。Taisei Kikuchi等[21]研究表明,1基因在松材线虫食道腺细胞中表达,所编码的多肽活性依赖于Ca2+,在pH值为8 ~ 10时具有最佳活性。松材线虫将果胶酶分泌到植物的组织内以助其取食与迁移,因此推断果胶酶基因是松材线虫关键致病相关基因。
本研究通过信号肽和跨膜结构的预测,分析基因编码蛋白功能。通过对1基因编码产物进行同源比对,发现1基因编码产物的氨基酸序列与拟松材线虫、燕麦真滑刃线虫的1蛋白序列具有高度同源性,这种同源性在一定程度上代表着物种亲缘关系的远近,同时也反映了1编码产物在不同物种结构上的稳定性对生物体的功能重要性。结果表明,1基因编码产物由252个氨基酸组成,其等电点为8.43,分子质量约为26.68 ku。1基因编码产物二级结构主要是以无规则卷曲和β-折叠为主,主要在细胞外发挥生物学作用,并且预测出信号肽的剪切位点位于第17至第18位的氨基酸之间,已知信号肽位于分泌蛋白的N端,它对于外分泌蛋白的分泌起主导作用[22-23]。利用生物信息学的方法对松材线虫1基因的编码产物序列进行分析,可以了解其蛋白质结构和功能,结果对进一步研究阐明1基因松材线虫致病过程中的功能及松材线虫病的分子致病机理具有重要意义,同时为以后试验方案的制定提供了重要理论依据。
[1] ZHU L h,YE J r,NEGI Sapan,. Pathogenicity of aseptic[J]. PLoS ONE,2012,7(5):e38095.
[2] PEREIRA F,MOREIRA C,FONSECA L,. New insights into the phylogeny and worldwide dispersion of two closely related nematode species,and[J]. PLoS ONE,2013,8(2):e56288.
[3] MALLEZ S,CASTAGNONE C,ESPADA M,. First insights into the genetic diversity of the pine wood nematode in its native area using new polymorphic microsatellite loci[J]. PLoS ONE,2013,8(3):e59165.
[4] Qiu X W,Wu X Q,Huang L,. Specifically expressed genes of the nematodeinvolved with early interactions with pine trees[J]. PLOS ONE,2013,8(10):e78063.
[5] Qiu X W,Wu X Q,Huang L,. Influence of1 Gene Silencing by dsRNA Interference on the Development and Pathogenicity of the Pine Wood Nematode,[J]. Int J Mol Sci,2016(17):125.
[6] BARRAS F,VAN GIJSEGEM F,CHATTERJEE A K. Extracellular enzymes and pathogenesis of soft-rot Erwinia[J]. Ann Rev Phytopathol,1994,32(1):201-234.
[7] DAVIS E L,HUSSEY R S,BAUM T J. Getting to the roots of parasitism by nematodes[J]. Trends Parasitol,2004,20(3):134-141.
[8] POPEIJUS H,OVERMARS H,JONES J,. Enzymology: degradation of plant cell walls by a nematode[J]. Nature,2000,406(6791):36-37.
[9] DE BOER J M,DAVIS E L,HUSSEY R S,. Cloning of a putative pectate lyase gene expressed in the subventral esophageal glands of[J]. J Nematol,2002,34(1):9.
[10] DOYLE E A,LAMBERT K N. Cloning and characterization of an esophageal-gland-specific pectate lyase from the root-knot nematode[J]. Mol Plant-Microb Interact,2002,15(6):549-556.
[11] 曹会萍,常卫华,马呈瑞,等. 绵羊性腺褪黑素受体基因 MT2 的克隆及其生物信息学分析[J]. 中国兽医科学,2013,43(12):1295-1300.
[12] KIKUCHI T,SHIBUYA H,AIKAWA T,. Cloning and characterization of pectate lyases expressed in the esophageal gland of the pine wood nematode[J]. Mol Plant-microb Interact,2006,19(3):280-287.
[13] JONES T M,ANDERSON A J,ALBERSHEIM P. Host-pathogen interactions IV. Studies on the polysaccharide-degrading enzymes secreted byf. sp. Lycopersici[J]. Physiol Plant Pathol,1972,2(2):153-166.
[14] TOMASSSINI A,SELLA L,RAIOLA A,. Characterization and expression of Fusarium graminearum endo-polygalacturonases in vitro and during wheat infection[J]. Plant Pathol,2009,58(3):556-564.
[15] 邱秀文,吴小芹,黄麟,等. 松材线虫2基因的克隆及RNA干扰载体构建[J]. 林业科学,2016,29(29):283-288.
[16] 王仕利,曹福祥,王猛,等. 松材线虫基因研究进展[J]. 中南林业科技大学学报,2009,29(3):195-198.
[17] JONES J T,MONES M,MOTA M,.: opportunities in comparative genomics and molecular host-parasite interactions[J]. Mol Plant Pathol,2008,9(3):357-368.
[18] SANTOS C S,PINHEIRO M,SILVA A I,. Searching for resistance genes tousing high throughput screening[J]. BMC Genomics,2012,13(1):599.
[19] KIKUCHI T COTTON J A,DALZELL J J,. Genomic insights into the origin of parasitism in the emerging plant pathogen[J]. PLoS Pathog,2011,7(9):e1002219.
[20] 马海宾. 松材线虫纤维素酶系及其cDNA基因的克隆与RNA干扰研究[D]. 北京:中国林业科学研究院,2008.
[21] KIKUCHI T,SHIBUYA H,AIKAWA T,. Cloning and characterization ofexpressed in the esophageal gland of the pine wood nematode[J]. Mol Plant-microbe Interact,2006,19(3):280-287.
[22] IZARD J W,DOUGHTY M B,KENDALL D A. Physical and conformational properties of synthetic idealized signal sequences parallel their biological function[J]. Biochemistry,1995,34(31):9904-9912.
[23] 杨运桂,徐京宁,胡泰山. 信号肽疏水性的提高促进青霉素G酰化酶分泌[J]. 生物化学与生物物理学报,2000,32(2):163-168.
Cloning and Bioinformatics Analysis of1 Gene from
QIU Xiu-wen1,2,3,ZHOU Gui-xiang1,2,3,WANG Hui-juan3,YANG Li-li3
( 1. Poyang Lake Eco-economy Research Center, Jiujiang University, Jiujiang 332005, China; 2. Jiujiang Key Laboratory of Basin Management and Ecological Protection, Jiujiang University, Jiujiang 332005, China; 3. School of Chemistry and Environmental Engineering, Jiujiang University, Jiujiang 332005, China)
1 gene sequence fromcDNA as a template was amplified and cloned by RT-PCR.1 gene (795bp) was successfully cloned with GC content of 50.44% and encode of 252 amino acids. The cloned sequence had 98% similarity to the pel1 gene previously published in the GenBank (ID: AB232908.1). Phylogenetic analysis showed that1 had high homologies with that fromand.1 gene encode from 0 to 25 sequences may be transmembrane structure, while the other sequences outside membrane. The secondary and tertiary structures were abundant in random coils and beta helix. The signal peptide cleavage sites locate between No. 17 to No. 18 amino acid and performs biological effects at extracellular.
;1 gene; clone; bioinformatics
10.3969/j.issn.1001-3776.2018.04.002
S763
A
1001-3776(2018)04-0008-07
2017-12-25;
2018-05-25
国家自然科学基金项目(31660205);江西省自然科学基金项目(20161BAB214152,20151BAB213018)
邱秀文,副教授,从事森林病理相关研究;E-mail:qiuxiuwen3@163.com。
周桂香,副教授,从事森林生态相关研究;E-mail:727424712@163.com。
