慢性乙型肝炎、肝硬化和肝衰竭患者肠道菌群变化研究*
2018-11-09郑婷婷蒋珊珊方钟燎陈茂伟
郑婷婷,蒋珊珊,方钟燎,陈茂伟
近年来,有研究表明肠道微生态系统与疾病的发生发展和转归有一定的联系[1]。国内外多项研究发现肝病患者存在不同程度的肠道菌群失调和肠黏膜生物屏障破坏,而在肝衰竭(LF)伴有相关并发症的患者中尤为明显,因此提出了“肠-肝轴”的概念[2]。为了解HBV感染导致的肝病患者肠道菌群的变化特点,我们应用宏基因组学中的高通量16SrDNA测序法分析了慢性乙型肝炎(CHB)、肝硬化(LC)和LF患者的肠道菌群,旨在阐明肠道菌群在肝病发展中的作用,探讨随着肝功能的改变,肠道微生态是否发生动态变化甚至失衡,现报道如下。
1 资料与方法
1.1 标本来源 2016年3月~2017年3年广西医科大学第一附属医院住院的CHB患者23例,男性15例,女性 8例,平均年龄(32.45±13.17)岁;失代偿期LC患者20例,男性9例,女性11例,平均年龄(44.28±5.35)岁;LF患者6例,男性4例,女性2例,平均年龄(50.28±9.84)岁和成年健康人9例,男性5例,女性4例,平均年龄(37.28±12.08)岁。诊断参照2015年版《慢性乙型肝炎防治指南》或2012年版《肝衰竭诊治指南》。排除标准:(1)近1个月内使用过抗生素或微生态调节剂等影响肠道微生态的药物者;(2)近1个月内发生过除HBV以外的其他病毒、细菌、真菌感染者;(3)近1个月内有过腹泻或肠道疾病史者;(4)素食者。
1.2 粪便基因组16SrDNA测定 采集粪便时,避免尿液污染,用一次性采样勺采集新鲜粪便放入冰盒,立即转运至实验室,称取约200~220 mg,分装于EP管,迅速转移至-80℃冰箱冻存。为防止肠道菌群DNA降解,以上采集和分装过程在30 min内完成。将粪便200 mg与GSL缓冲液1.4 ml混匀,置于70℃温浴内孵育5 min,旋涡15 s,12000 r/m离心1 min,加入蛋白酶proteinase K 15 μl和GB缓冲液200 μl,70℃温浴箱内孵育10 min,无水乙醇沉淀DNA过柱洗脱后溶解于TB洗脱缓冲液50 μl中。为增加基因组DNA得率,收集的溶液再次加入吸附柱GR2中,温室静置,12000 r/m离心2 min,-20℃保存。采用QubitFluorometer荧光剂检测DNA浓度,将样品在冰上融化,充分混匀并离心,取适量样品进行检测。采用琼脂糖凝胶电泳检测DNA的完整性。检测参数:胶浓度:1%;电压:150 V;电泳时间:40 min。检测的58例样品均为A类质量,符合构建DNA文库及测序的要求。将DNA样品送深圳华大基因公司,使用illuminaMiseq平台测序,将序列加在DNA片段的两端以构建文库,将文库中的DNA加载于流动细胞槽上,文库两端的通用接头与流动细胞槽基底上的寡聚核苷酸序列互补配对。以流动细胞槽表面所固定的接头为模板,进行桥式扩增,形成一个簇(cluster),采用边合成边测序法测16SrDNA序列。将原始测序数据经过去除接头污染reads[默认adapter序列与read序列有15 bp的重叠(overlap),因此设置为15 bp,允许错配数为3];去除低质量reads(默认 read 长度的 20%,设置 15 bp);去除低复杂reads(默认read中某碱基连续出现的长度>10,设置10 bp),最终得到清除数据(clean data)。
1.3 统计学分析 应用SPSS 20.0统计学软件进行分析,组间肠道菌群的差异性分析采用单因素方差分析,P≤0.05表示差异有统计学意义。应用COPE软件(connecting overlapped pair-end)分析,将不同相似度的序列归并到不同的操作分类单元(operational taxonomic units,OTU)。然后,通过OTU注释完成OTU的物种分类。应用mothur(v1.31.2,http://www.mothur.org/)[3]软件包对OTU 物种进行注释,结合微生物物种组成信息综合分析,得到特定样品中每个微生物物种的丰度信息。
2 结果
肠道菌种变化指肠道微生物群落中菌群种类的改变情况。本文根据各样本基因检测结果并与肠道菌群基因数据库进行比对,运用OTU进行肠道菌种分类,通过物种注释分析对58例样品中OTU进行种属分类学鉴定,统计每2个样品在门、纲、目、科、属、种水平上的构成。鉴于纲、目、科分类,发现其水平与门水平未显现出显著性差异,而种水平菌种数量繁多,因此我们选取具有代表性的门和属水平进行分析,结果如下。
2.1 门分类等级细菌分布情况 在门分类水平,健康组、CHB组、LC组和 LF组均以厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为主。广古菌门(Euryarchaeota)仅在健康人群中存在,梭杆菌门(Fusobacteria)在除LF组外的其他各组均有出现,且均较健康人体内的数量多(图1)。
2.2 属分类等级细菌分布情况 在属分类水平健康组、CHB组、LC组和LF组(图2)中,共鉴定出100余种菌属。每个样本均以拟杆菌属(Bacteroidetes)为主,其次为普氏菌属(Prevotella)、梭菌属(Fusobacterium)。此外,氨基酸球菌属(Acidaminococcus)和明串珠菌属(Leuconostoc)仅在CHB组、LC组和LF组中出现。异斯氏菌属(Alloscardovia)仅在健康组中出现。

图1 各组门分类水平物种细菌分布profiling柱状图
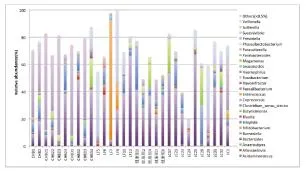
图2 各组属分类水平物种细菌分布profiling柱状图
2.3 门分类水平菌群结构比较 四组菌群结构在门分类水平上有较大的差异,其中CHB组拟杆菌门(bacteroidetes)丰度(617.83)多于 LC 组(343.16)、LF组(182.15)和健康组(236.66),LC组变形菌门(proteobacteria)丰度(183.16)较 CHB 组(35.86)、LF组(18.87)和健康组(53.40)增多,LC 组厚壁菌门(firmicutes)丰度(402.58)与 LF组丰度(395.23)相似(表1)。具体差异有无统计学意义尚待进一步分析。
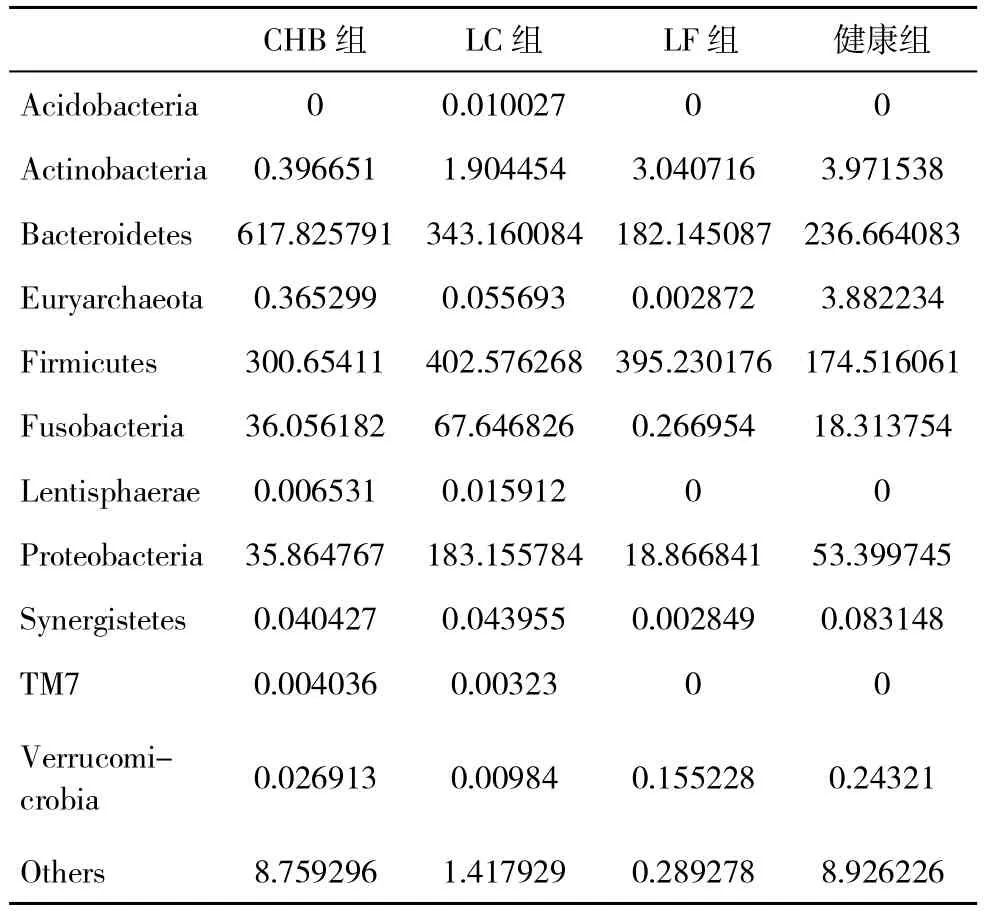
表1 各组门分类水平菌种丰度
2.4 各组属分类水平菌群结构比较 CHB组、LC组、LF组和健康组均以拟杆菌属(bacteroidetes)为主,其中LC组拟杆菌属丰度(150.28)较CHB组(184.53)、LF 组(175.07)和健康组(290.28)减少,CHB组普氏菌属(prevotella)丰度(345.28)比 LC 组(46.75)、LF 组(5.63)和健康组(20.14)增多,LF 组韦荣氏球菌属(veillonella)丰度(120.62)多于 CHB组(22.28)、LC 组(102.97)和健康组(1.46)。
2.5 样品组间显著性差异分析 在门分类水平,CHB和LF患者拟杆菌门丰度显著高于健康人(P<0.05),而LC患者与健康人比,无显著性差异(P>0.05);LC患者变形菌门丰度显著高于LF(P=0.006),LF患者变形菌门高于健康人和CHB患者(P<0.05),其余无统计学意义;在属分类水平,CHB患者拟杆菌属、普氏菌属、shuttleworthia属丰度较健康人(为0)增加(P<0.05),希瓦氏菌属和噬胆菌属丰度比健康人减低(P<0.05);LC 组和 LF组 Blautia属、普氏菌属、噬胆菌属丰度均比健康人减少(P<0.05)。同时,LC组Oribacterium、Selenomonas和 LF 组 Ruminococcus、Roseburia、Parabacteroides、Odoribacter、Holdemania菌属缺失(丰度为0);LC患者粪球菌属丰度比CHB患者少(P=0.04);LF患者粪球菌属、十八梭菌属较CHB患者丰度减少(P<0.05),其余无统计学意义。
3 讨论
肠道微生态系统是人体最大的微生态系统,含有人体最大的贮菌库[4]。人体肠道栖居着数千种微生物,其菌种达到1000多种,约为人体自身细胞数目的10倍[5]。以厚壁菌门(Frimicutes)和拟杆菌门(Bacteroidetes)两类为主,总数超过90%[6]。我们应用OTU在门、属分类水平上对HBV感染性肝病患者肠道菌群进行分析,并应用统计学方法分析肠道菌群在各组间的丰度差异性,分析出导致样品组成差异的物种。结果发现,门、属分类上总体趋势以拟杆菌(Bacteroidetes)主,与近年来许多研究结果相符[6]。我们在门分类水平研究中发现在CHB组拟杆菌门丰度最多,在LC组变形菌门最多。拟杆菌属于革兰氏阴性菌,当其死亡溶解后会释放出细胞壁中的脂多糖,有可能与CHB患者常伴发的内毒素血症有关[7]。变形菌具有高活性的尿素酶,能分解尿素产生氨,经血液吸收后血氨升高[8]。血氨升高是LC患者发生肝性脑病的常见诱因。梁友方[8]等人研究发现,变形杆菌感染是LC患者高血氨症发生的影响因素之一。
单从门的层面探讨肠道菌群的结构及组间差异是不全面的。门是一个较为大致的分类层面,同一个门下包含多个种属,其中既有有益菌也有致病菌,因此我们选择较为细致的属层面进行分析。研究发现,在属分类上共鉴定出100余种菌属,各研究菌属表现较大的差异性,在健康组和CHB组以拟杆菌属为主,比例在20%~40%,其具有促进上皮细胞成熟、修复上皮组织,帮助营养吸收的作用[9]。有报道称,健康成年人肠道优势菌群主要由拟杆菌和厚壁菌下的优势菌属构成[10],本研究结果与之相符。此外,在CHB组,普氏菌属较健康组丰度增加,而普氏菌属属于拟杆菌门。Tamura et al研究发现,普氏菌表面的LPS可诱导IL-8基因表达,增强炎症反应[11]。据报道,已有20种普氏菌属下的细菌被证明会引起人体多部位感染[12]。本研究发现CHB组和LC组噬胆菌属较健康组减少,考虑为肝病患者胆汁分泌异常和肠道环境不利于其增殖有关。Blautia属和韦荣是球菌属均为产短链脂肪酸(SCFA)菌属[13],而SCFA有保护肠道屏障并改善机体炎症状态的作用[14]。另外,LC组和LF组菌属构成无明显差异,而且大部分菌属较CHB组和健康组丰度缺失,可能因为LC和LF都是肝脏慢性进行性损害的终末表现,肝功能减退和门脉高压造成肠黏膜淤血水肿,一氧化碳(NO)生成增多,引起氧化应激反应和肾上腺素能活性升高,都会损伤肠道黏膜,从而使肠道蠕动减慢,小肠排空时间延长,导致菌群过度生长[15],而这个过程中以革兰阴性菌增多为主[16]。内环境的变化使一些有益菌减少,致病菌增多[17],随着肝功能的减退,菌种多样性减少,趋于单一。研究还发现仅在健康组出现了异斯氏菌属,目前还没有相关研究报道,我们也还不明白其意义。
综上所述,HBV感染患者存在肠道菌群的改变,但越来越多证据显示肠道菌群存在菌群失调,肠道菌群结构和数量的变化是导致疾病进展的一个重要因素[18]。肝脏疾病患者肠道菌群的平衡关系被打乱,肝脏功能降低,炎症反应被激活,肠道菌群失调和肠壁通透陛增加,又进一步加重肝脏负荷,打破“肠-肝轴”的平衡。目前,已证实肠道菌群与炎性肠病[19]、非酒精性脂肪肝[20]、肝硬化[4]等疾病的发生发展密切相关。
