慢加急性乙型肝炎肝衰竭患者外周血IFN-γ基因多态性分析及其临床意义探讨*
2018-11-09王燕吴琦琦庄小芳马燕郭峰王晓波王晓忠
王燕,吴琦琦,庄小芳,马燕,郭峰,王晓波,王晓忠
乙型肝炎病毒(hepatitis B virus,HBV)感染引起的慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是一种公认的致命性肝病症候群,其特征在于肝功能急性失代偿(acute decompensation,AD),导致肝、肾、脑等器官功能衰竭,生存率低(28 d病死率为30%~40%)[1]。尽管临床引入了人工肝支持系统和抗病毒治疗,但是除非进行肝移植,ACLF患者短期预后仍然很差[2]。该病发病机制复杂,目前尚不完全明确,但多数学者认为在HBV感染导致的ACLF发病过程中免疫损伤起到了关键的作用[3]。细胞因子是体液免疫的重要介质,在HBV感染性疾病的发病过程中发挥了重要的作用。γ干扰素(interferon-gamma,IFN-γ)是由活化的炎症细胞产生的多效能的促炎性细胞因子[4],具有抗病毒、抗增殖和免疫调节作用。同时,IFN-γ可诱导肝细胞凋亡或抑制肝细胞周期进程[5]。IFN-γ基因位于染色体12q24上,跨度约为5.4 kb,由四个外显子、三个内含子组成[6],与免疫应答机制的启动和调节关系密切。 IFN-γ基因多态性可通过影响IFN-γ的转录、翻译和表达过程,导致不同个体IFN-γ的产量及宿主免疫功能的差异,从而影响HBV携带者的不同临床转归。IFN-γ的第一个内含子中+874 T/A(rs567588525)位点 TT基因型产生高水平IFN-γ,有助于宿主对病毒感染的防御。相反,基因型TA和AA导致IFN-γ产生水平低,可能增加了病毒感染的风险。此外,含有+874T/A和 +2109A/G(rs34066384)的 DNA序列是 NF-κB转录因子的特异性结合位点,直接影响IFN-γ表达量。如果该通路受到影响,可能会导致氧化损伤[7]。我们分析了HBV感染导致的ACLF患者IFN-γ基因多态性与发病和临床结局的关系,以探讨IFN-γ基因+874位点和+2109位点基因多态性在本病发病中的作用。
1 资料与方法
1.1 研究对象 2016年1月~2017年2月在新疆医科大学附属中医医院住院的由HBV感染导致的ACLF患者51例,男性37例,女性14例;年龄23~75(49±2)岁。严格按照《肝衰竭诊治指南(2012年版)》的标准诊断[8]:即①极度乏力,有明显的消化道症状;②黄疸迅速加深,血清总胆红素(TBIL)大于正常值上限10倍或每日上升≥17.1 μmol/L;③出血倾向明显,PTA≤40%(或INR≥1.5),并排除其他原因导致的凝血功能障碍者。排除合并原发性肝癌、妊娠、肝移植者、有严重心肺肾功能不全及其他恶性肿瘤患者。另选在我院体检的健康人50例,男性30例,女性20例;平均年龄48±2(24~72)岁,既往无肝炎病史,血清肝炎病毒标志物均阴性,HBV DNA阴性,肝功能正常。
1.2 单核苷酸多态性(SNP)分型检测 本实验采用SNaPshot SNP分型技术对101个样本进行2个SNP位点分型。 设计了两对PCR引物用于扩增包含2个位点的2个150~350 bp片段,设计了2个紧邻的SNP位点的延伸引物用于单碱基延伸(+874位点引物,上游引物(F):5’-TCTGGCTTAGG TATCATAA-3’,下游引物(R):5’-GG CTTCATAAAATGAGGG-3’。+2109 位点引物,F:5’-GCAAATG ATTTCTCTCAGC-3’,R:5’-GGAATGAGACAGGTGAGAT-3’)。引物用在线(http://bioinfo.ut.ee/primer3-0.4.0/)Primer3软件设计。PCR产物用Qiagen公司的HotStarTaq进行多重PCR获得,PCR产物经虾碱酶(SAP,from Promega)和外切酶 I(EXO I,from Epicentre)纯化后,用ABI公司的SNaPshot Multiplex kit进行延伸反应。延伸产物用SAP(from Promega)纯化后,在ABI3730xl上样。SNP分型用GeneMapper4.1(Appliedbiosystems)进行分析(以上实验过程由SNP试验公司完成)。
1.3 统计方法 应用 SPSS 23.0软件进行统计分析,计量资料以±s表示,采用t检验或方差分析;计数资料采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 ACLF患者入院时肝功能指标变化 入院时,ACLF患者 ALT为 506.07±709.63 U/L,AST为504.66±623.21 U/L,AKP 为 196.13±219.62 U/L,GGT为121.45±121.07 U/L,TBIL为267.07±144.06 μmol/L,ChE 为 3136.32±2682.00 U/L,ALB 为29.59±5.59 g/L,TG 为 1.81±1.50 mmol/L,TC 为1.39±1.52 mmol/L,GLU 为 5.90±2.15 mmol/L,BUN为 8.06±8.31 mmol/L,Cr为 103.35±99.80 μmol/L,PLT为(113.62±64.42)×109/L,PT 为 23.96±7.41 s,PTA为32.04±10.86%,FIB为1.67±0.80 g/L。
2.2 两组血IFN-γ基因两个位点多态性Hardy-Weinberg平衡检验结果比较 经Hardy-weinberg遗传平衡定律检验,ACLF患者+874位点和+2109位点的实际数与理论数比较,差异均无统计学意义(P>0.05),表明各基因频率已达到遗传平衡,具有群体代表性(表1)。
2.3 两组IFN-γ基因+874位点T/A等位基因及基因型分布频率比较 ACLF患者+874位点TA+AA基因型频率显著高于健康人(P<0.05),提示TA+AA基因型患ACLF的风险是TT基因型的2.363倍(OR=2.363,95%CI:1.057~5.281);+874 位点 A 等位基因频率显著高于健康人(P<0.05),提示A等位基因患ACLF的风险是T等位基因的2.195倍(OR=2.195,95%CI:1.182~4.076,表 2)。
2.4 两组IFN-γ基因+2109位点A/G等位基因及基因型分布频率比较 ACLF组+2109位点AG+GG型基因型频率显著高于健康人(P<0.05),提示AG+GG基因型患ACLF的风险是AA基因型的2.96倍;G等位基因型显著高于健康人,提示G等位基因患ACLF的风险是A等位基因的2.51倍(表3)。
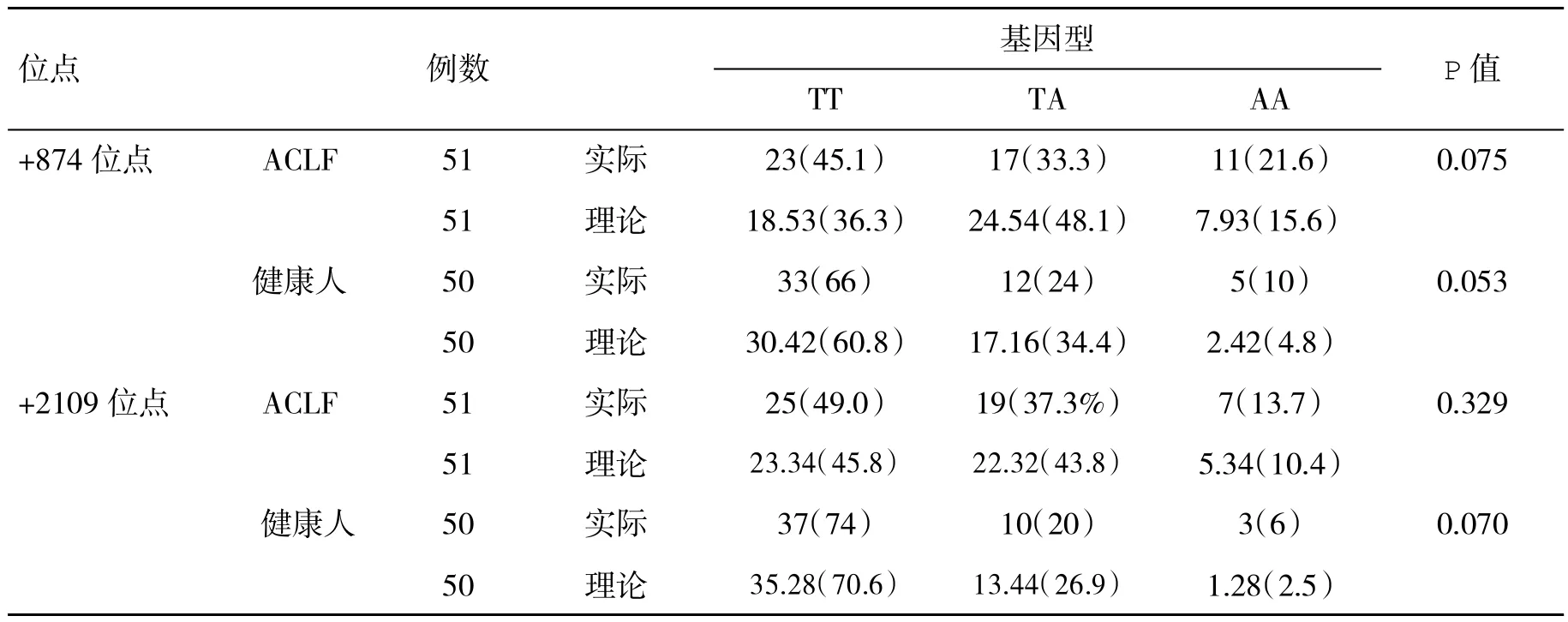
表1 两组血IFN-γ基因两个位点多态性Hardy-Weinberg平衡检验结果(%)比较

表2 两组血IFN-γ基因+874位点T/A等位基因和基因型分布频率(%)比较
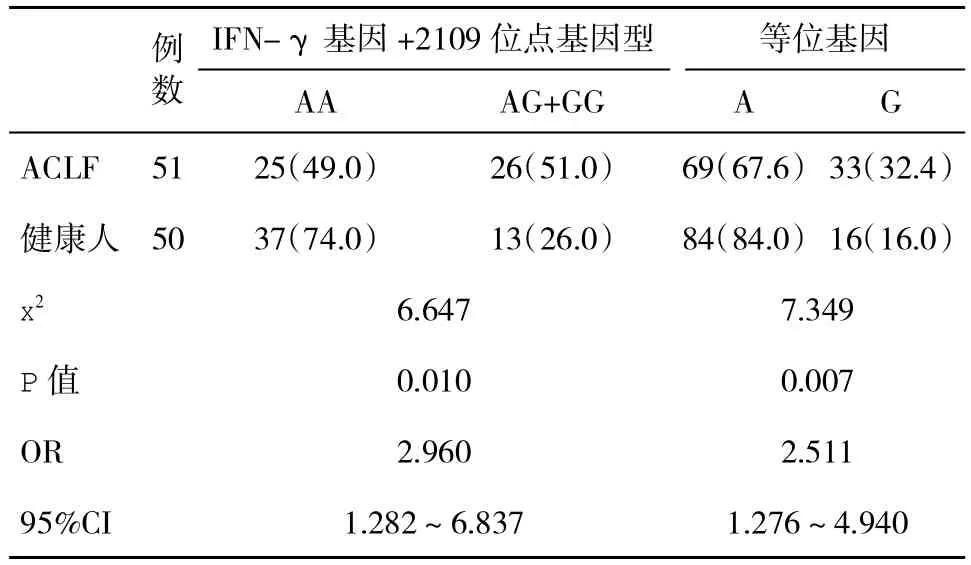
表3 IFN-γ基因+2109位点A/G等位基因及基因型分布频率(%)比较
2.5 不同IFN-γ基因型ACLF患者Child-Pugh评分和MELD评分比较 依据患者入院后的首次实验室检测结果,计算患者Child-Pugh评分和MELD评分。结果显示,IFN-γ基因+874位点与+2109位点各基因型间Child-Pugh评分和MELD评分均无统计学差异(P>0.05,表 4、表 5)。
2.6 不同临床结局ACLF患者血IFN-γ基因+874位点和+2109位点等位基因和基因型分布频率比较 在治疗3个月末,ACLF患者生存28例,死亡23例(45.1%)。两组IFN-γ基因+874位点、+2109位点基因型及等位基因分布频率均无显著性差异(P>0.05,表 6、表 7)。
表4 不同IFN-γ基因+874位点基因型ACLF患者两项评分(±s)比较

表4 不同IFN-γ基因+874位点基因型ACLF患者两项评分(±s)比较
IFN-γ基因+874位点基因型(n=51)TT(n=23) TA(n=17) AA(n=11)Child 评分 11.04±1.692 10.88±1.536 11.45±1.293 MELD 评分 26.00±4.796 24.53±4.810 27.36±6.153 F 0.457 1.057 P 0.636 0.355
表5 不同IFN-γ基因+2109位点基因型ACLF患者两项评分(±s)比较

表5 不同IFN-γ基因+2109位点基因型ACLF患者两项评分(±s)比较
IFN-γ基因+2109位点基因型(n=51)AA(n=25) AG(n=19) GG(n=7)Child 评分 10.80±1.291 11.21±1.843 11.71±1.496 MELD评分 25.44±5.723 26.42±4.426 25.43±5.159 F 1.044 0.088 P 0.360 0.916
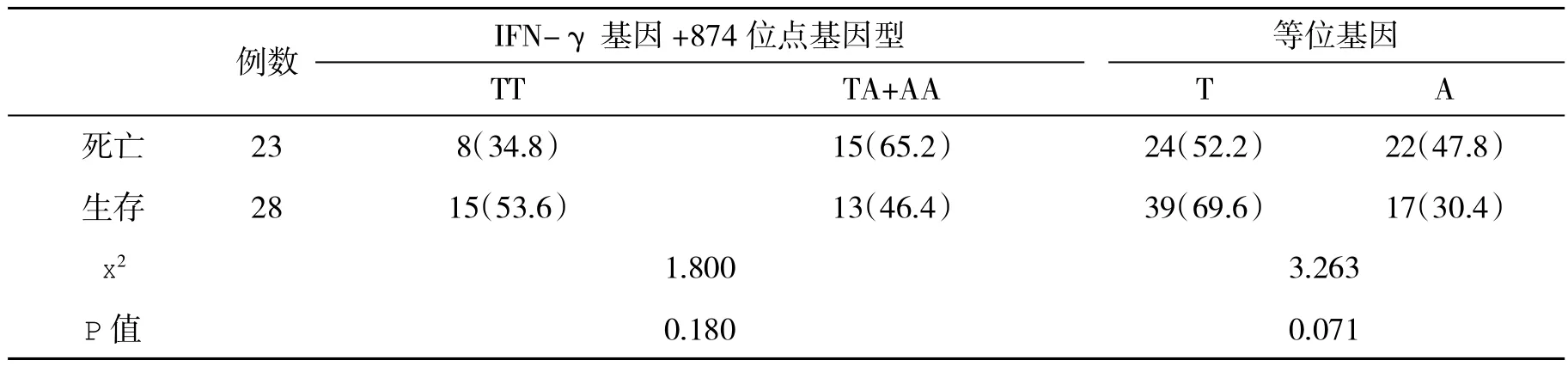
表6 两组ACLF患者IFN-γ基因+874位点T/A等位基因及基因型分布频率(%)比较

表7 两组ACLF患者IFN-γ基因+2109位点A/G等位基因及基因型分布频率(%)比较
3 讨论
HBV感染已被确定为亚太地区ACLF的主要病因[9]。ACLF是慢性乙型肝炎(CHB)患者短期病死率升高的主要因素。HBV感染后的表现是由病毒和宿主的相互作用决定的,细胞介导的免疫反应参与病毒的清除以及在此期间的疾病发病过程,细胞因子如白细胞介素(interleukin,IL)-6、IL-8、IL-10,肿瘤坏死因子 α (tumor necrosis factor,TNF-α),IFN-γ 等与 ACLF 患者疾病临床预后和肝细胞坏死密切相关[10]。其中辅助性T淋巴细胞分泌的IFN-γ在诱导病毒清除方面发挥重要的作用[11]。IFN-γ作为抗原提呈细胞和淋巴细胞增殖、分化的调节剂,参与细胞炎症反应和抗病毒免疫,高表达量的IFN-γ对病毒的清除有重要作用。在宿主早期特异性防御阶段,IFN-γ释放增加T细胞的细胞毒性和自然杀伤细胞活性,增强细胞免疫应答。在随后的抗原特异性免疫应答阶段,IFN-γ可作为抗原呈递、增殖以及淋巴细胞分化的调节剂[12]。IFN-γ各位点基因多态性可以影响IFN-γ表达,并以此方式影响免疫应答过程[13]。
本研究对新疆地区51例ACLF患者和50例健康人血IFN-γ基因+874位点和+2109位点多态性进行了分析。结果显示ACLF组TA+AA基因型频率(54.9%)显著高于健康人(24.0%),提示TA+AA基因型患ACLF的风险比TT基因型高2.365倍。同时,T/A等位基因分布频率在ACLF(T:61.8%,A:38.2%)和健康人(T:78.0%,A:22.0%)间有明显的差异,A等位基因患ACLF的风险是T等位基因的2.195倍,表明A等位基因和基因型是ACLF的遗传易感基因。健康人T等位基因和基因型频率显著高于ACLF组,由于T等位基因与IFN-γ的产量增加相关,从而使宿主免受疾病的侵扰[14,15]。
+2109位点位于IFN-γ基因的第3内含子区,此区的多态性能够调节核因子与IFN-γ基因的结合,从而可能会影响IFN-γ mRNA表达水平[15]。在AA、AG、GG 基因型中,GG基因型是慢性活动性肝病的易感基因型。本研究结果显示,AA、AG+GG基因型频率在ACLF患者(49.0%,51.0%)和健康人(74.0%,26.0%)之间有明显的差异,提示AG+GG基因型人群患HBV-ACL F的风险是AA基因型的2.96倍。ACLF组G等位基因频率(32.4%)显著高于健康人(16.0%),提示携带G等位基因的人群患ACLF的风险是A等位基因的2.511倍,IFN-γ+2109位点G基因型和等位基因可能影响机体免疫抗病毒过程。但尚不清楚+2109位点基因多态性的A至G转换是如何影响IFN-γ基因转录的[16]。
研究表明,IFN-γ可以促进细胞吞噬、促使病原体被杀灭、干扰病毒生长,是肝脏免疫病理损伤的重要效应分子。在ACLF患者,血清IFN-γ水平高于慢性乙型肝炎患者和正常人群[17]。由于I型干扰素(IFNs)主要由树突状细胞(DC)产生,DCs的数量和功能与ACLF患者的预后密切相关。所以,在ACLF发病初期IFN-γ呈高水平表达,经过治疗后IFN-γ水平降低,IFN-γ水平与病情进展和预后呈正相关关系[18]。本研究比较了ACLF患者三个月的临床结局,结果显示,IFN-γ基因多态性与患者临床结局差异无统计学意义。由于肝衰竭发生和发展是由多因素参与的一个复杂过程,病情发展过程变化迅速。既往研究提示肝衰竭进展至中晚期时,常常合并多种并发症,且并发症间可相互影响,从而加重肝衰竭患者病情进展,进一步增加了死亡的风险。本研究仅用入院后第一次的实验室数据进行肝衰竭预后评分,分析预后评分与IFN-γ基因多态性的关系,尚缺乏对疾病预后的动态性预测,因此其可靠性受到了影响。
由于 IFN-γ基因还存在其他位点的SNP,且这些多态性与 IFN-γ表达和分泌的关系还不明确。同时,ACLF的临床表现复杂多变,受基因、机体免疫和环境因素共同作用的影响。IFN-γ基因多态性与 HBV ACLF发病的关系及该位点不同基因型与其他细胞因子的相互作用,还需要更深入的研究。
