金黄色葡萄球菌定量质控菌株的制备及其在检验工作中的应用
2018-11-09解慧
解 慧
(天津市药品检验研究院,天津 300070)
实验室数据可靠性和有效性是检验工作和科学研究的生命线。利用微生物标准菌株进行检验方法学验证试验越来越受到重视,继《中国药典》要求进行微生物检验方法适用性试验后,保健食品和化妆品风险监测工作中也提出相关要求。利用标准菌种作为参考标准物质,进行药品、保健食品和化妆品微生物检验过程控制,是保障检验结果科学准确的重要环节,《中国药典》、保健食品和化妆品风险监测工作手册等均有明确要求[1-3]。微生物检验方法学适用性试验需要用到一定数目的标准菌株,传统的梯度稀释方法操作繁琐,工作量较大。目前,市售国内外质控菌株类型较少,多使用ATCC菌株或《中国药典》常用菌株,且价格昂贵,使检验成本提高。微生物定量质控菌株是考查实验室检验结果准确、可靠的重要工具,适用于食品、药品微生物检测的定量质控菌株是制约微生物检验标准化的一个瓶颈。
本研究通过优化培养条件和流程,制备金黄色葡萄球菌定量质控菌株,并对其均匀性、稳定性和保存条件进行考查,证明其能满足质控样品使用的要求,可以用于日常检验工作中的阳性对照试验和微生物限度检查方法学适用性试验,还可用于实验室内质量控制比对试验。
1 仪器与试药
1.1仪器 生物安全柜(BAKER SG-403A TX-INT),天平(sartorius TE612-L),恒温培养箱(BINDER KB720),恒温摇床(Thermo MaxQ 4000),冷冻干燥机(HETO POWER DRY LL1500),低速自动平衡离心机(Eppendof Centrifuge 5702),冰箱(Hair BCD-268DA),低温冰箱(Froilabo Congelateur)。
1.2试药D-海藻糖(Solarbio,批号411B054),脱脂奶粉(Solarbio,批号408B0513),胰酪大豆胨液体培养基(TSB,北京陆桥有限责任公司,批号151027),胰酪大豆胨琼脂培养基(TSA,北京陆桥有限责任公司,批号151202),磷酸盐缓冲液 PBS(北京奥博星生物技术有限责任公司,批号20140822),金黄色葡萄球菌(Staphylococcusaureus)[CMCC(B) 26 003] 购自中国食品药品检定研究院。
2 方法
2.1金黄色葡萄球菌的生长曲线测定 将甘油管保存的菌株接种至10 ml TSB培养基中,36 ℃培养18 h,使菌株充分复苏。吸取0.1 ml培养物接种于新鲜的10 ml TSB培养基中,36 ℃培养过夜,作为种子液。吸取1 ml种子液接种于新鲜的100 ml TSB培养基中,36 ℃、180 r/min培养。每隔2 h,无菌条件下吸取5 ml培养液,于600 nm处测定吸光度,绘制金黄色葡萄球菌的生长曲线。
2.2金黄色葡萄球菌质控菌株的制备流程 按“2.1”步骤制备金黄色葡萄球菌新鲜培养物,4 400 r/min离心5 min,倾倒上清,PBS清洗一次,4 400 r/min再次离心5 min获得菌体。采用5%脱脂奶粉+5%海藻糖作为保护剂[4],使菌体充分悬浮混匀。分装至西林瓶中,-20 ℃预冻4 h,使混悬液冷冻凝结。放入真空冷冻干燥机,待样品充分干燥后取出。将透气棉塞更换为无菌橡胶塞,密封冷藏。以此方法制成106cfu含菌量和104cfu含菌量的样本,冷冻干燥后保存。
2.3离心和清洗损失率的测定 取种子液1 ml接种于新鲜的100 ml TSB培养基中,于摇床中180 r/min、36 ℃培养4 h,此时的混悬液作为样品1。取部分上述培养物4 400 r/min离心5 min,倾倒上清,PBS清洗一次,4 400 r/min再次离心5 min获得菌体。采用5%脱脂奶粉+5%海藻糖作为保护剂[4],使菌体充分悬浮混匀,此时的混悬液作为样品2。对样品1和样品2分别进行梯度稀释,测定活菌数,分别记为A和B。则计算公式为:离心和清洗损失率=(1-B/A)×100%。
2.4冷冻干燥损失率的测定 待样品在冷冻干燥机冻干后,取出,立刻取其中一瓶作为样品3。梯度稀释后,测定活菌数,记为C。则计算公式为:冷冻干燥损失率=(1-C/B)×100%。
2.5金黄色葡萄球菌质控样品的均一性验证 106cfu 含菌量样本均一性验证:随机抽取106cfu组质控样品10瓶,每瓶加入1 ml 生理盐水,将金黄色葡萄球菌冻干物充分溶解,吸取0.1 ml进行适当梯度稀释后,取1 ml于平皿中,倾注TSA培养基,置36 ℃培养18~24 h。进行菌落计数。同法进行104cfu组质控样品计数。
2.6储藏条件的验证 将制备的106cfu和104cfu金黄色葡萄球菌质控样品分别保存于4 ℃、-20 ℃和-80 ℃。于0~90 d及1年分别取出金黄色葡萄球菌质控样品进行菌落计数,观察复苏率的变化,考查贮藏稳定性。
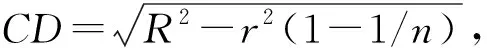
其中R为复现性限,r为重复性限,n为检测值的数量。
2.8定量质控菌株的活力检测 参照《中国药典》2015版四部通则1105非无菌产品微生物检查:微生物计数法,选择8种药品,分别采用-80 ℃保存的106cfu样品和正常制备工作菌株,进行回收率测定。所采用药品各取10 g,分别加pH 7.0氯化钠蛋白胨缓冲液稀释至100 ml,混匀,作为1∶10供试液。具体实验方法如下。
2.8.1吲达帕胺滴丸 取1∶10供试液9.9 ml,加入适量浓度的0.1 ml金黄色葡萄球菌菌液,制成菌含量<100 cfu/ml的供试液,取1 ml至平皿中,立即倾注TSA。
2.8.2脉管康复片 取1∶10供试液9.9 ml,加入适量浓度的0.1 ml金黄色葡萄球菌菌液,制成菌含量<1 000 cfu/ml的供试液,取0.1 ml至平皿中,立即倾注TSA。
2.8.3生脉饮/盐酸二甲双胍片 取1∶10供试液9.9 ml,加入适量浓度的0.1 ml金黄色葡萄球菌菌液,制成菌含量<2 000 cfu/ml的供试液,取0.5 ml至平皿中,立即倾注TSA。
2.8.4厄贝沙坦氢氯噻嗪分散片/醒脑安神胶囊 取1∶10供试液9.9 ml,加入适量浓度的0.1 ml金黄色葡萄球菌菌液,制成菌含量<5 000 cfu/ml的供试液,取0.2 ml至平皿中,立即倾注TSA。
2.8.5清咽滴丸 取1∶10供试液0.2 ml用pH 7.0无菌氯化钠蛋白胨缓冲液100 ml稀释后,全量薄膜过滤,用500 ml pH 7.0无菌氯化钠蛋白胨缓冲液分次冲洗5次,在最后一次冲洗液中加入规定量试验菌(不大于100 cfu)后薄膜过滤,取膜贴于TSA上,依法检查。
2.8.6盐酸沙格雷酯片 将1∶10供试液全量置于带过滤功能均质器专用袋(上新牌,规格30 cm×19 cm)大体积一侧中,在拍打仪中充分拍打30 s。取粗滤后小体积一侧的1∶10供试液0.2 ml薄膜过滤,用pH 7.0无菌氯化钠蛋白胨缓冲液500 ml分次冲洗,并在最后一次冲洗液中加入规定量试验菌(不大于100 cfu),取膜贴于TSA上,依法检查。
3 结果
3.1金黄色葡萄球菌生长曲线 把少量微生物接种到一定体积的新鲜培养基后,在适宜的温度、通气等条件下,微生物就会从小到大,数目增多,表现出有规律的生长,根据其生长速率常数可以得出生长曲线。典型的微生物生长曲线包括延滞期、指数期(对数期)、稳定期和衰亡期。通过定时取样,测定600 nm处的吸光度发现,按1%接种量,180 r/min、36 ℃培养条件下,金黄色葡萄球菌在2 h左右进入对数期,6 h后进入稳定期,此时菌体数目约为1.0×109cfu(如图1)。指数期的微生物代谢活跃,生长迅速,生理特性较一致,各细胞成分平衡增长,因而是代谢、生理研究的好材料。因此采用1%接种量,180 r/min、36 ℃培养4 h,制备金黄色葡萄球菌菌体。
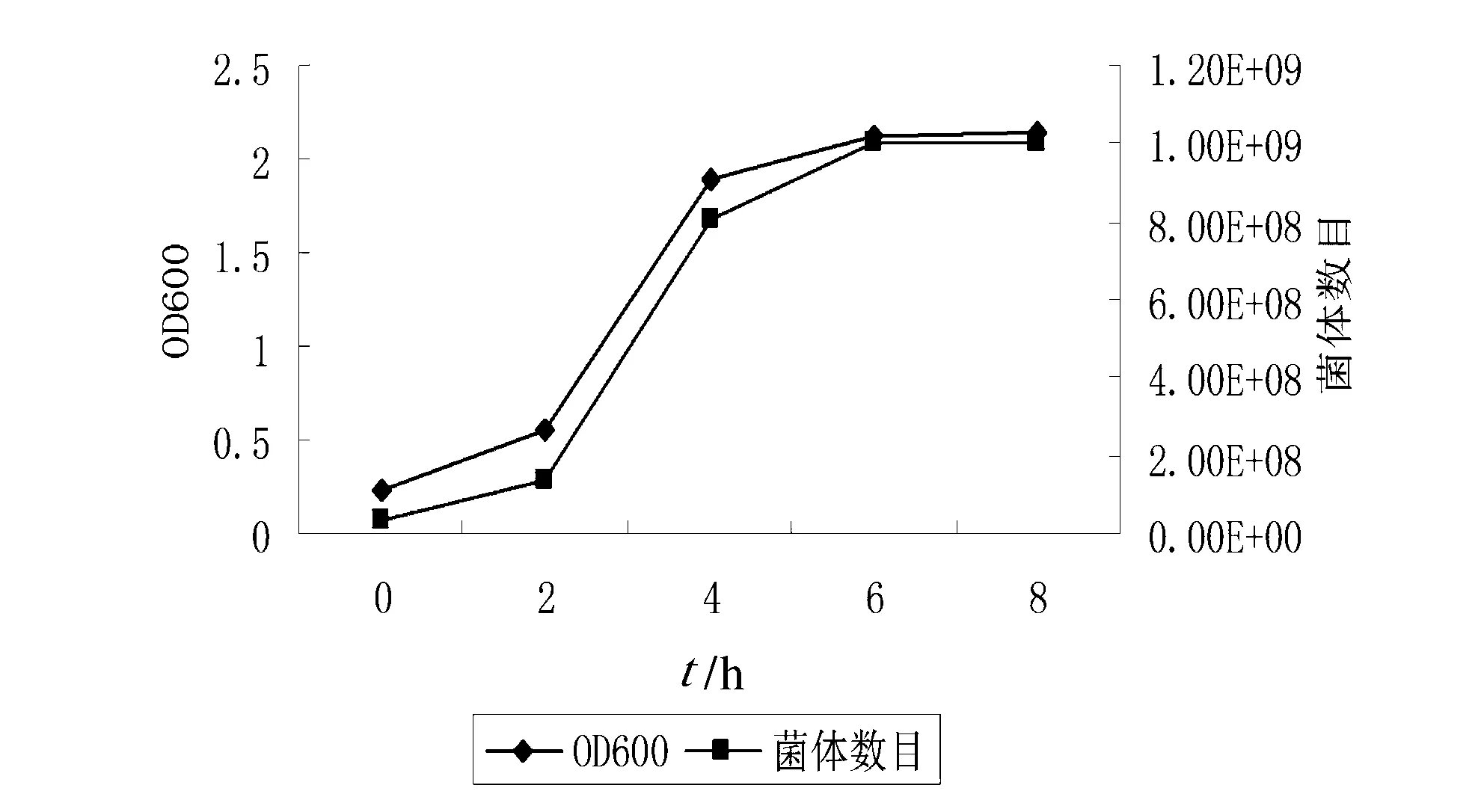
图1 金黄色葡萄球菌的生长曲线
3.2定量质控菌株的制备 保护剂可以减少冷冻干燥引起的微生物细胞损伤。常见的保护剂包括葡萄糖、谷氨酸等中性或酸性化合物,明胶和藻类等高分子物质及分解物,脱脂乳及血清等天然混合物,及抗坏血酸和羟胺等[6]。脱脂奶粉的主要成分是蛋白质和糖类,其中蛋白质的直径在1~2 nm之间,溶于水中形成胶体溶液,蛋白质分子比细菌小得多,在菌体外形成蛋白膜,对细胞加以保护,并可固定冻干酶类,防止由于细胞壁蛋白质损坏而引起的胞内物质泄漏,而且脱脂奶粉中其他成分(如乳糖等) 同样可提高菌体的冻干存活率。海藻糖具有特殊的水合作用,能够稳定细胞膜和蛋白质结构,抗逆保鲜,在冷冻干燥生物制品方面具有广阔的应用前景。本研究使用5%脱脂奶粉和5%海藻糖作为保护剂,制成106cfu含菌量、104cfu含菌量的冻存管,冻存菌体经活化证明均保持了较好的活性。离心和清洗过程对菌体细胞的损失率较大,约为95%。冷冻干燥过程同样造成菌体细胞的减少,损失率约为37%。
3.3质控样品的均一性检测 复现性临界差值(CD)=0.38(R取0.45,r取0.25,n取10)[5]。106cfu组10瓶样品均一性检测结果如表1显示,样品中金黄色葡萄球菌的平均量为4.6×106cfu,那么控制范围为1.9×106~1.1×106cfu。本实验10组数据均在上述范围内,质控样品中金黄色葡萄球菌的均一性可满足定量需求。104cfu组10瓶样品均一性检测结果如表1显示,样品中金黄色葡萄球菌的平均量为5.5×104cfu,则控制范围为1.3 ×105~2.2×104cfu,本实验所有数据均在上述范围内,质控样品中金黄色葡萄球菌的均一性可满足定量需求。
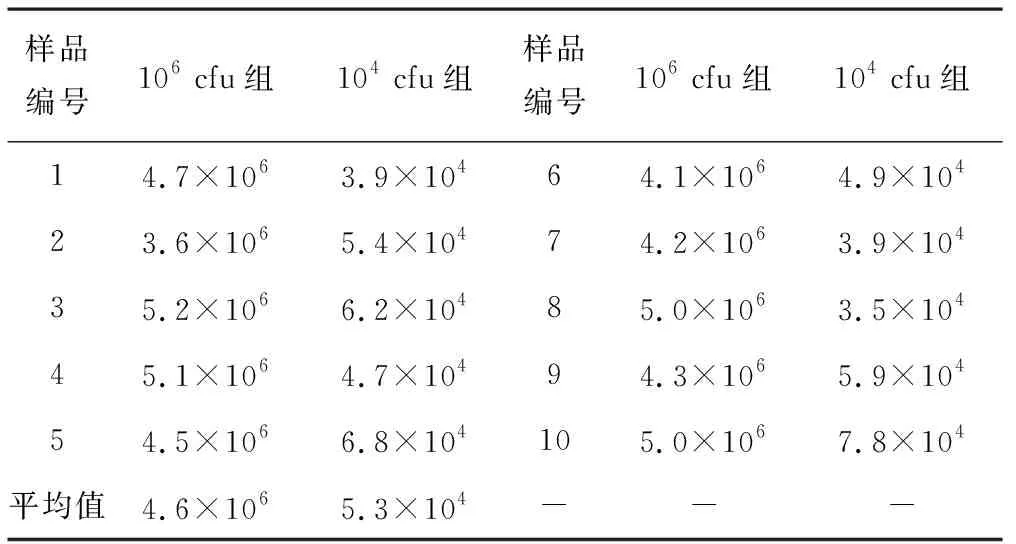
表1 质控样品的均一性检测 cfu
3.4储存条件检测 106cfu组和104cfu组质控样品的储藏稳定性检测结果见表2。根据统计结果,4 ℃保存的106cfu组样品随时间延长,稳定性明显下降,30 d时回收率只能达到51%,60 d的回收率只有15%。说明制备质控样品不适宜放置于4 ℃保存。放置于-20 ℃和-80 ℃保存的两组样品均保持了较好的稳定性,说明低温有助于保持菌体活性,这和微生物菌株定性保存是一样的。长期的稳定性考查,有待试验进一步研究。
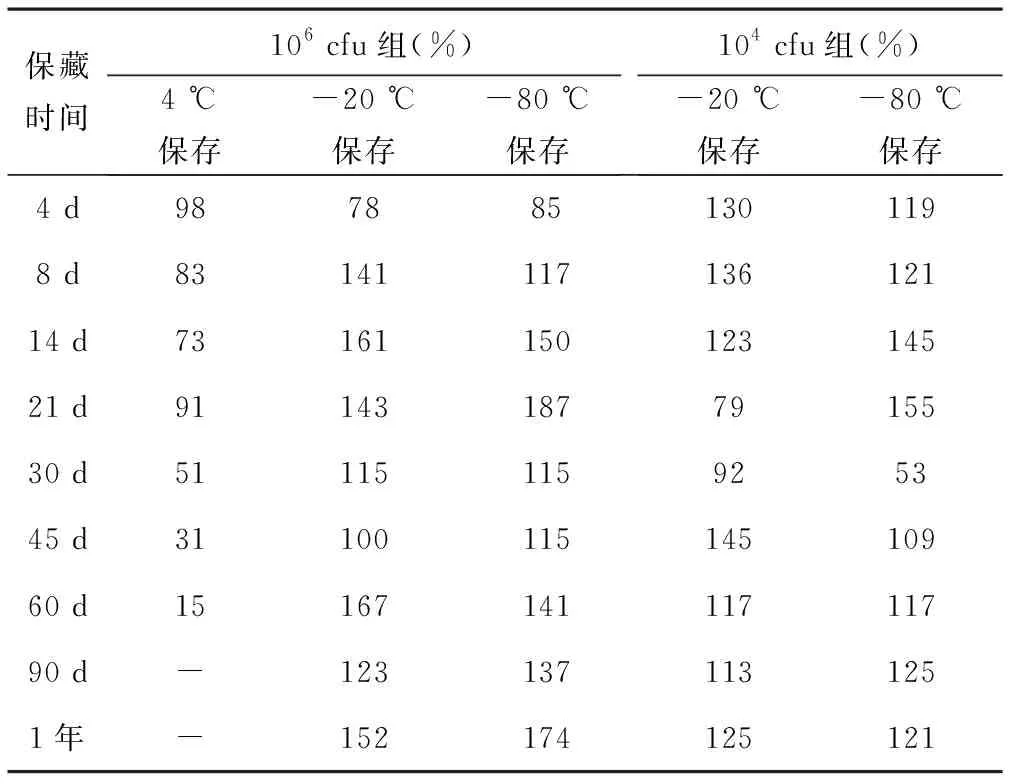
表2 不同温度下储存的定量质控菌株的复苏率
3.5质控样品的室内复现性检测 本实验中采用复现性临界差值判断,复现性临界差值(CD)=0.38(R取0.45,r取0.25,n取13)。106cfu组13瓶样品均一性检测结果如表3显示,样品中金黄色葡萄球菌的平均量为4.7×106cfu,那么控制范围为1.9 ×106~1.1×107cfu(相当于本实验的指定值为6.67,结果控制范围为6.29~7.05)。本实验13组数据均在上述范围内,质控样品中金黄色葡萄球菌的均一性可满足定量需求。104cfu组13瓶样品均一性检测结果如表3显示,样品中金黄色葡萄球菌的平均量为5.6×104cfu,则控制范围为1.3×105~2.3×104cfu(相当于本实验的指定值为4.75,结果控制范围为4.37~5.13)。本实验所有数据均在上述范围内,质控样品中金黄色葡萄球菌的均一性可满足定量需求。
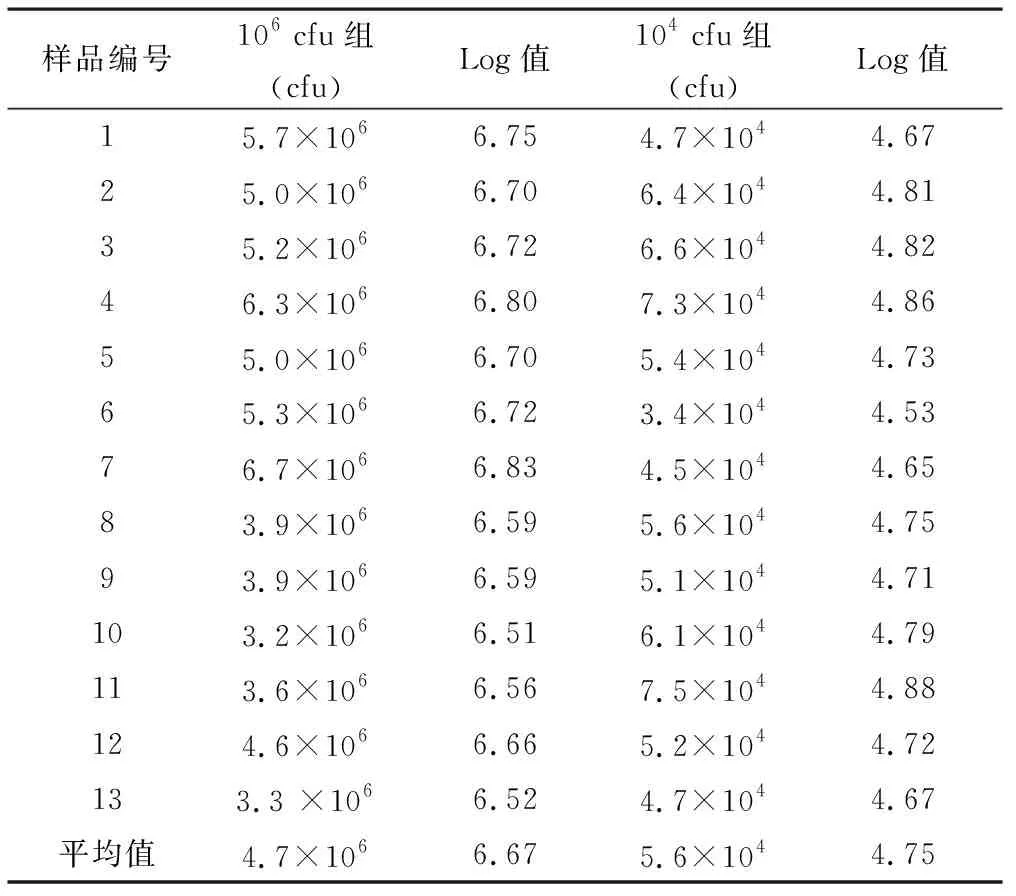
表3 质控样品的室内复现性检测结果
3.6质控样品的活力检查 表4所列的8种样品涵盖了常规法、培养基稀释法和薄膜过滤法处,均为微生物限度检查常用方法。对三次试验的回收率进行平均后,列于表4。可以看出,106cfu组与正常工作菌株的回收率没有明显区别,均符合《中国药典》2015版要求。
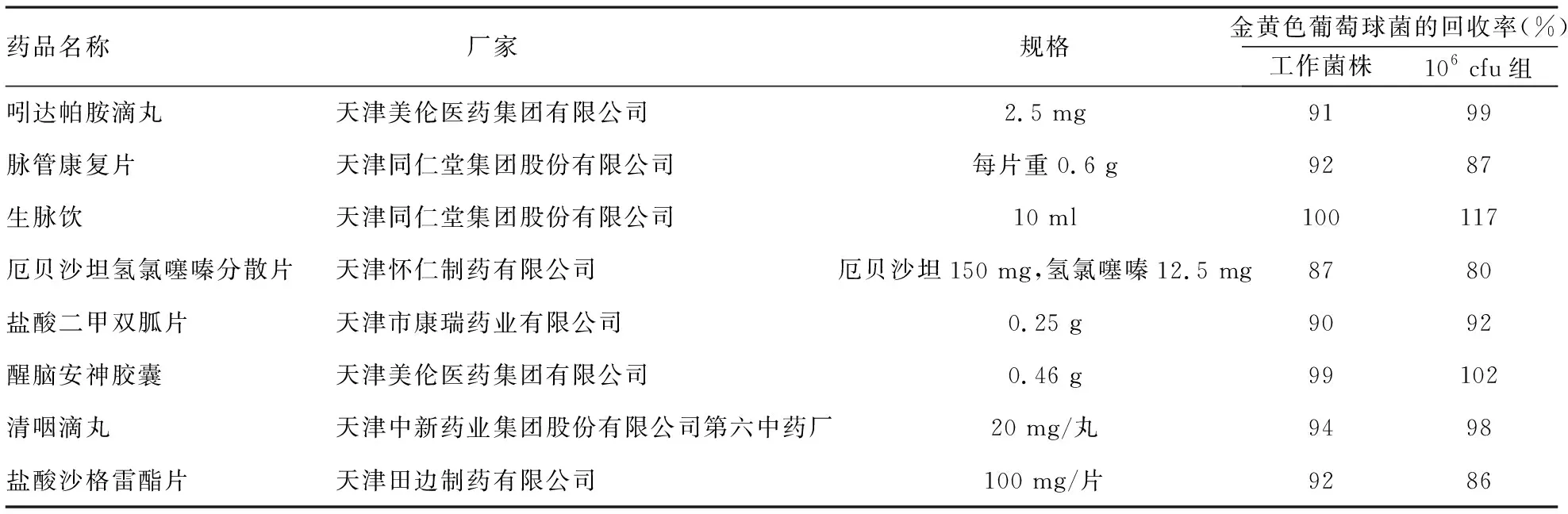
表4 质控样品用于微生物限度计数方法学验证试验
4 讨论
按照预先规定的条件,组织两个或多个实验室(工作人员)对相同或类似的物品进行测量或检测,并对检测结果进行评价,是有效的实验室质量控制手段,也是认可机构确认实验室检测能力的技术手段[7]。通过参加比对实验,有助于实验室(实验人员)了解自身的检测水平,证明检测能力,或者帮助其发现存在问题并采取有效措施进行纠正。近几年,通过参加中国食品药品检定研究院、中国检验检疫科学研究院、英国政府化学家实验室(LGC)和英国FEPAS检测实验室能力验证等举办的多个能力验证项目,实验室检测水平得到大幅提升。但是针对实验室内部质量控制,由于缺少微生物定量质控菌株而较难进行。
4.1具有均匀性和稳定性的定量质控菌株是进行比对实验的必要条件。本研究采用对数生长后期的金黄色葡萄球菌菌株,离心洗涤后获得菌体,使用5%脱脂奶粉和5%海藻糖作为保护剂,制成106cfu含菌量、104cfu含菌量的冻存管。经计数培养证明低温保存的质控样品具有较好的均一性和稳定性。
4.2在2014年举办的医疗器械检测机构能力验证和比对实验中,对于微生物计数项目的判定原则为:以测试结果的log为结果,指定值为3.83,各实验室结果在“指定值±0.5log10”(即3.33~4.23)范围为即为满意。2013年LGC举办的李斯特菌数计数能力验证项目中,根据公式Z=(x-X)/SDPA(x为参与者结果的log值,X为指定值,SDPA为0.35log10),∣Z∣≤2为合格结果,那么实验结果的控制范围为“指定值±0.7 log 10”。在本实验的均一性和室内复现性检测中,均采用复现性临界差值进行判断,分别取0.39和0.38,均小于上述控制标准,控制条件更为严格。均匀性试验和室内重复性检测证明质控样品符合均一性要求,-20 ℃和-80 ℃保存具有较好稳定性。
4.2质控样品的活力是限制其适用范围的重要因素。《中国药典》2015版非无菌产品的微生物限度检查要求将供试液与工作菌株充分混合后,取样进行培养计数。如果质控样品活力较差,与具有抑菌性的样品混合后,生长就会被抑制,回收率降低。因此,本研究首次使用不同种类的样品对106cfu组质控样品进行活力检验。分别考查了无明显抑菌作用和具有不同抑菌效力共8种样品的回收率试验,发现质控样品组与正常工作菌株的回收率没有明显区别,均符合《中国药典》2015版要求。这是关于适用于微生物限度检查方法学适用性试验的质控样品的首次报道。
