左西孟旦对猪冠状动脉微栓塞后心肌细胞炎症反应的影响
2018-11-09王江友陈涵宋丹刘成伟彭剑鄢华张龙岩
王江友 陈涵 宋丹 刘成伟 彭剑 苏 鄢华 张龙岩
冠状动脉微栓塞(coronary microembolization,CME)是急性冠状动脉综合征及经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)围术期常见并发症,主要由于医源性或自发冠状动脉粥样斑块破裂及腐蚀所导致[1]。研究显示,CME发生与冠状动脉无复流或慢血流存在直接相关,进而导致心肌损伤及近远期心功能明显下降,即使心外膜血流恢复正常,心功能依然进行性下降[2];一旦CME发生,目前包括药物及器械相关保护措施均不能改善患者近、远期临床预后[3]。因此,PCI围术期CME所致并发症仍是临床医师所面临的难题。
既往国外大量研究表明,CME发生后常伴有大量心肌炎症反应,表现为大量心肌组织中白细胞浸润,其中的机制可能是CME诱发心肌炎症反应,增加心肌组织肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的大量释放,最终导致心肌损伤及收缩功能恶化[4-7]。前期本研究团队针对动物实验发现,CME发生后,心肌微梗死灶周围可见大量炎性细胞浸润,并伴炎性因子的释放,从而诱发心肌局部炎症反应,最终导致CME后心肌损伤及进行性心功能障碍[8-10]。
左西孟丹作为一类新颖的强心药物,目前适用于传统抗心力衰竭治疗疗效不佳,并且需要增加心肌收缩力的急性失代偿心力衰竭的短期治疗。近年来大量研究证实,左西孟丹在多种组织中能够抑制促炎症反应因子TNF-α的表达,从而发挥抗炎症反应的作用[11-12]。本研究团队设想,是否能够使用左西孟旦预处理,降低CME后心肌细胞炎症反应,并且阐明其主要通过抑制促炎症蛋白TNF-α而起保护作用。另外,前期研究发现,CME后12 h心肌细胞炎症反应达到高峰。因此本研究均在成功建立CME模型后12 h作为研究观察时间,进行各组实验动物指标的对比研究。
1 材料与方法
1.1 微栓塞球的制备
取 42 μm 的微栓塞球 10 μl(42 μm Dynospheres,挪威Dyno 公司),放入 1.5 ml EP管中,加生理盐水至1 ml,配制成20×104个/ml,显微镜下计数;然后取12×104个/0.6 ml,放入60 ml离心管中,加入生理盐水配成40~45 ml,再次计数,使用前用超声震荡搅匀仪使微栓塞球混合均匀。
1.2 CME 模型建立[4]
12周龄小型猪(雌雄不拘),体重21~25 kg,肌注氯安酮和苯二氮 诱导麻醉后,给予戊巴比妥静脉维持麻醉,分离右侧股动脉,置入7 F动脉鞘,经鞘管给予肝素200 U/kg 以达到肝素化,此后每延长1 h静脉注射肝素100 U/kg维持肝素化。然后血管造影(DSA,GE INNOVA 2000)行冠状动脉造影,送入微导管(3.0/2.8 F ,科迪斯公司)于左前降支(LAD)中段(发出第一对角支)处,经微导管在40 min内注入42 μm的微栓塞球45 ml(假手术组注射等量生理盐水),再用10 ml生理盐水冲洗微导管并注入冠状动脉内。
1.3 实验分组与处理
共15头小猪,每组5头。分为假手术组、CME组、CME+左西孟旦组。CME+左西孟旦组在CME建立前用左西孟旦预处理,全麻下从耳缘静脉以0.05 μg/(kg · min)使用 24 h,术前 60 min 再以0.2 μg/(kg · min)负荷使用。
1.4 心脏功能测定
所有实验动物均采用Philips sonos7500型超声心动图仪,探头频率10 MHz,检测各组小型猪左心室舒张末期内径(LVEDd)、左心室射血分数(LVEF)、心排血量(CO)及左心室短轴缩短率(FS)。所有测量指标均取三个心动周期的平均值为最终结果。
1.5 心肌梗死面积测量
苏木素碱性苦味酸染色(HE染色)是诊断早期心肌缺血坏死的一种重要染色方式,缺血心肌呈红染,正常心肌细胞胞浆黄染、胞核蓝染。心肌缺血坏死面积采用DMR+Q550 病理图像分析仪测定,每张HBFP染色切片随机选取5个视野(×100倍),使用Leica Qwin分析软件平面法测量梗死区域,表示为总分析切片的面积百分比,取平均值[4]。
1.6 以Western-blot检测心肌组织中TNF-α
检测促凋亡蛋白TNF-α的表达。用磷酸缓冲盐溶液(PBS)冲洗心肌组织两次,匀浆,在4℃以下12000 r/min离心15 min提取心肌组织总蛋白;以95℃10 min,每份标本取20 μg蛋白于12%分离胶和5%浓缩胶十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳;蛋白转移至聚偏氟乙烯(PVDF)膜;室温下5%牛奶封闭1 h,一抗4℃孵育过夜,HRP标志二抗按l ∶ 2000稀释室温下孵育1 h,采用目标条带的积分吸光度值经actin校正后(美国Bio-Rad公司,Gel Doc 2000凝胶图像)用专用软件分析,TNF-α的活化产物IA值/actin IA值表示其相对活化水平。
1.7 以ELISA法测定血清超敏C-反应蛋白(HsCRP)、TNF-α 浓度
按照说明书操作采用ELISA法测定血清HsCRP、TNF-α 浓度。
1.8 心肌损伤标记物测定
cTnI测定采用免疫化学发光法测定。
1.9 统计学分析
所有数据采用SPSS17.0统计软件进行分析。计量资料以(-x ±s)表示,组间比较采用单因素方差分析,两两比较采用LSD 检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组实验动物心功能指标比较
CME 组术后 12 h FS[(24.49±2.86)%比(41.28±2.86) %,P=0.023]、LVEF[(49.83±4.64) % 比(66.86±3.97) %,P=0.035]、CO[(2.58±0.42) L/min比(4.32±0.89) L/min,P=0.042]与假手术组比较均显著下降,而 LVEDd[(38.26±1.93) mm 比(32.39±1.52) mm,P=0.043]比假手术组显著增加,差异均有统计学意义。CME+ 左西孟旦组 FS[(32.42±3.98) %比(24.49±2.86) %,P=0.029]、LVEF[(58.42±5.28) %比(49.83±4.64) %,P=0.043]、CO[(3.58±0.92) L/min 比(2.58±0.42) L/min,P=0.038]与 CME 组比较均呈现升高趋势,LVEDd [(33.92±1.56) mm比(38.26±1.93) mm,P=0.037]比CME 组呈现降低趋势,差异均有统计学意义(表1)。
表1 冠状动脉微栓塞术后12 h各组实验动物心功能指标比较(±s)

表1 冠状动脉微栓塞术后12 h各组实验动物心功能指标比较(±s)
注:a,与假手术组比较,P<0.05;b,与CME组比较,P<0.05;LVEF,左心室射血分数;FS,左心室短轴缩短率;LVEDd,左心室舒张末期内径;CO,心排血量
项目 假手术组(n=5)CME组(n=5)CME+左西孟旦组(n=5)LVEF (%)66.86±3.97 49.83±4.64a 58.42±5.28ab FS (%)41.28±2.8624.49±2.86a 32.42±3.98ab LVEDd (mm)32.39±1.5238.26±1.93a33.92±1.56b CO (L/min) 4.32±0.89 2.58±0.42a 3.58±0.92ab
2.2 各组实验动物心肌损伤标志物比较
CME 组与假手术组比较,术后12 h 肌钙蛋白 明显升高[(0.229±0.038)ng/ml 比(0.049±0.009)ng/ml,P=0.025]。CME+ 左 西 孟 旦 组与CME 组比较,肌钙蛋白 明显下降[(0.128±0.029)ng/ml比 (0.229±0.038)ng/ml,P=0.048]。
2.3 各组实验动物血清炎症指标比较
CME 组 术 后 12 h 血 清 HsCRP[(15.68±8.62)mg/ L 比(3.58±1.68)mg/ L,P=0.018]、TNF-α 浓 度[(82.58±20.35)ng/ L 比(23.65±12.68)ng/ L,P=0.027]均明显高于假手术组,差异均有统计学意义。CME+左西孟旦组HsCRP[(7.25±2.98)mg/L 比(15.68±8.62)mg/ L,P=0.038]、TNF-α 浓度[(42.68±18.95)ng/ L 比(82.58±20.35)ng/ L,P=0.029] 均明显 低于CME 组,差异均有统计学意义。
2.4 CME 病理学改变
HE 染色显示微梗死灶内心肌细胞核消失或溶解,细胞胞浆呈红染,梗死灶周边细胞变性、水肿,周围炎性细胞大量浸润及红细胞渗出(图1)。HE染色发现,假手术组未见明显心肌微梗死灶;CME组和CME+左西孟旦组均可见多处心肌微梗死灶,呈局灶性分布,非透壁性,以内膜下和左心室多见(图2)。CME+左西孟旦组梗死面积占比明显低于CME组[(6.658±2.897)%比(9.986±3.542)%,P=0.036]。
2.5 心肌组织TNF-α蛋白的表达
Western blot 定量分析显示,CME 组与假手术组比较心肌组织TNF-α蛋白表达水平较高(P=0.039);CME+左西孟旦组与CME 组比较,心肌组织TNF-α蛋白表达水平较低(P=0.042),差异均有统计学意义(图3)。
3 讨论
CME是急性冠状动脉综合征及介入治疗围术期常见并发症,主要由于医源性或自发冠状动脉粥样斑块破裂及腐蚀所导致[1]。研究显示,CME发生与冠状动脉无复流或慢血流存在直接相关,进而导致心肌损伤及近、远期心功能明显下降,即使心外膜血流恢复正常,心功能依然进行性下降[2];一旦患者发生CME后,药物及器械相关保护措施均不能改善其近期和远期临床预后[3]。有动物实验发现,在犬的冠状动脉内注入微栓塞球,犬的冠状动脉血流短暂减少后即刻可恢复正常,但心肌的收缩功能呈现进行性下降现象,表明CME致心肌损伤的机制并非由心外膜血管血流减少所决定[13]。另有动物实验发现,微栓塞所致坏死心肌的面积占总心肌面积不到5%,微栓塞所致心肌细胞坏死不足以完全解释心肌收缩功能障碍[14]。本研究表明,动物CME模型建立后,心肌缺血坏死面积占比很少,但是心脏功能明显受到损伤,与既往研究结果一致。

图1 冠状动脉微栓塞后心肌微梗死区域HE染色(×200) A.CME术后12 h微梗死相关区域HE染色(箭头所示为微动脉内的微栓塞球);B.CME+左西孟旦组心室前壁心肌组织微梗死相关区域HE染色(箭头所示为微动脉内的微栓塞球),梗死程度及炎症浸润幅度明显少于CME组
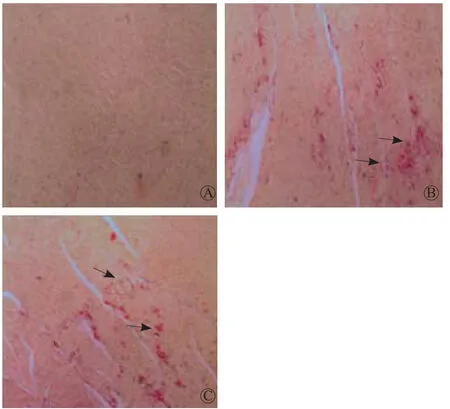
图2 冠状动脉微栓塞后心肌微梗死区域HE染色(×100) A.假手术组心室前壁心肌组织未见明显微梗死灶;B.CME术后12 h微梗死灶区域HE染色(箭头示微梗死灶染成红色);C.CME+左西孟旦组心室前壁心肌组织微梗死相关区域HE染色(箭头示微梗死灶染成红色),梗死面积明显少于CME组

图3 Western blot 定量分析
既往研究表明,CME发生后心肌细胞TNF-α蛋白明显升高,与心脏功能明显相关,通过TNF-α抗体抑制TNF-α表达,心功能明显改善,因此,证实TNF-α与CME所致心功能下降密切相关[15-16]。另有研究发现, CME发生后的缺血心肌组织细胞中,TNF-α表达显著升高并伴有白细胞浸润,使用TNF-α抗体和糖皮质激素抗炎可防治CME导致的心功能不全,进一步证实了CME致心功能不全发生机制与TNF-α介导的炎症反应密切相关[17]。本研究表明,CME发生后,在微梗死灶周围,发现有大量炎症细胞浸润,证实其中的机制可能是CME诱发心肌细胞炎症反应,增加心肌组织TNF-α蛋白表达,进而导致心肌损伤及收缩功能恶化。
左西孟丹作为一类新型的强心药物,目前适用于传统抗心力衰竭治疗(如利尿药、血管紧张素转换酶抑制药及洋地黄类)疗效不佳,并且需要增加心肌收缩力的急性失代偿心力衰竭的短期治疗。左西孟丹目前已发展成在急性心力衰竭或其他心源性需要使用强心药物时的理想选择。另外,左西孟旦能够增加心脏收缩功能而不增加心脏耗能,有改善心室-血管收缩耦合,改善外周血管舒张,增加组织灌注,抗心肌顿抑及抗炎症反应作用[18]。近年来大量研究证实,左西孟丹在多种组织中能够抑制促炎症反应因子TNF-α的表达,从而发挥抗炎症反应的作用[11-12]。Grossini等[11]研究发现,左西孟旦能够通过抑制炎症改善猪急性再灌注肝损伤。Paraskevaidis等[12]研究显示,左西孟旦能够通过抑制心肌炎症及凋亡,改善慢性心力衰竭患者长期预后。本研究发现,左西孟旦预处理能够明显抑制促炎因子TNF-α活化,降低心肌细胞炎症反应,从而改善心脏功能。
本研究发现,CME发生后12 h,心肌组织促炎因子TNF-α明显增高,心肌细胞炎症反应显著增加,心脏功能明显下降;然而,通过左西孟旦预处理,能够明显抑制促炎因子TNF-α表达,降低心肌细胞炎症反应,从而改善心脏功能。左西孟旦防治CME致心肌损伤的分子和效应机制,为CME所致心肌损伤的防治提供新颖的策略;为未来在PCI围术期使用左西孟旦降低心肌损伤,改善心功能及长期预后提供理论依据。
