肝X受体α与蛋白酶体激活因子28γ在胃癌中的表达及其对胃癌细胞生长的影响
2018-11-08陈冠阳陈子华袁伟杰高昱杨伟民陈志康
陈冠阳,陈子华,袁伟杰,高昱,杨伟民,陈志康
(中南大学湘雅医院 1.胃肠外科 2.结直肠肛门外科,湖南 长沙 410008)
胃癌是世界第五常见恶性肿瘤,我国是胃癌高发地区[1-2]。传统的胃癌治疗是以手术为主,结合化疗等其他方法的综合治疗。目前,胃癌的分子靶向治疗日新月异,越来越多的基因受到人们的关注,成为胃癌治疗的潜在靶点[3]。
肝X受体(liver x receptor,LXR)属于核受体家族的一员,包括LXRα(也称为NR1H3)和LXRβ(也称为NR1H2)两种亚型,在糖类、胆固醇、脂肪酸的代谢过程中起到了重要的调节作用[4]。近年来的研究发现LXR参与肿瘤的免疫调节[5],并在多种恶性肿瘤中发挥抑癌作用[6]。GW3965是LXR的激动剂,能特异性激动上调LXR[7]。在前期的工作中,笔者通过高通量测序发现:上调LXRα后,胃癌细胞AGS中蛋白酶体激活因子28γ(PA28γ)的mRNA表达水平出现了明显下调。 蛋白酶体激活剂PA28γ是11S蛋白酶体激活剂家族(REG家族)成员之一,能够通过一种不依赖泛素化和ATP的方式降解目的蛋白,从而参与调控细胞信号传导、细胞凋亡、细胞周期及免疫应答等[8]。PA28γ在多种恶性肿瘤中高表达,发挥促癌作用,与多种肿瘤的预后、发生和临床病理特征密切相关[9]。因此推测:在胃癌细胞AGS中,LXRα可能与PA28γ存在一定联系;这可能是LXRα发挥抑癌作用的机制之一。
本研究首先使用免疫组织化学染色和qRTPCR确定了LXRα、PA28γ在胃癌组织和癌旁组织中的表达情况;分析LXRα和PA28γ蛋白表达的相关性;并分析了LXRα、PA28γ蛋白的表达水平与临床病理参数的关系。接下来选择胃癌细胞株AGS为研究对象,利用LXRα过表达慢病毒载体处理AGS细胞;通过流式细胞术探究了LXRα对AGS细胞细胞周期的影响;并通过qRT-PCR和Western blot验证了LXRα对PA28γ表达水平的影响。最后在动物实验中进一步验证LXRα对AGS细胞增殖的影响。旨在为理解LXRα、PA28γ在胃癌增殖中的地位、作用和可能机制提供了新的实验依据和思路,并为LXRα、PA28γ潜在临床价值的发掘奠定了理论基础。
1 材料与方法
1.1 实验材料
1.1.1 组织标本 收集35例中南大学湘雅医院自2015年7月—2016年8月收治的胃癌患者癌组织以及距肿瘤边缘约2 cm癌旁正常组织,每例患者手术后30 min内取新鲜组织标本,并迅速转移至液氮中保存。所有患者术前均未行化学治疗、放射治疗以及其他针对肿瘤的治疗,其中女12例,男23例;年龄分布32~75岁,中位年龄54岁;未分化和低分化者30例,中分化和高分化者5例;按照AJCC第7版TNM分期标准分期:I~II期10例,III~IV期25例;肿瘤≥5 cm者18例,<5 cm者17例;T1/T2期者5例,T3/T4期者30例;淋巴结转移者24例,无淋巴结转移者11例。所有患者均知情同意,本研究经医院伦理委员会审批。
1.1.2 细胞与实验动物 胃癌细胞株AGS由中南大学湘雅医院中心实验室提供。裸鼠BALB/c-nu,全为雄性,4周龄,体质量18~22 g,由中南大学动物实验中心提供,共6只,SPF级条件下饲养,标准实验室食物,自由饮水。
1.1.3 主要试剂与耗材 培养液RPMI1640、胰蛋白酶、TRIzol试剂、胎牛血清(FBS)购自美国Gibco公司;DAB显色试剂盒购自瑞士Roche公司;BCA试剂盒购自中国上海碧云天生物技术有限公司;二甲基亚砜(DMSO)明胶、嘌呤霉素、碘化丙啶(PI)以及核糖核酸酶A(RNase A)购自美国Sigma公司;PCR试剂盒、反转录试剂盒均购自日本TaKaRa公司;引物由上海生物生工公司合成;LXRα抗体,二抗均购自英国Abcam公司;PA28γ抗体,二抗均购自美国CST公司;CCK-8试剂盒购自日本同仁化学研究所;6孔细胞培养板购自美国Corning公司;其他各种化学试剂均为国产分析纯产品。
1.2 实验方法
1.2.1 标本处理 标本各取部分由10%福尔马林固定,常规行石蜡包埋。蜡块切片后行免疫组织化学染色。所有石蜡标本行连续切片,片厚4 μm,共4张。1张作常规HE染色,2张作LXRα、PA28γ免疫组化染色,1张以PBS液代替一抗作为阴性对照。随机抽取15例胃癌患者术后新鲜标本进行qRT-PCR。
1.2.2 免疫组织化学及评分标准 石蜡标本4 μm厚连续切片,常规脱蜡以及水化,3%双氧水室温下15 min灭活内源性过氧化物酶,于0.01 mol/L枸橼酸盐缓冲液(pH 6.0)中用微波法进行抗原修复,冷却后PBS漂洗3次。然后使用5%的牛血清白蛋白(BSA)封闭,滴加一抗,4 ℃条件下过夜。接着滴加生物素化山羊抗兔二抗,37 ℃孵育20 min。之后使用辣根过氧化物酶DAB显色试剂盒于室温下显色,蒸馏水洗涤。用苏木精复染5 min。以细胞核出现淡黄色至棕褐色判为阳性。使用低倍镜观察整个切片,随机取10个视野,切换高倍镜观察细胞染色情况;结合阳性细胞百分率和染色强度进行免疫组化评分。结果判定参照相关文献[10]:阳性细胞百分数为0评为0分;>0~<10%为1分;10%~50%为2分;>50%为3分。染色深度计分:阴性为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。按“阳性细胞×染色深度”计总分,0~3分为阴性,4~6分为中度阳性,>6分为强阳性。所有染色结果的判定都采用双盲法和统一评分标准,在完全不知对应样本临床资料的前提下,由2名研究者分别对免疫组织化学结果进行评分,所有打分过程都重复3次以上。
1.2.3 细胞培养 人胃癌AGS细胞采用含10%胎牛血清的RPMI1640培养基进行培养,用25 cm2培养瓶置于5%CO2的37 ℃恒温培养箱中培养。细胞铺满80%培养瓶时,胰酶消化后1 000 r/min离心5 min,进行1:3传代培养。
1.2.4 过表达LXRα慢病毒构建和转染 过表达LXRα的重组慢病毒颗粒-LV-NR1H3(25063-1)由上海吉凯基因化学技术有限公司构建。根据厂家说明书进行慢病毒转染,经过嘌呤霉素筛选后得到稳定转染细胞株。
1.2.5 qRT-PCR 分别提取新鲜胃癌与癌旁组织、各组皮下成瘤瘤体以及体外实验各组细胞中的总RNA,将1 μg总RNA依照反转录试剂盒中的操作步骤反转录成cDNA。采用SYBR Green法进行qRT-PCR,引物序列见表1。ΔCT=CT(目的基因,待测样本)-CT(内标基因,待测样本)(表1)。

表1 引物序列Table 1 The sequences of gene primers
1.2.6 Western blot 分别提取各组皮下成瘤瘤体以及体外实验各组细胞中的总蛋白。使用二喹啉甲酸(BCA)法检测蛋白浓度。取各组蛋白样品30 μg在100 ℃下加热变性后上样,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)电泳分离后,转移至聚偏二氟乙烯(PVDF)膜上,5%的脱脂牛奶室温下封闭2 h,相应的一抗4 ℃条件下孵育过夜、使用洗涤缓冲液(TBST)洗膜3次,每次10 min,室温下孵育二抗1 h,洗膜3次,每次10 min。使用Bio-Rad凝胶成像分析系统显影、拍照。采用Image J软件进行条带灰度分析,以目的蛋白与内参的灰度比值表示目的蛋白的相对表达量。
1.2.7 流式细胞术检测细胞周期 将AGS细胞分为过表达组(过表达LXRα慢病毒载体转染)和空白对照组(无处理),常规方法计数并收集细胞(约2×106),1×PBS洗涤1次(1 000 r/min,5 min)。预冷75%乙醇固定,4 ℃孵育过夜。弃去 75% 乙 醇,1×PBS洗 涤 1次(1 000 r/min,5 min)。重悬细胞于 800 µL 1×PBS+1%BSA 溶液中,加入100 µL PI染液,加入100 µL RNA酶,37 ℃避光孵育30 min,上机检测。检测前预热30 min后荧光微球调整机器,使各放大器接收信号的HCV值<2%,采用Cell Modifit软件进行分析。细胞增殖指数=(S+G2/M)/(S+G2/M+G0/G1)。

图1 LXRα和PA28γ mRNA在胃癌和癌旁组织中的相对水平Figure 1 The relative expression levels of LXRα and PA28γ mRNA in gastric cancer and adjacent tissue
1.2.8 裸鼠皮下成瘤 将裸鼠随机分为过表达组(移植过表达LXRα的AGS细胞)和空白对照组(移植无处理的AGS细胞),每组3只。取各组对数生长期的胃癌细胞株用胰蛋白酶消化,用RPMI1640培养液稀释成单细胞悬液,通过台盼蓝染色测定细胞活力后,用冰生理盐水离心洗涤2次,悬浮于生理盐水中,调整细胞浓度为1×108个/mL。将裸鼠左侧腋窝处皮肤用75%酒精消毒,使用1 mL注射器抽取细胞悬液0.1 mL接种于左侧腋窝处皮下。观察期结束后用颈椎脱臼法处死裸鼠,无菌条件下完整剥离瘤体,称重。30 min内转移至液氮中保存,供后续实验使用。
1.3 统计学处理
使用SPSS 21.0统计软件对实验数据进行统计分析,计数资料使用χ2检验和Kruskal-Wallis H检验,相关性检验使用Spearman等级相关分析,计量资料使用t检验。P<0.05为有统计学意义。
2 结 果
2.1 胃癌手术标本中LXRα与PA28γ的表达
2.1.1 LXRα 与 PA28γ mRNA的 表达 qRTPCR结果显示,与内参GAPDH相比较,LXRα在15例胃癌组织中的ΔCT值为6.81±1.48,在癌旁组织中的ΔCT值为5.61±1.23。即LXRα mRNA在胃癌组织中的水平低于癌旁组织,差异有统计学意义(P=0.0314)。PA28γ在15例胃癌组织中的ΔCT值为7.11±2.91,在癌旁组织中的ΔCT值为 8.90±1.20。即 PA28γ mRNA在胃癌组织中的水平高于癌旁组织,差异有统计学意义(P=0.041 4)(图1) 。
2.1.2 LXRα和PA28γ蛋白的表达及其临床病理因素的关系 免疫组织化学结果显示,LXRα在胃癌组织以及癌旁组织中表达的阳性率分别为68.6%(24/35) 和 91.4%(32/35),即 LXRα在胃癌组织中的表达低于癌旁组织(P=0.034)。PA28γ在胃癌组织以及癌旁组织中表达的阳性率分别为 60.0%(21/35)和 31.4%(11/35),即PA28γ在胃癌组织中的表达高于癌旁组织(P=0.030)(图2)(表2)。LXRα与PA28γ蛋白表达与患者性别、年龄、肿瘤分化程度、TNM分期、肿瘤大小、浸润深度、有无淋巴结转移均无明显关系(均P>0.05)(表3)。
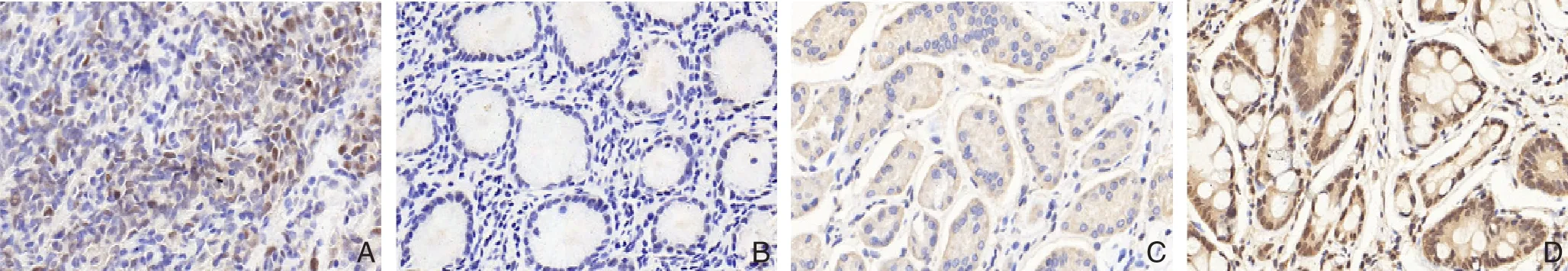
图2 免疫组化检测PA28γ和LXRα蛋白表达(×400) A:胃癌中PA28γ阳性;B:癌旁中PA28γ阴性;C:胃癌中LXRα阴性;D:癌旁中LXRα阳性Figure 2 Immunohistochemical staining for PA28γ and LXRα protein expressions (×400) A:Positive PA28γ expression in gastric cancer tissue; B: Negative PA28γ expression in tumor adjacent tissue; C: Negative LXRα expression in gastric cancer tissue; D: Positive LXRα expression in tumor adjacent tissue
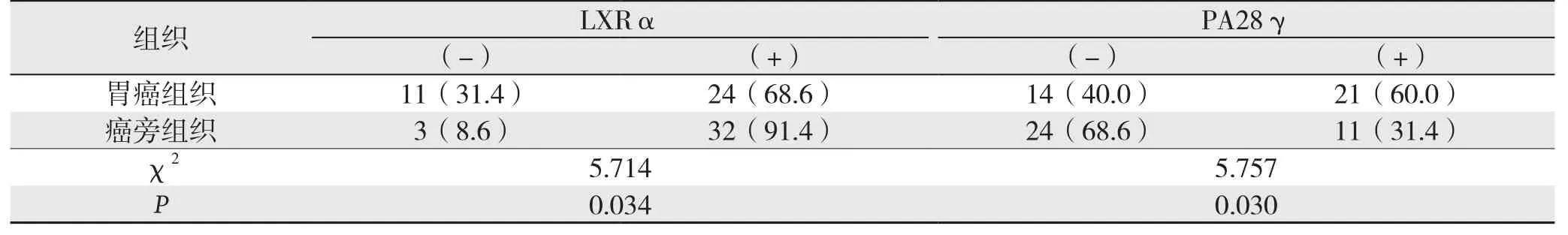
表2 LXRα和PA28γ蛋白在胃癌及其癌旁组织中的表达比较[n(%)]Table 2 Comparison of LXRα and PA28γ protein expressions in gastric cancer and adjacent tissue [n (%)]

表3 LXRα与PA28γ蛋白的表达与胃癌临床病理特征的关系[n(%)]Table 3 The relations of LXRα and PA28γ protein expressions with the clinical factors of gastric cancer [n (%)]
2.1.3 LXRα与PA28γ蛋白表达的相关性 免疫组织化学结果显示,35例胃癌组织中,LXRα蛋白强阳性者9例,中等阳性者15例,阴性者11例。PA28γ蛋白强阳性者5例,中等阳性者16例,阴性者14例。经Spearman等级相关分析显示,LXRα和PA28γ蛋白在胃癌中的表达呈负相关(r=-0.452,P=0.006)(表4)。

表4 胃癌组织中LXRα和PA28γ蛋白表达的相关性Table 4 Correlation between LXRα and PA28γ protein expressions in gastric cancer tissue
2.2 细胞实验结果
2.2.1 转染效率检测以及过表达LXRα对PA28γ表达的影响 用qRT-PCR检测空白对照组AGS细胞和过表达组AGS细胞中PA28γ mRNA相对水平,结果显示,过表达组LXRα mRNA的相对水平为空白对照组的(26.507±3.016)倍。同 时 用qRT-PCR与Western blot检 测PA28γ mRNA与蛋白的表达,结果显示,与空白对照组比较,过表达组PA28γ的mRNA与蛋白的表达水平均明显下降(P=0.006 8、P=0.001 0)(图3)。
2.2.2 过表达LXRα对体外AGS细胞细胞周期的影响 流式细胞仪检测结果显示,过表达组细胞处于亚G0期以及G0/G1期比例高于空白对照组;而S期和G2/M期细胞比例均低于空白对照组(均P<0.05)。LXRα过表达组增殖指数为0.433±0.003,明显低于空白对照组的0.526±0.001(P=0.000)(图4)(表5) 。

图3 PA28γ表达检测 A:mRNA表达;B:蛋白表达Figure 3 Determination of PA28γ expression A: mRNA expression; B: Protein expression
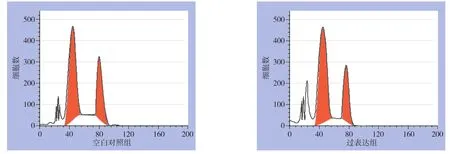
图4 流式细胞仪检测细胞周期变化Figure 4 Flow cytometric analysis of cell cycle

表5 周期相关指标的比较Table 5 Comparison of cell cycle-related variables
2.3 动物实验结果
2.3.1 移植瘤生长情况 空白对照组和过表达组的裸鼠在接种后7 d左右皆可见接种部位皮下长出约米粒大小硬结,成瘤率为100%。肿瘤随着时间的推移呈不同速度生长。接种24 d后处死裸鼠,取出肿瘤组织称重。过表达组和空白对照组肿瘤质量分别为(0.475±0.099)g、(2.295±0.178)g,过表达组肿瘤质量明显轻于空白对照组(P=0.000 9)(图5)。
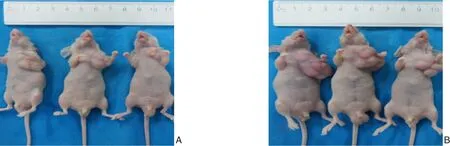
图5 接种24 d后小鼠皮下移植瘤情况 A:过表达组;B:空白对照组Figure 5 The subcutaneous xenografts in mice 24 d after transplantstion A:LXRα overexpression group; B: Blank control group
2.3.2 移植瘤组织中LXRα与PA28γ水平 用qRT-PCR检测两组皮下移植瘤中LXRα和PA28γ mRNA的相对水平,结果显示,与空白对照组比较,过表达组PA28γ mRNA水平明显下调(P=0.001 8),LXRα mRNA水平明显上调(P=0.001 1)。用Western blot检测两组皮下移植瘤中LXRα和PA28γ蛋白的相对水平,结果显示,与空白对照组比较,过表达组PA28γ蛋白表达水平明显下调(P=0.001 4),LXRα蛋白表达水平明显上调(P=0.002 0)(图6) 。

图6 LXRα和PA28γ在皮下移植瘤组织中的表达检测 A:mRNA表达;B:蛋白表达Figure 6 Determination of the expression levels of LXRα and PA28γ in the transplanted tumor tissue A: mRNA expressions; B: Protein expressions
3 讨 论
胃癌是世界常见肿瘤,在我国恶性肿瘤中发病率居第2位,病死率居第3位[1-2]。近年来,随着D2根治术为主的规范手术的推广,以及合理的术后化疗,胃癌患者生存率有一定程度的提高,但其整体治疗效果依然不佳。除了传统的手术治疗以及新辅助化疗,胃癌的靶向治疗同样发展迅速。无数胃癌发生、发展的驱动基因被识别,受到学界的关注,而LXRα则是近年来恶性肿瘤增殖研究的热点基因。
LXR是DNA结合转录因子核受体家族的成员,有LXRα和LXRβ两种亚型。LXRβ广泛分布于全身各个组织,而LXRα主要分布在肾上腺、小肠、脂肪、肝脏等代谢活跃的组织或器官中[11-12]。近年来的研究发现LXRα与多种肿瘤的发生、发展相关,且在多种肿瘤中发挥抑癌作用。蛋白酶体激活剂PA28γ,又名REGγ、PSME3、11Sγ、Ki抗原[13]。PA28γ是REG蛋白酶体激活因子家族(也称11S家族)中的一员,11S家族还包括PA28α(REGα)和PA28β(REGβ)。这些成员可以在不依赖ATP和泛素的情况下激活20S蛋白酶体的裂解活性[9]。目前,PA28γ被认为在多种肿瘤中发挥促癌作用[9,13-14]。
本研究首先在胃癌和癌旁组织中运用免疫组织化学方法和qRT-PCR检测LXRα与PA28γ的表达。结果显示,LXRα在胃癌组织中的蛋白和mRNA水平低于癌旁组织,PA28γ在胃癌组织中的蛋白和mRNA水平高于癌旁组织。Vigushin等[15]发现:15例乳腺癌中LXRα mRNA的阳性率为11/15(73.3%),低于正常组织的14/15(93.3%)。PA28γ在人体正常组织中多为低表达,而在喉癌、胰腺癌、黑色素瘤等多种肿瘤中高表达[16-18]。这与本研究结果相一致。在进一步的实验中,通过流式细胞术和动物实验发现,LXRα对人胃癌细胞株AGS的细胞周期具有阻滞作用,并能抑制AGS细胞的生长。大量文献[19-23]报道了类似结果:LXR在结直肠癌、黑色素瘤、前列腺癌、乳腺癌等肿瘤中起抑癌作用。免疫组化研究中发现:胃癌组织中LXRα蛋白与PA28γ蛋白的表达存在明显负相关,提示LXRα与PA28γ之间可能存在联系。随后本研究通过Western blot和qRT-PCR发现:过表达LXRα可显著下调体内外AGS细胞中PA28γ的表达。近年的研究提示:PA28γ具有促癌作用。Guo等[17]发现在胰腺癌中PA28γ通过c-Myc-glycolysis信号轴促进胰腺癌生长。Chen等[16]发现PA28γ通过Wnt/β-catenin通路促进黑色素瘤增殖;阻断和敲除PA28γ能够抑制体内外黑色素瘤细胞增殖。进一步查阅文献发现PA28γ可特异性降解p53[23]。p53是一种重要的抑癌基因[24],而特异性降解p53被认为是PA28γ发挥促癌作用的重要途径之一。已有文献[25]报道,激动LXRα后p53的表达上调。综上所述,我们提出以下观点,即LXRα可抑制人胃癌细胞的生长,并且其机制之一可能是通过抑制PA28γ的表达,进而上调抑癌基因p53的表达,最终达到抑制肿瘤的作用。
在本研究中,LXRα在胃癌组织中相对低表达,在癌旁组织中相对高表达,并且抑制胃癌AGS细胞的生长,起抑瘤作用,这与LXRα在其他肿瘤中的作用是基本一致的。PA28γ在胃癌组织中相对高表达,在癌旁组织中相对低表达,这与其在其他肿瘤中的表达也基本一致。而LXRα与PA28γ的负相关作用则是首次报道。在其他肿瘤中是否也存在类似现象,还需进一步实验证明。但无论如何,LXRα的抑癌作用正逐步被揭示,有望成为胃癌靶向治疗的一个新靶点。
