应用原代软骨细胞与SW1353软骨肉瘤细胞系建立体外骨关节炎模型的效果评价
2018-11-07刘晓彤黄悦刘旭丹徐小磊姜梦琪杨迎春何健宜顾海伦刘莉
刘晓彤,黄悦,刘旭丹,徐小磊,姜梦琪,杨迎春,何健宜,顾海伦,刘莉*
(1中国医科大学公共卫生学院营养与食品卫生教研室,沈阳 110100;2中国医科大学附属盛京医院骨科,沈阳 110004)
骨关节炎(osteoarthritlis,OA)又称退行性骨关节病,以关节软骨退变及继发性骨质增生为主要特征[1],在人群中的发病率及致残率均较高[2]。OA的危险因素主要包括年龄、性别、肥胖、关节损伤等[3],但其具体发病机制仍不十分清楚,且无有效的根治方法。关节软骨的变化被认为是OA发生发展过程中最主要的病理过程[4],软骨细胞是关节软骨的唯一细胞成分,其合成分泌的II型胶原及蛋白多糖是组成软骨细胞外基质的主要成分,且在维持软骨功能方面发挥决定作用。研究表明,OA时软骨细胞基质减少、功能衰退[5]。因此,对于软骨细胞的研究是探讨OA的发病机制、寻找有效防治措施的必要手段。
软骨细胞体外培养是了解软骨细胞生物学性状的重要方法[6]。目前,针对OA的体外实验研究大多采用原代细胞或细胞系来进行[7,8],如正常软骨细胞、OA软骨细胞或软骨肉瘤细胞系(如SW1353细胞系)等。但以上细胞在作为OA体外实验研究对象时,细胞的病理变化及对炎症的反应程度存在一定的差异。因此,本研究通过比较白细胞介素-1β(interleukin-1β,IL-1β)处理下,来源于OA患者的原代软骨细胞及SW1353软骨肉瘤细胞系的增殖活力、OA的炎症标志性产物白细胞介素6(interleukin-6,IL-6)及基质金属蛋白酶-13(matrix metalloproteinase-13 ,MMP-13)表达水平、炎症反应信号通路的核因子 -κB(nuclear factor-κB,NF-κB)表达水平的异同,建立与评估不同来源的体外OA模型,为OA的体外实验研究中细胞的选择提供理论依据。
材料与方法
1 原代软骨细胞及SW1353软骨肉瘤细胞系的培养
取 8例因 OA 行膝、髋关节置换的患者关节软骨组织(男 4 例、女 4 例,患者年龄 32~81岁,经某三甲医院医学伦理委员会批准、患者知情同意),采用胰酶(0.25 %)、Ⅱ型胶原(0.08 %)两步消化,200目筛网过滤分离,培养关节原代软骨细胞,并进行传代培养,至第3代使用;SW1353细胞系购置于中国科学院上海生科院细胞资源中心。均使用低糖DMEM培养基(10% FBS、1% 青链霉素),于37℃、5 % CO2、饱和湿度培养箱中培养。
2 主要仪器与试剂
主要仪器:超净工作台(成都市苏净科学器材有限公司);细胞培养箱(上海科峻仪器公司);倒置显微镜(日本OlymPus 公司);Multiskan MK3酶标仪(美国Thermo公司); 7500 Real-Time PCR仪(美国ABI公司)
主要试剂:IL-1β(美国PeProTech);DMEM(美国Hyclone);FBS(美国CLERK);Ⅱ型胶原酶(美国Invitrogen);胰蛋白酶(美国GIBCO);Ⅱ型胶原一抗(中国博士德);SP试剂盒(北京中杉金桥生物技术有限公司);Trizol(大连宝生物工程有限公司);CCK-8(日本东仁);ELISA 试剂盒(中国博士德);PCR扩增试剂盒(大连宝生物工程有限公司)。
3 原代软骨细胞爬片及表型鉴定
第2代关节原代软骨细胞融合至80%~90%,消化传代至预先放入无菌盖玻片的直径为35mm的培养皿中,37℃,5% CO2细胞培养箱中培养,待细胞约融合50%左右,进行表型鉴定。Ⅱ型胶原检测(免疫细胞化学法):细胞用4%多聚甲醛室温固定20min;3% H2O2孵育10min;正常山羊血清室温孵育15min,一抗4℃过夜;辣根过氧化物酶标记的二抗室温孵育15min;H2O2-DAB 呈色,苏木素复染,梯度酒精脱水,中性树胶封片。蛋白多糖检测(甲苯胺兰染色法):细胞用4%多聚甲醛室温固定20min,1% 甲苯胺蓝染色30min,梯度酒精脱水,中性树胶封片。
4 CCK-8法检测细胞增殖活力
取对数生长期细胞,胰酶(0.25%)消化后制备单细胞悬液,接种于96孔板,每孔100μl(约含细胞数2000个)。原代细胞分组如下:对照组(CON组)、IL-1β(10ng/ml)组,分别处理24h、48h及72h;SW1353细胞分组如下:CON组、IL-1β(1、10、20、40ng/ml)组,处理24h。酶标仪490nm波长处测量OD值。
5 IL-6、MMP-13 水平和 NF-κB mRNA 表达检测
取对数生长期细胞接种于6孔板,待融合至80%~90%后,加药处理,分组如下:CON组、IL-1β(10ng/ml)组。收集细胞及细胞培养上清,-80℃保存待测。IL-6、MMP-13水平的ELISA法测定:根据ELISA说明书按步骤进行。
NF-κB mRNA表达水平的Real-time PCR检测:提取总 RNA,逆转录成cDNA后进行,多聚酶链反应(总反应体系20μl:2×SYBR Premix Ex Taq II 10μl、10μmol/L 的上下游引物各 0.8μl、50×Rox Reference DyeII 0.4μl、cDNA 2μl、ddH2O 6μl。反应条件:预变性95℃30s 1 个循环;PCR 反应95℃5s,60℃34s,40 个循环;熔解曲线分析 95℃15s,60℃1min,95℃15s,1个循环)。数据分析:β-actin 作为内参基因,数据分析采用 2-ΔΔCt分析法。引物序列如下:NF-κB(218bp)上 游 5’-AGGAGAGGATGAAGGAGTTGTG-3’, 下游 5’-CCAGAGTAGCCCAGTTTTTGTC-3’;β-actin(101bp)上游5’-CACACTGTGCCCATCTACGA-3’,下游 5’-CTCAGTGAGGATCTTCATGAGGTAGT-3’。
6 数据分析
利用SPSS 20.0软件进行统计分析,实验结果用均数±标准差(¯x±s)表示。两组比较时采用独立样本t检验;多组比较时,组间比较采用单因素方差分析,两两比较采用LSD-t检验,当P<0.05时认为差异有统计学意义。
结 果
1 原代软骨细胞表达II型胶原蛋白并呈甲苯胺蓝异染性
免疫细胞化学染色显示:所有原代软骨细胞均呈II胶原蛋白免疫反应阳性,其胞质呈棕黄色(图1A);甲苯胺蓝染色显示,所有原代软骨细胞呈蓝紫色,胞质内含有蓝紫色异染颗粒,表明其表达蛋白多糖(图1B)
2 IL-1β降低原代软骨细胞增殖活力
CCK-8法检测显示,10ng/ml IL-1β处理软骨细胞24h后,原代软骨细胞增殖活力显著降低,且随着作用时间的延长(48h及72h),降低增值活力作用有逐渐增强的趋势(图2);而1、10、20、40ng/ml IL-1β处理SW1353细胞24h,对其增殖活力无明显影响(图3)。
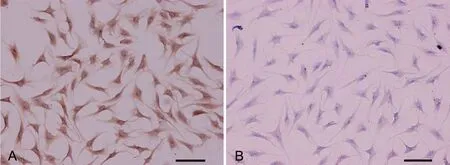
图1 原代软骨细胞鉴定。A,Ⅱ型胶原免疫细胞化学染色;B,蛋白多糖甲苯胺蓝染色;比例尺,100μmFig. 1 Identification of primary chondrocytes. A, immunocytochemical staining for type II collagen; B, toluidine blue staining for proteoglycan; scale bars, 100μm

图2 IL-1β处理对原代软骨细胞增殖活力的影响。与CON组相比,**P<0.01Fig. 2 Effect of IL-1β treatment on the proliferation activity of primary chondrocytes. Compared with CON group, **P<0.01
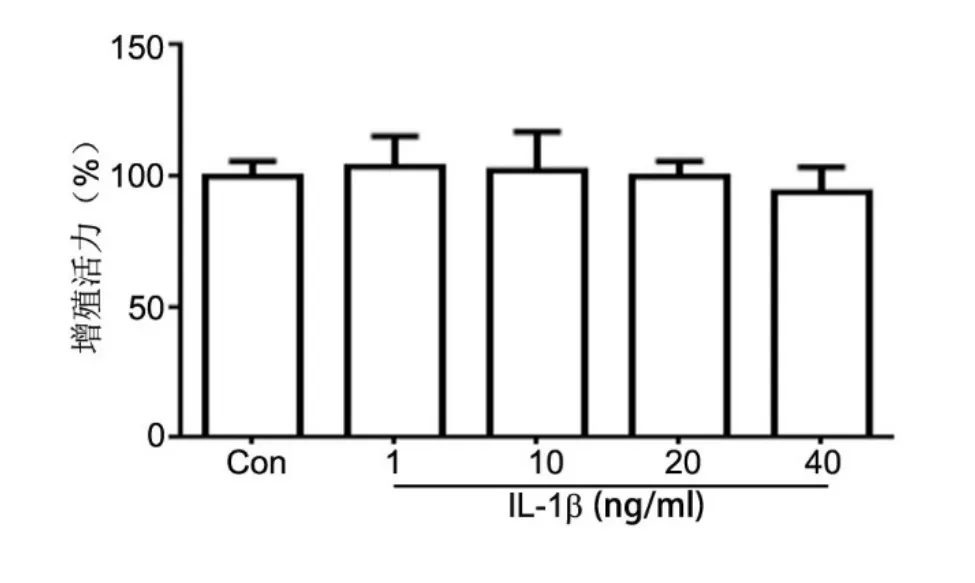
图3 IL-1β处理对SW1353细胞增殖活力的影响Fig. 3 Effect of IL-1β treatment on the proliferation activity of SW1353 cells
3 IL-1β上调原代软骨细胞与SW1353细胞IL-6、MMP-13和NF-κB表达
ELISA测定显示,10ng/ml IL-1β处理可使原代软骨细胞与SW1353细胞系培养基上清中IL-6(图4)和MMP-13(图5)水平均显著升高;Real time-PCR检测表明,10ng/ml IL-1β处理可使原代软骨细胞和SW1353细胞系中NF-κB mRNA表达量显著上升(图6)。

图4 . IL-1β处理对原代软骨细胞及SW1353细胞分泌IL-6的影响。A,原代软骨细胞;B,SW1353细胞;与CON组相比,**P<0.01Fig. 4 Effect of IL-1β treatment on secretion of IL-6 in primary chondrocytes and SW1353 cells. A, primary chondrocytes; B, SW1353 cells; compared with CON group, **P<0.01

图5 IL-1β处理对原代软骨细胞及SW1353细胞分泌MMP-13的影响。A,原代软骨细胞;B,SW1353细胞;与CON组相比:*0.01<P<0.05;**P<0.01Fig. 5 Effect of IL-1β treatment on secretion of MMP-13 in primary chondrocytes and SW1353 cells. A, primary chondrocytes; B, SW1353 cells;compared with CON group, *0.01<P<0.05, **P<0.01
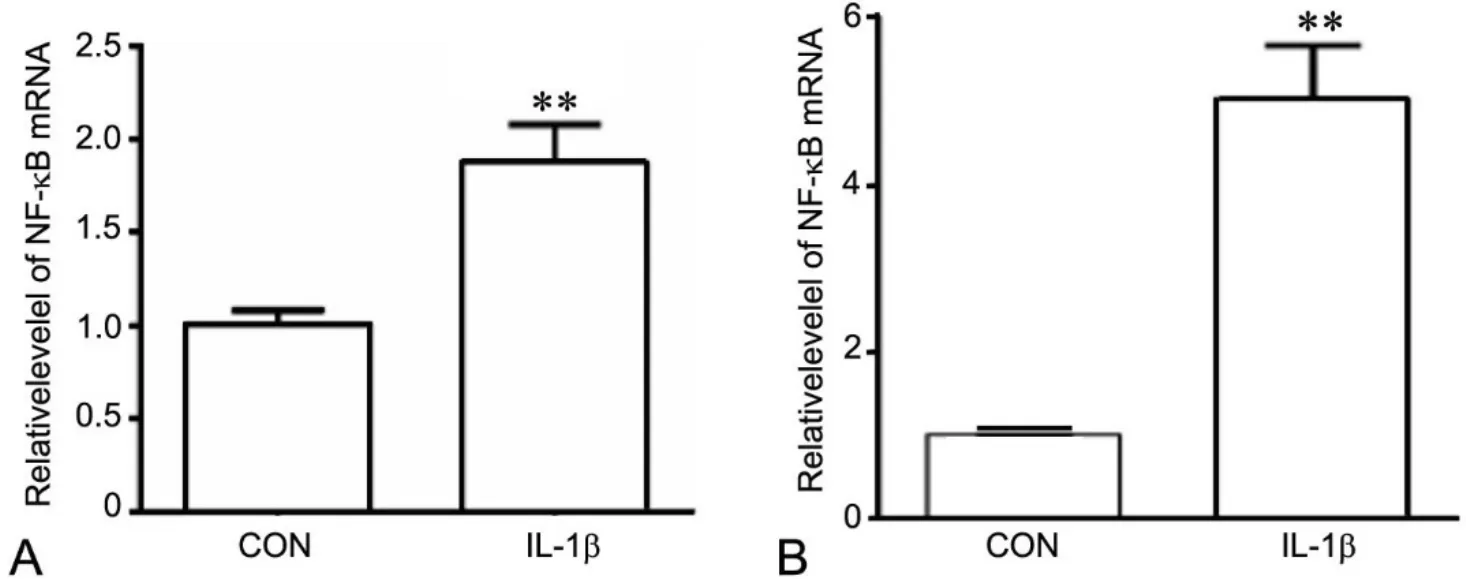
图6 IL-1β处理对原代软骨细胞及SW1353细胞NF-κB mRNA表达的影响。A,原代软骨细胞;B,SW1353细胞;与CON组相比:*0.01<P<0.05;**P<0.01Fig. 6 Effect of IL-1β treatment on expression of NF-κB mRNA in primary chondrocytes and SW1353 cells. A, primary chondrocytes; B, SW1353 cells;compared with CON group, *0.01<P<0.05, **P<0.01
讨 论
来源于患者的原代软骨细胞与永生化的软骨肉瘤细胞系都是常用于OA体外研究的细胞[9,10],相比于细胞系,原代软骨细胞可以更好的体现OA进程中细胞内环境的变化、OA产物及通路等的表达变化,但来源不易、且分离步骤较烦琐,培养时间较长。在本实验中,原代软骨细胞基本爬满培养瓶瓶底需两周左右。SW1353细胞系优点就在于增殖活力强、较易获得和易于培养等(如本实验中,SW1353细胞系基本爬满培养瓶瓶底只需48 h ~72 h),但由于其是肿瘤细胞系,表型、特性等方面的代表性较原代细胞差。
由于本实验培养的原代软骨细胞提取自患者关节组织,可能混有骨细胞、巨噬细胞等,而II型胶原主要是由软骨细胞特异性分泌的,因此,为鉴别我们所培养的细胞是否为软骨细胞,本实验选用免疫细胞化学法与甲苯胺蓝染色法分别检测细胞中Ⅱ型胶原与蛋白多糖的表达。结果显示Ⅱ型胶原与蛋白多糖表达均呈阳性,说明本实验所培养的原代细胞为软骨细胞。
体外实验中,常用IL-1β做诱导剂来模拟OA炎症环境[11]。为探讨IL-1β对原代软骨细胞及SW1353细胞系的增殖活力的影响,我们采用CCK-8法检测细胞活力。结果显示,IL-1β(10 ng/ml)处理不同时间均可显著抑制原代软骨细胞增殖活力,但抑制作用并未随作用时间延长而增强, 这与Li等人的研究结果相同,即 IL-1β(10 ng/ml~25 ng/ml)作用6h~48h后可抑制原代软骨细胞增殖活力[12]。但不同浓度IL-1β处理下,对SW1353细胞增殖活力却无明显影响,Ji[13]等人研究也显示IL-1β(5 ng/ml)处理24 h对SW1353细胞增殖活力无明显影响的结果一致。这可能是由于作为肿瘤细胞系,SW1353细胞本身的增殖活力很强,掩盖了IL-1β对其增殖活力的抑制作用。
IL-6的升高往往预示着炎症反应加重[14],而MMP-13合成及活性的上调均可引起Ⅱ型胶原在OA中的过度裂解[15],是反映关节软骨退变程度的重要标志物[16,17]。本研究结果显示,IL-1β处理后原代软骨细胞与SW1353细胞培养上清中IL-6和MMP-13的表达量均显著增加,提示IL-1β可诱导原代软骨细胞及SW1353细胞出现OA样炎症反应。对于SW1353细胞来说,虽然IL-1β并不能引起细胞增殖活力的抑制,但却可显著增加炎症因子的表达,说明IL-1β作为体外OA模型的诱导剂一样适用于SW1353细胞系。在本研究中还发现,原代软骨细胞培养上清中IL-6的表达量要高于SW1353细胞系,这有可能是由于本实验所培养的原代软骨细胞取自OA患者,细胞本身已经处于炎症环境。
NF-κB是一种广泛参与免疫炎症反应进程的核蛋白因子,调节多种基因表达,同时还可促进多种炎症因子,如IL-1β、MMPs的合成与分泌,在OA进程中发挥着重要的作用[18,19]。本实验结果显示,IL-1β处理可使原代软骨细胞与SW1353细胞中NF-κB mRNA的表达量均显著升高,提示IL-1β可通过激活NF-κB信号通路诱导原代软骨细胞与SW1353细胞系发生OA炎症反应。可推测,虽然两种细胞炎症反应程度存在差异,但引起炎症反应的机制可能相同。
综上所述,IL-1β可诱导原代软骨细胞及SW1353细胞系出现OA炎症反应,但在细胞增殖活力、炎症因子的表达等方面依然存在一定差异。研究者可根据实验目的及客观条件选择不同的细胞作为研究OA的体外模型。
