小鼠脊髓损伤半切模型的建立及评价
2018-11-07张向红王立言郭雨霁韩爱卿
张向红,王立言,郭雨霁,韩爱卿
(1山东大学医学院组织胚胎学教研室,济南 250014;2济南市妇幼保健院妇产科,济南 250001)
随着世界各国经济水平的发展,脊髓损伤(spinal cord injury, SCI)发生率呈现逐年增高的趋势。在发达国家,SCI的发生率大约为13.3~ 45.9人/百万人/年。SCI的患者有极高的致残率和死亡率,严重影响患者生活质量,一直是临床急救医学关注的课题[1,2]。为便于临床研究与诊治,建立脊髓损伤模型并对其研究已势在必行。目前,由脊髓外伤和脊髓内部病变等原因引起的脊髓半切综合征(Brown-Séquard Syndrome)病例日渐增多[3-6],现多数学者着眼于脊髓打击伤或挤压伤模型的构建[7,8],但这些模型与临床上脊髓半切伤的受力及损伤机理明显不同[9]。根据临床脊髓半切综合征病人的脊髓损伤机理,建立脊髓半切伤动物模型就变得尤为重要。由于操作方法的多样性致使疗效差异较大,各研究结果之间缺乏可比较性,因此有必要建立标准化的脊髓半切损伤操作标准,保证动物模型既能模拟人类SCI,又具有广泛可重复性。为此,本研究在该方面进行了深入探索,以期为后期治疗脊髓半切伤提供有益的实验数据。
材料与方法
1 实验动物
昆明小鼠60只,雌性,体重约30~35g,由山东大学医学院实验动物中心提供,将昆明小鼠随机分成2组:损伤组和假手术组,每组30只。
2 脊髓损伤半切模型的建立
实验小鼠用10%水合氯醛按0.35ml/100g剂量行腹腔麻醉后俯卧位固定,以T10胸椎棘突为中心剪除毛发,常规消毒铺巾切开皮肤,分离肌肉,暴露T9-11棘突和椎板。在体视显微镜下,咬除T10棘突及椎板,暴露该阶段脊髓。显微外科剪将脊髓半切至脊髓后正中静脉右缘,切勿伤及静脉,建立脊髓损伤模型,逐层缝合肌肉及皮肤,室温下自然苏醒。术后腹腔注射庆大霉素。假手术组只切开皮肤肌肉,暴露脊髓,无损伤脊髓。
3 行为学评分
于造模后1d、3d、5d、1w、2w、3w采用双盲Basso Mouse Scale (BMS)评分法评价各组小鼠后肢运动功能。由两名测试者对小鼠后肢功能的恢复进行BMS评分,每天测一次,每次5min。取均值记录并对其进行统计学处理。
4 组织标本的制备
实验动物麻醉后仰卧位固定,打开胸腔暴露心脏,于心尖处进针左心室插管,立即用PBS快速灌注,待右心耳留出无色清亮液体后,改用4%多聚甲醛(PFA)心脏灌注约40ml,至鼠体变硬时停止。取损伤(T10)节段上下0.5cm左右的脊髓,置于4%多聚甲醛中进行后固定。于恒温冰冻切片机上,冰冻切片10μm,置于-20°C冰箱内备用。
5 结晶紫染色
取脊髓半切损伤1w小鼠脊髓的冰冻切片复温,PBS冲洗,甲醇固定20min,0.1%结晶紫染色5~10min,95%乙醇分化,显微镜下观察。
6 电镜检测
脊髓半切损伤后1w,实验小鼠用10%水合氯醛按0.35ml/100g剂量行腹腔麻醉处死。实验动物麻醉后仰卧位固定,打开胸腔暴露心脏,于心尖处进针左心室插管,立即用生理盐水快速灌注,待右心耳流出无色清亮液体后,改用2%多聚甲醛+2.5%戊二醛心脏灌注约40ml,至鼠体变硬时停止。取损伤(T10)节段上下0.1cm左右的脊髓置于2.5%戊二醛,于4℃冰箱后固定过夜。冲洗后用刀片修整为1mm组织块,置于1%四氧化锇中,4℃固定1h,PBS冲洗,之后梯度酒精脱水,浸入环氧丙烷,环氧树脂包埋。于超薄切片机(Ultracut R, Leica, Heerbrugg,瑞士)制备70nm超薄切片,柠檬酸铅电子染色后利用电镜(JEM-1200,JOEL,东京,日本)观察。
7 Caspase 3免疫荧光染色
脊髓损伤后1w,将取下的脊髓组织标本常规固定、沉糖脱水、OCT包埋、冷冻切片厚度为8μm。常规破膜,山羊血清封闭,一抗Cleaved caspase 3(兔,1∶100, CST, USA)4℃过夜,二抗(TRITC标记的羊抗小鼠IgG,1∶100, Sigma-Aldrich, USA)37℃ 孵育 1h。1μg/ml DAPI (Invitrogen,USA)染色5min,防淬灭剂封片,荧光显微镜下观察。每组染色均设有阴性对照,以0.01mol/L PBS 代替Cleaved caspase 3抗体。
8 统计学分析
对实验数据作两样本均数的t检验,样本均数用¯x±s表示,以α = 0. 05 为检验水准进行双侧检验,P<0. 05 为差异有统计学意义。
结 果
1 小鼠脊髓半切损伤模型评价
脊髓损伤组小鼠术后2h完全清醒,两个前肢可爬行,损伤侧后肢瘫痪(图1),而假手术组小鼠清醒后即可自由活动。实验组表现为术后3d内小鼠活动较少;1w后个别可恢复爪子着地,偶尔有扎实的脚步,但非常不协调,躯干不平衡;术后3w脚步变得协调,但爪子着地时,躯干仍不平衡。所有小鼠手术切口均愈合良好,无感染,缝线在2w内自动脱落。整个实验过程中因各种原因(如麻醉意外、感染、衰竭等)而死亡的小鼠共6只,死亡率约10%。

图1 脊髓损伤半切动物模型的建立。A和B,示用虹膜剪剪断一侧脊髓;C,示小鼠右后肢瘫痪;D,示损伤脊髓组织(箭头示损伤部位);E,右侧脊髓横断处显微镜观察;比例尺,400μmFig. 1 Establishment of spinal cord hemi-section model in mice. A and B, showing clipping the right hemi-cord with iris scissors; C, showing the right hindlimb of mouse was under paralysis; D, showing the injured spinal cord tissue (arrow shows the injured part); E, microscopic view of the transected part of the right hemi-cord; scale bar, 400μm
2 脊髓半切损伤后的行为学变化
脊髓半切损伤后1d至3w的BMS评分结果见表1。脊髓损伤组各时间点的BMS评分均低于假手术组,表明脊髓半切损伤模型的建立是成功的,其在脊髓半切后还存在着自我修复,为后期研究神经再生的实验提供理想的模型。

表1 脊髓半切损伤后不同时间点BMS评分Tab. 1 BMS score at different time points after spinal cord hemi-section injury
3 脊髓半切后的组织学变化
结晶紫染色结果显示损伤后神经元胞体固缩,突起模糊,尼氏体减少。而假手术组胞体丰满,尼氏体明显多于损伤组(图2)。
电镜观察发现,脊髓半切损伤侧脊髓组织超微结构损伤严重,细胞结构破损严重,线粒体嵴肿胀模糊,甚至消失,形成空泡;髓鞘板层分离,轴索肿胀;毛细血管周围水肿,血管内皮细胞中的线粒体出现空泡化(图3)。而假手术组脊髓组织结构正常。
为了检测脊髓损伤后脊髓组织内细胞凋亡情况,我们进行了Cleaved caspase-3免疫荧光检测。结果显示损伤侧脊髓内的Cleaved caspase-3阳性细胞数要明显多于损伤对侧的Cleaved caspase-3阳性细胞数(图4)。
讨 论

图2 结晶紫染色检测脊髓半切损伤后1w后脊髓损伤。A,假手术组;B,手术组;比例尺,20μmFig. 2 Crystal violet staining for detection of the injured spinal cord at 1w after spinal cord hemi-section. A, sham-operation group; B, operation group;scale bar, 20μm
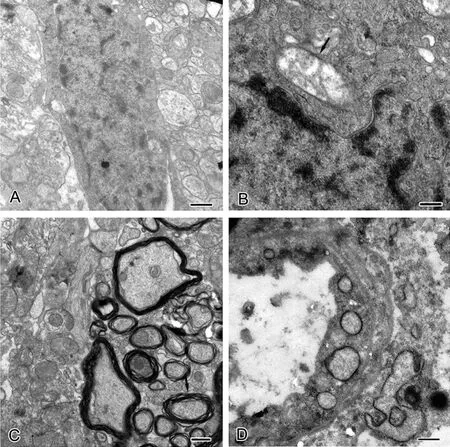
图3 电镜观察脊髓半切损伤后1w损伤脊髓超微结构变化。A,损伤脊髓组织内的神经元;B,损伤脊髓组织内的线粒体;C,损伤脊髓组织内的髓鞘;D,损伤脊髓组织内的毛细血管;比例尺:A和C,0.5μm;B和D,0.2μmFig. 3 Electron microscopic observation of ultrastructural changes of the injured spinal cord at 1w after spinal cord hemisection. A, the neuron in the injured spinal cord tissue; B, the mitochondrion in the injured spinal cord tissue; C, the myelin sheath in the injured spinal cord tissue; D, the capillary in the injured spinal cord tissue; scale bar∶ A and C, 0.5μm; B and D, 0.2μm
近年来,脊髓损伤模型已研究颇多,但多数学者着眼于挤压、打击损伤[10,11]。Allen等最早建立了重物坠落致SCI的模型,即重物坠落法,采用一定重量的重锤沿一个套管垂直落下打击特定脊髓节段导致SCI,但由于重锤与套管之间的摩擦,大鼠脊髓遭受打击的力量不完全一致,可重复性差[12]。在这些脊髓损伤动物模型的制备过程中,动物的死亡率常高于15%,高的死亡率也一直是困扰学者的一大难题[13,14]。再者,这种脊髓压迫损伤模型与临床上脊髓半切伤的受力及损伤机理明显不同,并不适用于脊髓半切综合征病人脊髓损伤机理的研究[9]。目前为研究脊髓半切综合征病人的损伤机理,多采用切割型大鼠脊髓损伤模型,用虹膜刀片直接切除一段大鼠脊髓、或切开后用玻璃针吸出已损毁的脊髓组织,或负压吸除部分脊髓,造成脊髓完全或非完全的横断性缺损[15]。但是这种方法获得的实验模型重复性差,大鼠椎骨较硬,在咬除椎骨的过程中极易造成脊髓的挫伤,难以保证模型动物脊髓损伤的单一性与一致性[15]。在本实验中,尝试使用体型较小的小鼠,在体式显微镜下直视进行,用虹膜剪咬除椎骨,暴露T10段脊髓,并沿着脊髓后正中静脉右缘施行半切,定位标志明确,可准确对脊髓施行半切,从而保证动物模型准确模拟人类的脊髓半切伤。模型制备后的组织标本及冰冻切片,均需在体式显微镜下严格筛选,取准确半切的标本用于后续的实验研究,确保模型制备的可重复性。整个实验过程在体式显微镜直视下开展进行,实验操作精准,除脊髓半切损伤外,对脊髓没有引入其它外来损伤,干扰实验模型的稳定性。整个实验过程中因各种原因(如麻醉意外、感染、衰竭等)而死亡的小鼠只有6只,死亡率约10%,也很好地解决了脊髓损伤后高死亡率的问题。
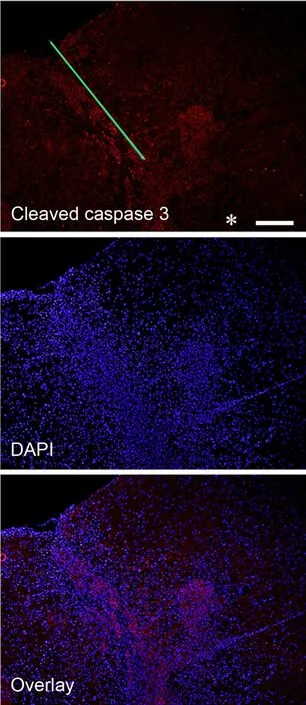
图4 脊髓半切损伤后1w后损伤脊髓内Cleaved Caspase 3表达的免疫荧光检测(绿线,损伤侧,*示损伤对侧);比例尺,20μmFig. 4 Immunofluorescence detection for expression of Cleaved Caspase 3 in the injured spinal cord at 1w after spinal cord hemisection (green line,injury side; * contralateral side). Scale bar, 20μm
动物模型的科学性是评价治疗措施重要的前提条件。在大鼠脊髓损伤模型中,通常用BBB评分法(Basso, Beattie, Bresnahan Scale)来评价脊髓功能的恢复,但BBB法并不能准确地反映出小鼠脊髓功能改善的特殊规律[16]。BMS评分法为目前公认较为准确、可靠的用于小鼠运动功能评价的评分体系[17]。本实验中采用双人双盲法,对实验动物进行后肢运动功能评价发现,SCI组小鼠术后不同时间点BMS评分与假手术组有显著差异,从运动行为学角度,可以认为脊髓损伤动物模型造模成功。
脊髓损伤组织的形态学观察结果显示损伤局部神经元胞体固缩,突起模糊,尼氏体减少,电镜观察显示损伤局部脊髓组织超微结构损伤严重,线粒体嵴肿胀模糊,髓鞘板层明显分离,毛细血管周围水肿,血管内皮细胞中的线粒体出现空泡化,与同水平假手术组脊髓结构有明显差异。凋亡标志物Cleaved caspase3免疫组织化学结果显示,半切损伤致使局部脊髓组织内大量细胞发生凋亡,而损伤对侧波及甚微,与我们课题组的其它研究结果一致[18,19]。这些形态学检测结果提示该方法能很好地满足脊髓半横切的要求。
由此可见,小鼠脊髓半切损伤模型的标准化制作,不但有利于造模的均一性、稳定性和可重复性,而且通过与损伤对侧结构的对比,更加有利于对治疗效果的准确评估以及多种治疗方案之间的疗效比较,有利于促进脊髓损伤神经再生的研究和治疗方案的优化选择。
