和厚朴酚对ox-LDL诱导的血管内皮细胞损伤的保护作用及其机制研究
2018-11-07朱为勇唐元升盖延红李越凡尹刚
朱为勇,唐元升,盖延红,李越凡,尹刚
动脉粥样硬化(AS)是冠状动脉硬化性心脏病、高血压等多种心血管疾病的病理基础,是由斑块积聚引起的常见动脉病症。血管内皮下层氧化低密度脂蛋白(ox-LDL)的沉积是AS的特征之一[1]。研究发现血管内皮细胞损伤在AS的发生发展中起到重要促进作用,内皮细胞凋亡是AS的始动发病机制[2,3]。 而大量文献报道ox-LDL是引起血管内皮细胞损伤的关键因子之一;ox-LDL可通过诱导细胞内氧化应激和内质网应激导致内皮细胞凋亡[4-7]。和厚朴酚是传统中药厚朴中分离出的有效成分之一,是一种含有酚羟基的活性物质,具有一定的心血管保护作用[8]。研究发现其具有抗肿瘤,抗炎和抗氧化活性[9]。但截至目前,仍不明确和厚朴酚是否具有保护ox-LDL诱导的内皮细胞损伤的作用。本研究通过ox-LDL来诱导HUVECs损伤,探讨和厚朴酚对ox-LDL介导的内皮细胞损伤的保护作用及可能作用机制。
1 资料与方法
1.1 研究对象及主要试剂人脐静脉血管内皮细胞HUVECs购于上海丰寿生物科技有限公司(源自ATCC库);RPMI 1640培养液、胰蛋白酶、1%青链霉素、胎牛血清购于美国GIBCO公司;和厚朴酚对照品均购自中国食品药品检定研究院,纯度>98%;ox-LDL购于北京索莱宝科技有限公司;细胞计数试剂盒(CCK8)、Annexin V-FITC细胞凋亡检测试剂盒购自江苏碧云天生物技术研究所;兔源或鼠源B细胞淋巴瘤/白血病-2(BCL-2)、Bcl-2相关X蛋白(Bax)、活化的半胱天冬酶半胱天冬酶-3(Cleaved Caspase3)、蛋白激酶样内质网激酶、p-PERK、真核起始因子2α (elF2α)、p-elF2α多克隆抗体购自美国Cell Signaling公司;兔源或鼠源转录激活因子、C/EBP同源蛋白和GAPDH多克隆抗体来自于英国Abcam公司;Western blotting相关试剂、辣根过氧化酶标记的山羊抗兔或者抗鼠二抗购于碧云天研究所;ROS检测试剂盒购于北京索莱宝科技有限公司;超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测试盒、过氧化氢酶(CAT)测试盒和谷胱甘肽(GSH)测试盒购于南京建成生物工程研究所。
1.2 仪器细胞培养箱;TriStar2 LB 942型多功能酶标仪;高速离心机;电热恒温鼓风干燥箱(上海鸿都电子科技有限公司,DHG-9140A) ;倒置荧光显微镜;Mini-Protean tetra型垂直板电泳装置;低温离心机;凝胶成像仪(BIO-RAD);Epics-XL Ⅱ型流式细胞仪。
1.3 研究方法
1.3.1 细胞培养和处理HUVECs在含有10%胎牛血清和1%青链霉素的RPMI 1640培养液中,置于37℃、5% CO2环境下培养。2~3 d换液一次,当细胞融合至90%左右时常规传代。配置100 ng/L的ox-LDL的溶液并无菌处理,细胞干预前均做同步化处理。和厚朴酚溶解于10 μm的DMSO中,并以0.22 μm滤膜过滤,置于4℃冰箱中备用。
1.3.2 实验分组检测细胞增殖时,在培养基中加入0.1、1、10、50、100 μmol/L浓度的和厚朴酚,分别干预24 h和48 h,不加药为对照组。其余实验分为Blank组、ox-LDL组;在ox-LDL干预细胞时,分别在培养基中加入0.1、1、10 μmol/L的和厚朴酚,设置ox-LDL+0.1 μmol/L、ox-LDL+1 μmol/L和ox-LDL+10 μmol/L组。
1.3.3 细胞增殖-毒性检测CCK8法测细胞增殖取生长状态良好的HUVECs,每孔5000个种于96孔板中,待细胞融合生长至80%后,加入不同浓度的和厚朴酚(0.1、1、10、50、100 μmol/L)。分别干预24 h、48 h后,每孔加入CCK8工作液10 μL,置于培养箱中继续培养2 h。用酶标仪于570 nm 处测定每个孔A570 值。检测和厚朴酚对ox-LDL处理的HUVECs的影响时,在不同浓度的和厚朴酚中加入100 mg/L的ox-LDL干预细胞24 h,随后按照上述办法检测细胞增殖。CCK8细胞增殖活率=(实验组-空白组)/(对照组-空白组),每组设5个复孔,实验重复3次。
1.3.4 氧化应激水平和抗氧化酶水平检测用无血清培养液稀释试剂盒中的DCFH-DA探针(浓度为10 μmol/L)。细胞干预结束后,收集各组细胞,离心后加入DCFH-DA,37℃培养箱内孵育20 min。PBS洗涤2次后,收集沉淀用于荧光检测。1 h内利用流式细胞仪检测荧光强度(激发波长485 nm,发射波长530 nm),最终荧光强度反应细胞内ROS含量。通过比色法测定细胞上清液中氧化应激相关因子的水平:收集上述分组的细胞上清液,严格按试剂盒说明书方法,检测细胞内SOD、MDA、CAT和GSH的水平。
1.3.5 流式细胞仪检测细胞凋亡以1×105/孔细胞密度将HUVECs接种于6孔板,按照不同实验分组和用药方法处理细胞。作用24 h后,用0.25%的胰酶进行消化,随后室温下3000 rpm离心5 min收集细胞;用预冷PBS(4℃)重悬细胞,3000 rpm离心5 min,洗涤2次,加入300 μl的1×BindingBuffer 悬浮细胞;加入5 μl的Annexin V-FITC混匀后避光孵育15 min;上机前5 min再加入5 μl的碘化丙啶(PI)染色,并补加200 μl的1×Binding Buffer,最后通过流式细胞仪检测细胞早期和晚期凋亡率。
1.3.6 免疫印迹法检测蛋白表达量提取各组细胞总蛋白,使用BCA法定量蛋白,蛋白变性后进行SDS聚丙烯酰氨凝胶电泳,每孔加入30 μg的样品,采用湿转法将蛋白转印至0.45 μm孔径的PVDF上。转膜结束后常温下TBST洗膜3次,5%脱脂牛奶封闭1 h,孵育BCL-2、Bax、Cleaved Caspase3、p-PERK、PERK、p-elF2α、elF2α、ATF4、CHOP和GAPDH(1:1000),4℃过夜。次日,常温下TBST洗膜3次,加入辣根过氧化物酶标记羊抗兔(鼠)二抗(1:5000)孵育2 h。ECL化学发光法显影,凝胶成像仪上拍照。蛋白表达强度以各条带灰度值/GAPDH灰度值表示。
1.4 统计学方法采用SPSS21.0和GraphPad Prism 5.5软件进行统计分析。计量数据以平均数±标准差(±s)表示,各组之间比较用单因素方差分析和SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 和厚朴酚对ox-LDL诱导的HUVECs增殖能力的影响首先,我们检测不同浓度和厚朴酚对HUVECs细胞干预的适宜浓度。表1结果表明,使用和厚朴酚干预24 h后,50 μmol/L的和厚朴酚对细胞增殖产生抑制作用;类似的,干预48 h时,0.1~10 μmol/L的和厚朴酚对细胞增殖没有明显影响,而50 μmol/L和100 μmol/L的和厚朴酚对细胞增殖明显抑制,表明高浓度和厚朴酚对HUVECs存在一定细胞毒性。因此,我们选择0.1~10 μmol/L的和厚朴酚用于实验。表2结果发现,与对照组相比,ox-LDL组细胞的增殖能力明显下降;而与ox-LDL组相比,和厚朴酚成浓度依赖性增加细胞的增殖能力。以上结果提示,和厚朴酚可逆转ox-LDL导致的HUVECs增殖抑制。
2.2 和厚朴酚对ox-LDL诱导的HUVECs氧化应激的影响Ox-LDL可通过诱导氧化应激引起内皮细胞损伤,检测和厚朴酚对ox-LDL诱导的HUVECs氧化应激水平的影响。与对照组比较,ox-LDL组ROS水平明显增加,而和厚朴酚可呈浓度依赖性抑制ox-LDL诱导的ROS水平(P均<0.05)(表3)。如表4所示,与对照组相比,ox-LDL组细胞MDA水平明显增加,而SOD、CAT和GSH水平明显下降(P均<0.01)。加用0.1 μmol/L和厚朴酚后,虽然上述指标有所改变,但与ox-LDL组比较无统计学意义;与ox-LDL组相比,加入1 μmol/L和10 μmol/L和厚朴酚后,MDA水平明显下降,SOD、CAT和GSH水平明显增加(P均<0.05)。
2.3 和厚朴酚对ox-LDL诱导的HUVECs凋亡的影响Ox-LDL诱导的氧化应激通常伴随着细胞凋亡,因此我们探讨不同浓度的和厚朴酚对ox-LDL诱导的HUVECs凋亡的影响。流式细胞仪结果显示,相比于对照组,ox-LDL组细胞凋亡比率明显增加,而加用不同浓度的和厚朴酚后,细胞凋亡比率卡死逐渐降低,ox-LDL+10 μmol/L和厚朴酚组抑制凋亡最明显(P<0.05)。Western blotting检测发现,与ox-LDL明显降低Bcl-2/Bax比率,增加Cleaved caspase3表达(P<0.05)。相反,与ox-LDL组相比,和厚朴酚成浓度依赖性增加Bcl-2/Bax比率,降低Cleaved caspase3的表达(P<0.05)(图1)。

表1 和厚朴酚对HUVECs增殖的影响(x±s)
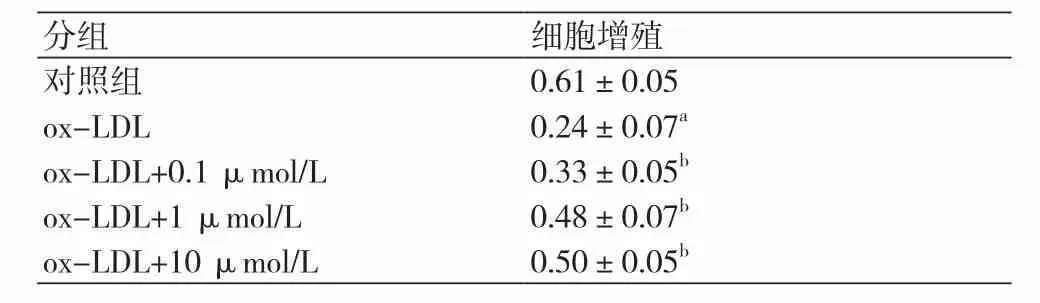
表2 和厚朴酚对ox-LDL诱导的HUVECs增殖的影响(x±s)
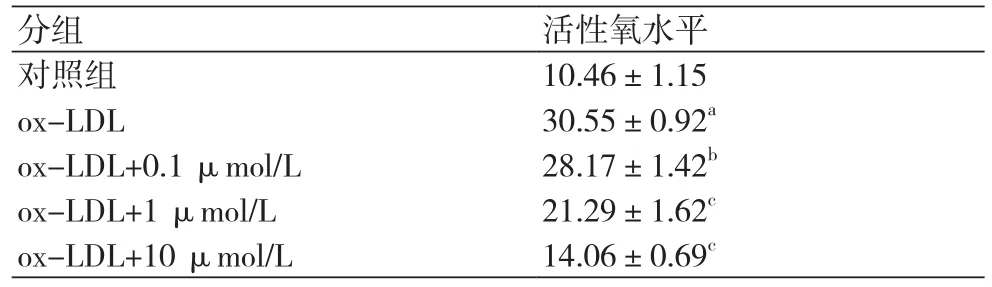
表3 和厚朴酚对ox-LDL诱导的HUVECs活性氧(ROS)水平的影响(x±s)
2.4 和厚朴酚对ox-LDL诱导的内质网应激(ERS)通路的改变为进一步分析和厚朴酚对ox-LDL诱导的内皮细胞保护作用的机制,我们检测ERS相关通路在其中的作用。如图2所示,与对照组相比,ox-LDL处理明显激活p-elF2α和p-PERK的表达(P<0.05);随后,ox-LDL上调ATF4和CHOP的表达(P<0.05)。而不同浓度的和厚朴酚处理,被ox-LDL激活的elF2α/PERK/ATF4/CHOP信号通路呈浓度依赖性受到抑制(P均<0.05),提示CHOP信号通路在和厚朴酚对抗ox-LDL诱导的内皮细胞损伤中起重要作用。

表4 和厚朴酚对ox-LDL诱导的HUVECs氧化应激相关分子水平的影响(x±s)
3 讨论
近年来,大量研究表明血管内皮细胞的损伤和功能改变是AS 发生发展的始动环节,而血管壁内沉积的ox-LDL是血管内皮细胞凋亡的诱导因子[10-12]。因此,抑制ox-LDL介导的内皮损伤有望成为预防或缓解AS进展的有效措施。Ox-LDL诱导的氧化应激是引起内皮细胞损伤的主要原因之一[13]。另一方面,也有报道发现,ox-LDL可通过激活内质网应激(ERS)引起细胞凋亡[14]。结合本研究结果发现ox-LDL诱导HUVECs增殖下降和凋亡水平增加,增加ROS水平和激活ERS下游eIF2α/PERK/ATF4/CHOP通路,进一步证实了ox-LDL可通过诱导氧化应激和ERS引起内皮细胞损伤。
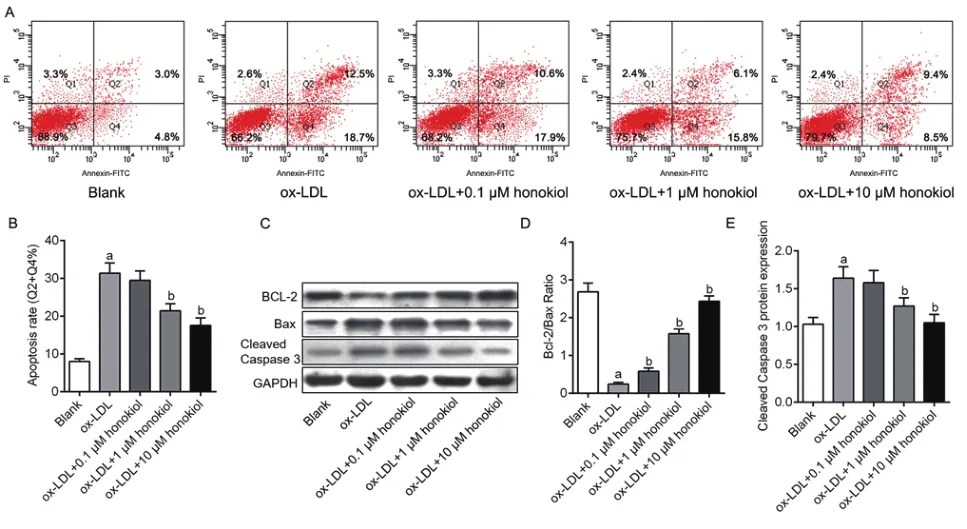
图1 不同浓度和厚朴酚对ox-LDL诱导的HUVECs细胞凋亡的影响。(A)流式细胞仪检测不同组细胞凋亡率;(B)定量分析比较各组凋亡水平;(C)Western blotting检测各组细胞凋亡相关蛋白的改变;(D-E)定量分析比较各组凋亡相关蛋白的水平。与对照组比较,aP<0.05;与ox-LDL组比较,bP<0.05
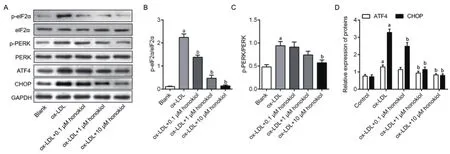
图2 不同浓度和厚朴酚对ox-LDL诱导的HUVECs细胞ERS相关通路的影响。(A)Western blotting检测不同浓度和厚朴酚对elF2α/PERK/ATF4/CHOP信号通路的影响;(B-C)各组之间p-elF2α/elF2α和p-PERK/PERK的比较分析;(D)各组织间ATF4和CHOP蛋白的比较分析。与对照组比较,aP<0.05;与ox-LDL组比较,bP<0.05
和厚朴酚来自木兰科落叶乔木植物厚朴的树皮,是厚朴的最主要的两个活性组分之一。和厚朴酚具有抗炎、抗菌、抗氧化、抗肿瘤和心血管保护作用。本研究首先研究不同浓度的和厚朴酚对正常内皮细胞的毒性作用,发现高浓度的和厚朴酚对内皮细胞的增殖产生抑制作用,提示高浓度和厚朴酚具有一定毒性。为探讨和厚朴酚对ox-LDL诱导的内皮细胞损伤作用,本研究使用不同浓度的和厚朴酚对ox-LDL处理的HUVECs进行处理。结果发现,在一定浓度范围内,和厚朴酚呈浓度依赖性促进HUVECs增殖,抑制凋亡。而且和厚朴酚可以缓解ox-LDL诱导的HUVECs氧化应激和内质网应激,提示和厚朴酚可能通过抑制氧化应激和内质网应激起到内皮保护作用。先前的研究表明,和厚朴酚可减少棕榈酸诱导的内皮细胞炎症反应,抑制内皮细胞一氧化氮的合成,改善内皮功能紊乱[15]。动物实验表明和厚朴酚可抑制新生内膜的形成,抑制平滑肌细胞增殖和细胞外基质的沉积[16]。我们首次发现和厚朴酚可保护ox-LDL诱导的内皮细胞损伤。机制层面,以往研究表明和厚朴酚可通过抑制炎症和氧化应激改善心肌缺血再灌注损伤[17]。类似的,和厚朴酚可通过抑制NADPH依赖的氧化应激通路,减轻高糖诱导的内皮细胞紊乱[18]。本研究发现和厚朴酚同样能抑制ox-LDL诱导的HUVECs氧化应激反应,减少ROS产生,增加抗氧化酶水平。已有研究证实PERK/eIF2α/CHOP通路参与ox-LDL介导的内皮细胞凋亡[19],而有研究者发现和厚朴酚可通过抑制ERS改善小鼠认知功能[20],表明和厚朴酚具有抑制ERS的作用。我们首次发现和厚朴酚可通过抑制PERK/eIF2α/CHOP通路,减轻ox-LDL诱导的ERS,抑制细胞凋亡。因此,我们有理由相信和厚朴酚可通过抑制氧化应激和ERS保护内皮细胞损伤。
综上所述,低浓度(0.1、1、10 μmol/L)的和厚朴酚对HUVECs 细胞无毒性作用而高浓度(50、100 μmol/L)和厚朴酚具有一定的细胞毒性;和厚朴酚对ox-LDL诱导的内皮细胞损伤具有保护作用,其机制可能是通过抑制氧化应激和ERS,从而起到抑制内皮细胞凋亡的作用。该研究结果将会为和厚朴酚在AS相关疾病如冠心病的开发应用提供可靠的科学依据。但ox-LDL诱导的氧化应激与ERS之间的关系,以及ERS其他通路在和厚朴酚保护内皮细胞中的作用尚不明确,有待于在今后的研究中进一步阐述。
