NaCl胁迫对5个桂花品种叶片超微结构的影响
2018-11-06杨秀莲高树桃施婷婷王良桂
杨秀莲,王 欣,高树桃,施婷婷,王良桂
(南京林业大学 风景园林学院,南京 210037)
土壤盐渍化是一个世界性的资源和生态问题。盐分是影响植物生长的一个重要环境因素。盐分胁迫对植物最普遍和最显著的效应就是抑制生长,盐胁迫会造成植物发育迟缓,抑制植物组织和器官的生长和分化,使植物的发育进程提前[1]。
桂花(Osmanthusfragrans)作为中国传统十大名花之一,是集绿化、美化、香化于一体,观赏与实用兼备的优良园林树种,桂花清可绝尘,浓能远溢,香气扑鼻,含多种香料物质,可用于食用或提取香料,具有极高的观赏价值、药用价值和文化价值[2]。然而,由于受土壤盐渍化影响,限制了桂花在沿海地区的园林绿化应用,研究桂花在盐胁迫条件下的生理响应,有助于筛选耐盐桂花品种在盐渍化地区的绿化美化, 杨秀莲等[3]通过综合考虑盐害症状初步确定3个桂花品种的耐盐性强弱排序为:笑秋风>潢川金桂>大叶银桂。
植物的生长与其耐盐性密切相关,研究盐渍条件下植物细胞的超微结构变化,有利于从机理上阐述植物的耐盐特征[4]。已有研究表明,经过一段时间的NaCl胁迫后,部分植物的形态结构会发生变化,如细胞膜脂过氧化程度加剧,细胞内物质大量外渗,膜的稳定性下降,叶绿体色素降低幅度较大,叶绿体结构松散变形,基粒片层模糊不清,失去完整的膜结构等[5]。膜结构的破坏导致植物叶片光合作用减弱,从而影响植物正常生长[6]。
桂花在逆境胁迫下的形态结构变化是桂花抗逆性研究的基础。气孔作为高等陆地植物表皮所特有的结构,是植物与环境气体交换的通道。植物叶片表皮上气孔的闭合、分布以及发育过程对外界环境的适应过程至关重要[7]。因此,本研究借助透射电镜和扫描电镜在不同NaCl胁迫条件下对幼苗叶片进行系统观察,比较5个桂花品种在NaCl胁迫下超微结构的差异,为进一步阐明桂花的NaCl胁迫反应机制提供科学依据,也有助于耐盐桂花品种的筛选。
1 材料和方法
1.1 试验材料
‘大叶银桂’(O.fragrans‘Daye Yingui’)、‘潢川金桂’(O.fragrans‘Huangchuan Jingui’)、‘笑秋风’(O.fragrans‘Xiao Qiufeng’)、‘晚籽银桂’(O.fragrans‘Wanzi Yingui’)和‘紫梗籽银桂’(O.fragrans‘Zigeng Ziyingui’)的一年生实生苗。
1.2 试验方法
1.2.1幼苗的培养将不同品种的桂花种子用质量分数为0.1%赤霉素浸泡24 h[8],于5 ℃恒温箱中沙藏培养。种子发芽后移栽到小型花盆中,于温室中培养。
1.2.2NaCl胁迫处理待幼苗长至5~6片真叶时,挑选长势一致的植株定植于基质为细沙的直径8 cm、高度11 cm的花盆中,每品种200株,缓苗生长后进行NaCl胁迫处理。具体方法为:在Hoagland培养液中分别添加NaCl,使培养液的最终盐浓度分别为0、70、100 mmol/L,为避免盐冲击效应,盐浓度每天递增30 mmol/L,直至预定浓度。处理期间,管理措施保持一致,然后每2 d定时、定量按预定盐浓度浇灌1次,浇灌量为持水量的2倍,约2/3溶液流出,从而交换以前的积余盐,以保持NaCl浓度的恒定。NaCl胁迫处理10 d后取各品种植株顶端第2对鲜嫩小叶进行透射电镜和扫描电镜的样品制备。
1.3 样品的制备与观察
1.3.1透射电镜观察法将叶片沿叶脉方向用刀片快速切取大小约2 mm×2 mm的叶片数块,取下的样品迅速放入2.5%戊二醛溶液中,真空泵抽气使材料下沉,4 ℃过夜,磷酸缓冲液(pH=7.2)冲洗3次,1%锇酸4 ℃下固定4 h,不同浓度梯度的乙醇脱水(30%、50%、70%、80%、90%、100%),每次10~15 min,100% 3次,其他浓度各1次。100%包埋剂浸透24 h后,用Epon812环氧树脂包埋,LKB超薄切片机切片,醋酸双氧铀染色30 min和柠檬酸铅染色15 min后,于透射电镜(HITACHI7650)下观察、拍照。
1.3.2扫描电镜观察法与透射电镜相同取样,用刀片将其切成约5 mm×5 mm的小块,快速投入2.5%戊二醛中,抽气使组织下沉后,于4 ℃下固定24 h,磷酸缓冲液冲洗3次,乙醇梯度脱水(30%、50%、70%、80%、90%、100%),丙酮和醋酸异戊酯混合液再次进行脱水处理,然后用纯醋酸异戊酯脱水,临界点干燥后,将样品粘贴在盖玻片上,放入真空喷镀仪进行喷镀。最后用扫描电镜(日立AMRAY 1000-B6)对桂花叶片表面和断面进行观察、拍照。
1.4 数据处理与分析
运用SPSS19.0和Excel 2010 进行数据处理和统计分析。采用Duncan 新复极差测验法(P<0.05) 进行处理间差异显著性检验。
2 结果与分析
2.1 不同NaCl胁迫条件下5个桂花品种叶肉细胞的超微结构
经过不同浓度NaCl 胁迫处理后,5个桂花品种叶肉细胞的超微结构均有一定的变化(表1),正常条件(0 mmol/L NaCl)下,5个桂花品种叶肉细胞排列疏松,各细胞器结构完整,清晰可见。叶绿体紧贴细胞壁,内部片层清晰,外形为长椭圆形,类囊体基粒清晰,并具有少量的淀粉粒。细胞核核膜清晰,内部染色质均匀分布(图版Ⅰ)。
NaCl胁迫下,叶绿体超微结构的变化表现出许多类似的共同特征:在70 mmol/L NaCl胁迫下,叶绿体轻微肿胀,基质片层轻微扩张,其中‘大叶银桂’中嗜锇颗粒增加;在100 mmol/L NaCl胁迫下,叶绿体表现出明显的肿胀,其中‘紫梗籽银桂’叶肉细胞的细胞器最为稳定,未发生质壁分离现象;而‘大叶银桂’被膜破坏,形状基本不能辨认;‘笑秋风’线粒体略微肿胀(图版Ⅱ, 图版Ⅲ)。
2.2 不同NaCl浓度胁迫对5个桂花品种叶片表面特征的影响
用扫描电镜观察5个桂花品种的幼叶,发现不同浓度NaCl处理下,其叶片表面的气孔器密度都有不同程度的变化,而且各品种叶片表面随着NaCl浓度的升高出现星芒状的蜡质纹饰,这样的特征有利于减少水分的蒸腾,以适应生境中因含有大量盐分而造成的生理干旱(图版Ⅳ)。
由表2可以看出,‘大叶银桂’、‘笑秋风’和‘紫梗籽银桂’的气孔器密度在0~70 mmol/L NaCl时随NaCl浓度的升高而增大,在100 mmol/L NaCl时气孔器密度明显减小,呈先升高后降低的趋势;说明这3个品种在低盐环境下通过增大气孔器的密度减少水分的蒸腾、保持体内的水分以避免生理干旱;当盐浓度提高到100 mmol/L时,可能超过了植物的耐受性,气孔器密度明显减小。而‘潢川金桂’和‘晚籽银桂’的气孔器密度则随盐浓度的升高呈持续增大的趋势,说明这2个品种在高盐浓度下依然能够通过增大气孔器密度来抵抗NaCl胁迫。可初步判定‘潢川金桂’和‘晚籽银桂’耐盐性略微高于‘大叶银桂’、‘笑秋风’和‘紫梗籽银桂’。
在盐渍环境下,植物通过减少气孔开张的数量,来减少体内水分的散失,以抵抗NaCl胁迫。由表2可以看出,5个品种开张的气孔密度和开张气孔的百分比均随着盐浓度的升高而呈降低趋势。不同浓度NaCl胁迫处理下,气孔开张密度差异显著。说明5个品种均无法抵抗盐渍环境的胁迫,而使得叶片表面的气孔不得不闭合,说明这5个桂花品种的耐盐性均较弱。
2.3 不同NaCl浓度胁迫对5个桂花品种叶片断面特征的影响
随着盐浓度的升高,5个品种的叶片厚度都呈下降趋势,盐浓度越大,叶片厚度越小。随着盐浓度的升高,‘大叶银桂’、‘潢川金桂’和‘紫梗籽银桂’的栅栏组织厚度呈先升高后降低的趋势;‘笑秋风’和‘晚籽银桂’则一直呈降低趋势。‘大叶银桂’、‘笑秋风’、‘晚籽银桂’的栅栏组织占叶厚的比重随盐浓度的升高而增加,在70~100 mmol/L NaCl之间,增加幅度分别为32.84%、1.48%、6.39% ;‘潢川金桂’和‘紫梗籽银桂’的栅栏组织占叶厚的比重则随盐浓度的升高而呈先增后降的趋势,在70~100 mmol/L NaCl之间,降低幅度分别为2.49%、10.73%。由图版Ⅴ可以看出,在正常无NaCl胁迫情况下,5个桂花品种叶片均由表皮、叶肉和叶脉3部分构成,为典型的背腹型叶。表皮细胞排列紧密,上表皮细胞较大,多数长方形。其下是叶肉组织,分化为栅栏组织和海绵组织。由2~5层柱形细胞构成的栅栏组织,排列整齐紧密,含叶绿体较多。栅栏组织下为排列疏松的海绵组织,其中含叶绿体较少,海绵组织的厚度及疏松度在不同品种间存在差异。叶肉组织下面为下表皮,细胞较小,排列不规则。在70 mmol/L NaCl胁迫下,‘大叶银桂’和‘紫梗籽银桂’的海绵组织细胞体积增大,细胞间隙也增大;‘晚籽银桂’和‘紫梗籽银桂’的叶肉细胞形态开始变得不规则;‘笑秋风’的变化不明显。在100 mmol/L NaCl胁迫下,5个品种桂花的叶肉细胞体积均缩小;‘大叶银桂’和‘紫梗籽银桂’的栅栏组织细胞和海绵组织细胞经历了减小-增大-减小的过程,说明细胞在短时间失水收缩后体积迅速增大,以适应盐分环境,而长时间胁迫导致细胞再次失水收缩。
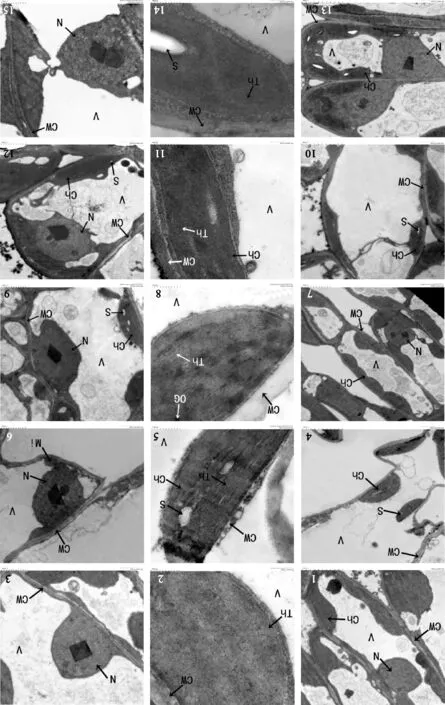
表2 不同NaCl浓度胁迫对5个品种叶片表面气孔的影响
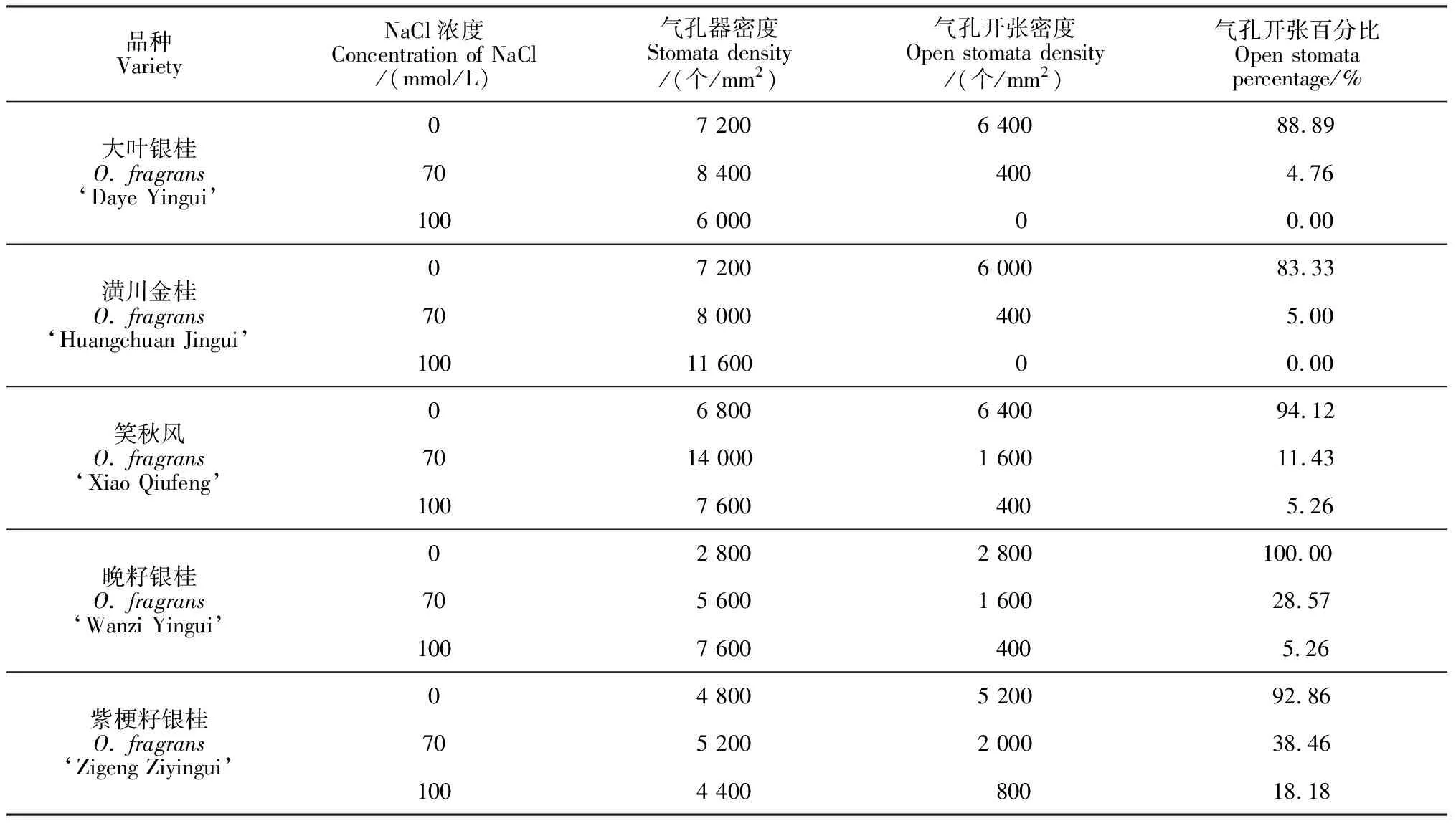
品种VarietyNaCl浓度Concentration of NaCl/(mmol/L)气孔器密度Stomata density/(个/mm2)气孔开张密度Open stomata density/(个/mm2)气孔开张百分比Open stomatapercentage/%大叶银桂O. fragrans‘Daye Yingui’07 2006 40088.89708 4004004.761006 00000.00潢川金桂O. fragrans‘Huangchuan Jingui’07 2006 00083.33708 0004005.0010011 60000.00笑秋风O. fragrans‘Xiao Qiufeng’06 8006 40094.127014 0001 60011.431007 6004005.26晚籽银桂O. fragrans‘Wanzi Yingui’02 8002 800100.00705 6001 60028.571007 6004005.26紫梗籽银桂O. fragrans‘Zigeng Ziyingui’04 8005 20092.86705 2002 00038.461004 40080018.18
3 讨 论
本结果表明,经过不同浓度NaCl 胁迫处理后,5个桂花品种叶肉细胞的超微结构均有一定的变化,但叶肉细胞内各细胞器对NaCl 胁迫的敏感性和耐受性不同。5个品种在正常条件(0 mmol/L NaCl)下,叶肉细胞超微结构基本不受影响,在中、高强度的NaCl胁迫下,5个品种叶肉细胞受到不同程度的伤害,尤其以叶绿体、线粒体和生物膜系统的表现较明显。
植物细胞正常的新陈代谢都是通过膜系统完成的,而生物膜是环境胁迫对植物造成伤害的原处部位,也是整个细胞区域和酶催化反应能有序进行的结构基础[4]。盐胁迫引起细胞器和膜结构的破坏,是植物受到盐害的共同特征,其破坏程度取决于植物耐盐性的强弱。凡是耐盐性强的品种,其细胞膜系统及细胞器的稳定性高,破坏程度小[9]。目前,盐胁迫的发生机理有两个方面:一是渗透胁迫,在盐胁迫下的植物细胞内渗透势大于细胞外渗透势,细胞失水导致植物缺水形成生理干旱;二是离子毒害作用,不同离子(Na+、K+、Cl-等)过量渗入细胞后,使原生质凝集,蛋白质合成受到抑制且水解作用加强,造成氨基酸积累。这些氨基酸又会转化为丁二胺、戊二胺等,达到一定浓度时,细胞就会中毒死亡。而且,这些离子(Na+、K+、Cl-等)的存在使得一些低浓度的矿质营养元素供应不足,降低了呼吸作用的强度,因此植物生长受抑。该试验中,NaCl浓度为70 mmol/L处理下,5个桂花品种的超微结构均出现明显变化,叶肉细胞的细胞核结构基本维持正常;而在100 mmol/L NaCl的条件下,细胞核内染色质发生凝聚,并聚集至核膜附近。推测染色质的凝聚可能是由于NaCl胁迫改变了细胞核内生物大分子(如核酸)的结构等,从而在分子水平上造成DNA 损伤,对细胞核造成不可逆的损害。
嗜锇体在电镜下观察为黑色颗粒,是强烈吸收锇酸的一些脂类物质聚集在一起形成的液滴,是叶绿体脂类物质的贮存库[10]。本试验中桂花叶肉细胞内叶绿体通过淀粉粒数目增多、体积增大,嗜锇体数量增多,基粒片层结构变松散,细胞器减少等方式对NaCl胁迫进行反应,这与前人的研究结果相似[11-15]。其中淀粉粒增多主要是由于光合作用的下降,光合产物以淀粉的形式沉积,也可能与高浓度盐碱阻碍了淀粉的水解和向外运输有关[13]。一些研究发现,盐胁迫下淀粉粒数量增加、体积增大,一方面可以水解释放能量,补充因胁迫损伤造成的能量供给不足;另一方面可以升高渗透压,提高细胞液浓度,保证细胞水分正常吸收,从而缓解细胞“生理干旱”[16]。
植物生长在复杂的自然界环境中,既接受周围环境提供的生长所需条件,同时也承受着不良因素的影响。植物为了适应不良环境,会在生理及结构上做出适应性调整[17]。已有的研究结果表明,盐胁迫会减少植物叶片面积,改变叶片的组织结构,增加叶片的气孔密度,降低植物的气孔导度和净光合速率[18],这与本研究的观察结果相似。光合作用是植物基本的生命活动,也是对逆境影响最敏感的生理过程之一。一般认为,盐胁迫导致光合作用下降的原因是气孔关闭导致的气孔限制[12]。气孔是植物光合作用气体进出和蒸腾作用水分散失的主要通道,气孔密度大小和气孔开张度对植物的光合作用和蒸腾作用都有重要的影响。通常为减少蒸腾水分散失,同时保证光合所需的CO2,旱生和盐生植物的上表皮气孔密度较低,气孔多处于关闭状态,而下表皮的气孔密度较大,气孔开张度较大[19]。气孔密度越大,吸收CO2的量就越多,从而提高植物的光合速率[20]。本研究发现随着NaCl胁迫浓度的增大,5个桂花品种叶表皮气孔密度较对照组有显著增加,而气孔开张的密度却不断减小。同时气孔的长度和宽度有所减少,说明桂花在NaCl胁迫环境中有相应的调整外部结构的适应能力,这与前人的研究结果相似[17]。
毛桂莲等[13]的研究结果表明,栅栏组织在植物适应逆境环境过程中起着重要作用,随着盐胁迫浓度的增加,植物栅栏组织结构紧密度下降,层数减少。组成栅栏组织的栅栏细胞上有大量的叶绿体,是植物进行光合同化作用的主要发生部位,因而栅栏组织越发达植株的光合效率越高。同时栅栏组织还有利于叶片内物质的横向运输[19]。又由于栅栏细胞垂直于叶面和维管组织排列,在充分利用光能的同时,有效降低了蒸腾面积,因而栅栏组织在叶肉中比例越高,越有利于防止其蒸腾作用造成的水分过度散失,保证正常代谢。本研究中,‘大叶银桂’、‘笑秋风’、‘晚籽银桂’的栅栏组织占叶厚的比重随盐浓度的升高而增大,‘潢川金桂’和‘紫梗籽银桂’的栅栏组织占叶厚的比重则随盐浓度的升高而呈先升增后降的趋势,由此可初步判断‘大叶银桂’、‘笑秋风’、‘晚籽银桂’的耐盐性略微高于潢川金桂和紫梗籽银桂。
盐胁迫条件下,植物自身的形态结构变化比较复杂。明确植物结构在盐胁迫下的变化有利于认识植物的耐盐机理。本研究为后续研究桂花的抗逆性研究提供一定价值的参考。
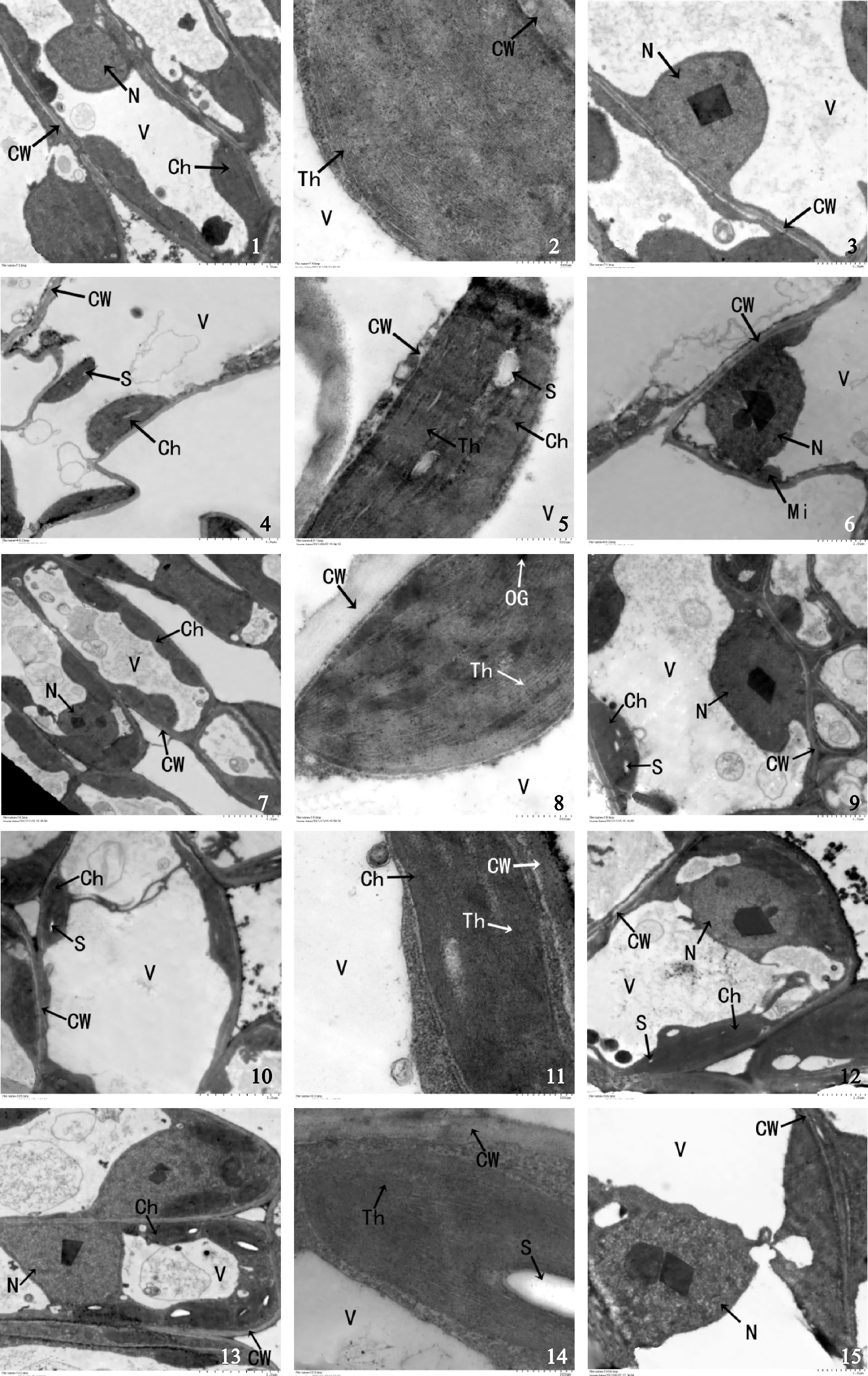
图版Ⅰ 0 mmol/L NaCl胁迫下5个品种叶肉细胞的超微结构
CW.细胞壁;N.细胞核;V.液泡;Ch.叶绿体;Th.类囊体片层;S.淀粉粒;Mi.线粒体;OG.嗜锇颗粒
1~3.大叶银桂; 4~6.潢川金桂;7~9.笑秋风;10~12.晚籽银桂;13~15.紫梗籽银桂.
Plate Ⅰ The leaf cell ultrastructure of five varieties’ under 0 mmol/L NaCl
CW. Cell wall; N. Cell nucleus; V. Vacuole; Ch. Chloroplast; Th. Thylakoid lamella; S. Starch grain; Mi. Mitochondrion; OG. Osmiophilic granule
1-3. O. fragrans ‘Daye Yingui’; 4-6. O. fragrans ‘Huangchuan Jingui’;7-9. O. fragrans ‘Xiao Qiufeng’ ;10-12. O. fragrans ‘Wanzi Yingui’;13-15. O. fragrans ‘Zigeng Ziyingui’
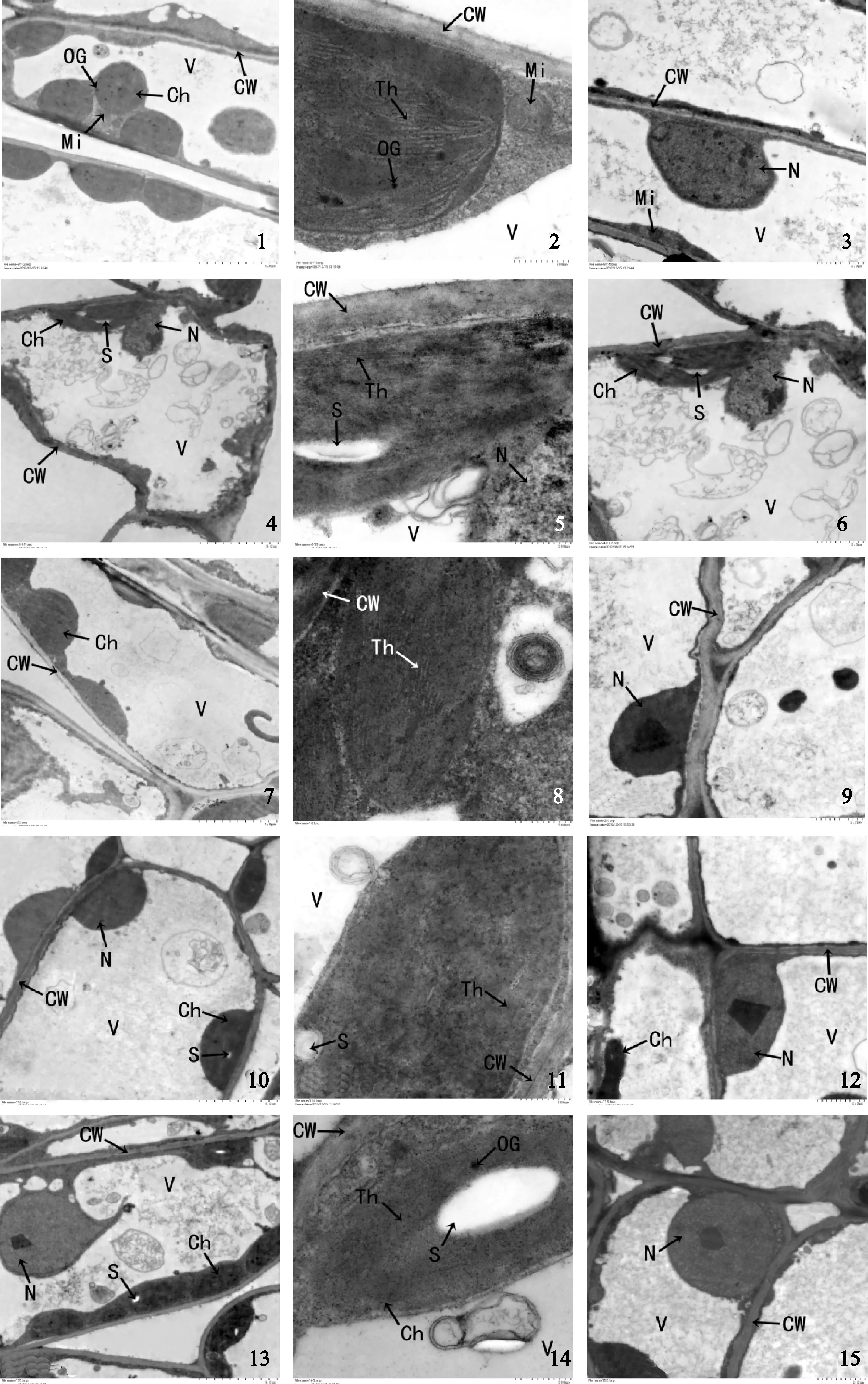
图版Ⅱ 70 mmol/L NaCl胁迫下5个品种叶肉细胞的超微结构
OG.嗜锇颗粒;Mi.线粒体;Ch.叶绿体;V.液泡;CW.细胞壁;Th.类囊体片层; N.细胞核;S.淀粉粒
1~3.大叶银桂; 4~6.潢川金桂;7~9.笑秋风;10~12.晚籽银桂;13~15.紫梗籽银桂.
Plate Ⅱ The leaf cell ultrastructure of five varieties’ under 70 mmol/L NaCl
OG. Osmiophilic granule; Mi. Mitochondrion; Ch. Chloroplast; V. Vacuole; CW. Cell wall; Th. Thylakoid lamella; N. Cell nucleus; S. Starch grain
1-3. O. fragrans ‘Daye Yingui’; 4-6. O. fragrans ‘Huangchuan Jingui’;7-9. O. fragrans ‘Xiao Qiufeng’ ;10-12. O. fragrans ‘Wanzi Yingui’;13-15. O. fragrans ‘Zigeng Ziyingui’
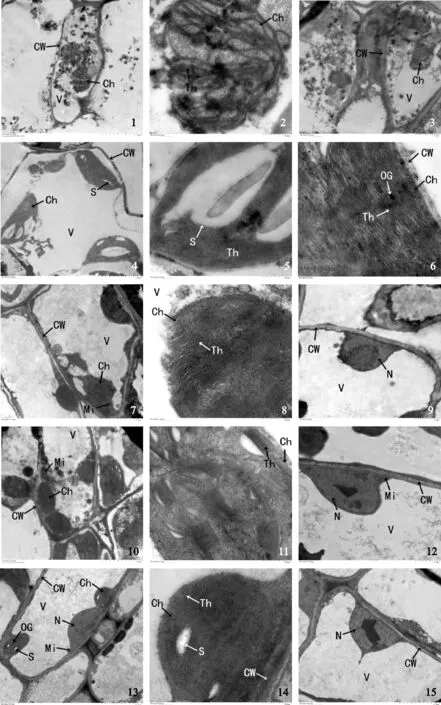
图版Ⅲ 100 mmol/L NaCl胁迫下5个品种叶肉细胞的超微结构
CW.细胞壁;Ch.叶绿体;V.液泡;Th.类囊体片层;S.淀粉粒;OG.嗜锇颗粒;Mi.线粒体;N.细胞核
1~3.大叶银桂; 4~6.潢川金桂;7~9.笑秋风;10~12.晚籽银桂;13~15.紫梗籽银桂.
Plate Ⅲ The leaf cell ultrastructure of five varieties’ under 100 mmol/L NaCl
CW. Cell wall; Ch. Chloroplast; V. Vacuole; Th. Thylakoid lamella; S. Starch grain; OG. Osmiophilic granule; Mi. Mitochondrion; N. Cell nucleus
1-3. O. fragrans ‘Daye Yingui’; 4-6. O. fragrans ‘Huangchuan Jingui’;7-9. O. fragrans ‘Xiao Qiufeng’ ;10-12. O. fragrans ‘Wanzi Yingui’;13-15. O. fragrans ‘Zigeng Ziyingui’
图版Ⅳ 不同浓度NaCl胁迫下5个品种叶片表面的扫描电镜观察
1~3. 分别示0、70、100 mmol/L NaCl胁迫下的大叶银桂; 4~6. 分别示0、70、100 mmol/L NaCl胁迫下的潢川金桂;7~9. 分别示0、70、100 mmol/L NaCl胁迫下的笑秋风;10~12. 分别示0、70、100 mmol/L NaCl胁迫下的晚籽银桂;13~15. 分别示0、70、100 mmol/L NaCl胁迫下的紫梗籽银桂.
Plate Ⅳ The scanning electron microscopy of five varieties’ leaf surface in different concentrations of NaCl
1-3. Shows O. fragrans ‘Daye Yingui’ in 0, 70, 100 mmol/L NaCl; 4-6. Shows O. fragrans ‘Huangchuan Jingui’ in 0, 70, 100 mmol/L NaCl ;7-9. Shows O. fragrans ‘Xiao Qiufeng’ in 0, 70, 100 mmol/L NaCl;10-12. Shows O. fragrans ‘Wanzi Yingui’ in 0, 70, 100 mmol/L NaCl; 13-15. Shows O. fragrans ‘Zigeng Ziyingui’ in 0, 70, 100 mmol/L NaCl
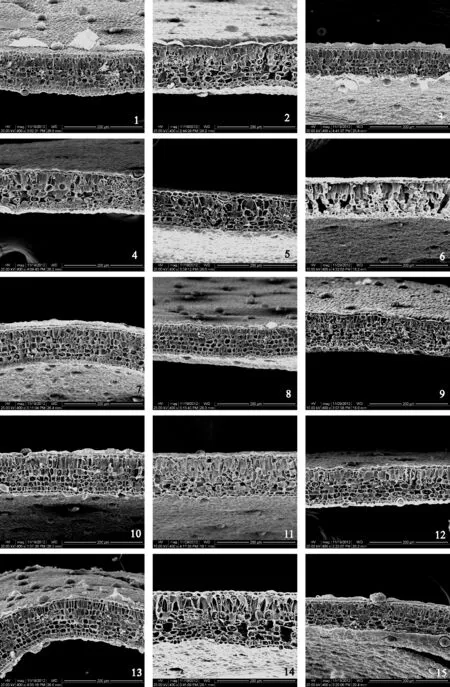
图版Ⅴ 不同浓度NaCl胁迫下5个品种叶片断面的扫描电镜观察
1~3. 分别示0、70、100 mmol/L NaCl胁迫下的大叶银桂; 4~6. 分别示0、70、100 mmol/L NaCl胁迫下的潢川金桂;7~9. 分别示0、70、100 mmol/L NaCl胁迫下的笑秋风;10~12. 分别示0、70、100 mmol/L NaCl胁迫下的晚籽银桂;13~15. 分别示0、70、100 mmol/L NaCl胁迫下的紫梗籽银桂
PlateⅤ The scanning electron microscopy of five varieties’ leaf section in different concentrations of NaCl
1-3. Shows O. fragrans ‘Daye Yingui’ in 0, 70, 100 mmol/L NaCl; 4-6. Shows O. fragrans ‘Huangchuan Jingui’ in 0, 70, 100 mmol/L NaCl ; 7-9. Shows O. fragrans ‘Xiao Qiufeng’ in 0, 70, 100 mmol/L NaCl; 10-12. Shows O. fragrans ‘Wanzi Yingui’ in 0, 70, 100 mmol/L NaCl; 13-15. Shows O. fragrans ‘Zigeng Ziyingui’ in 0, 70, 100 mmol/L NaCl
