矮牵牛PhTPS5基因的克隆与表达分析
2018-11-06刘同瑞张水明董丽丽
刘 娜,王 琦,刘同瑞,熊 枫,张水明,董丽丽
(安徽农业大学 园艺学院,合肥 230036)
分枝发育是决定植物地上部分形态建成的重要因素,是植物适应环境,竞争营养,提高自身产量和观赏性状的有效手段。植物的分枝起源于腋生分生组织,形成于叶腋部位。腋生分生组织起始后产生叶片形成腋芽,新形成的腋芽可以继续萌发,也可以进入休眠。而休眠的腋芽在受到内部因素或外部因素的影响后会重新被激活开始萌发[1]。
研究表明:生长素在茎中耗减的速度不足以引起去顶后芽的快速生长;而去除顶端的同时去除叶片,腋芽并不能快速萌发;放射性同位素标记实验显示去除顶端后糖分能够快速地向腋芽聚集[2]。在完整植株中,外源施加糖能够快速诱导腋芽萌发,改变生长素含量而不改变糖含量则并不能影响腋芽的萌发。因此,糖分在腋芽中的快速积累是腋芽后续萌发的必备条件[2]。Mason等[2]证实豌豆去顶2.5 h后,糖会诱使距顶部40 cm处的基部腋芽明显生长,鉴于糖类在植物茎中的运输速度可达150 cm/h,推测这种快速的信号转导是糖分的作用。此外,人工施加蔗糖2 h内会导致BRC1表达量下调。说明糖分在调控植物的分枝发育中,能够作为信号分子起作用。
海藻糖(Trehalose)是广泛存在于多种有机体中的一类重要多糖。TPS是海藻糖合成的关键基因,也是腋芽萌发时最早响应的基因之一[3]。研究表明TPS成员有多个,虽然有的TPS成员不具有TPS蛋白的催化活性,但缺失后仍能够引起花序分枝的增多[4], 说明TPS蛋白至少部分通过信号调控途径影响植物的生长发育。
矮牵牛(PetuniahybridaVilm.)既是重要的观赏植物,也是常见的模式植物。因此,本研究以矮牵牛为研究材料,克隆获得了TPS5同源基因,对PhTPS5基因的序列以及表达特性进行了分析。该研究不但对于研究糖分调控矮牵牛分枝发育的机理奠定了基础,并且对于培育具有不同分枝特性的矮牵牛新品种具有重要的实际应用价值。
1 材料与方法
1.1 实验材料
该研究以矮牵牛(P.hybrida)为试材。矮牵牛全基因组数据库见于Sol Genomics Network(https://solgenomics.net/)。其他物种的TPS蛋白序列来源于NCBI。
矮牵牛实生苗种置于智能人工气候箱中(RTOP-430B),组培苗放置于组织培间中。温度均设置为(23±2)℃,光照强度为3 500 Lx,光周期为16 h/8 h (光/暗)。
1.2 方 法
1.2.1PhTPS5基因全长序列的克隆以已经公布的矮牵牛基因组序列为参考,设计上游引物PhTPS5-F(ATGGTTTCGAGGTCATATTCCA-ACT), 下游引物PhTPS5-R (CTATTCTCGGTCA-ATGATTACGCG)。取矮牵牛叶片,使用EZ-10总RNA小量提取试剂盒 (上海生工生物工程有限公司)提取RNA,并反转录成cDNA。以F/R作为引物,使用高保真酶进行扩增获得PhTPS5序列。将克隆获得的序列经加A反应后连接到pGEM-Teasy载体, 鉴定阳性克隆送由上海生工生物工程公司进行测序。
1.2.2PhTPS5的表达分析组织特异性表达实验:分别取矮牵牛根、茎、叶、花、叶腋等部位。使用EZ-10总RNA小量提取试剂盒提取RNA;去顶及IAA处理实验:将矮牵牛分为两组,第一组分别于去除顶端6和24 h后取叶腋部位提取RNA,反转录后用于基因表达水平的检测。另一组去除顶端的同时施加10 μL IAA(50 μmol/L),分别于6和24 h后取下方2~3个叶腋部位提取RNA,对基因的表达水平进行检测;6-BA处理实验:于自顶端向下的第4个叶腋处施加10 μL 6-BA(50 μmol/L),分别于6和24 h后取处理的腋芽提取RNA,用于基因表达水平的检测。每个处理12棵苗,共进行3次生物学重复。反转录及荧光定量PCR参照董丽丽等的方法[5];根据获得的PhTPS5的全长序列,设计荧光定量PCR引物PhTPS5-RT-F(TGCCTCACTTTCCCCCGTCG)和PhTPS5-RT-R(TTCTTGCTTTGTTTTTCCTT)。使用Actin作为内参基因。
1.2.3数据分析利用SPSS17.0软件对数据进行统计分析,使用Excel绘制柱状图。
2 结果和分析
2.1 矮牵牛PhTPS5基因全长的克隆与序列分析
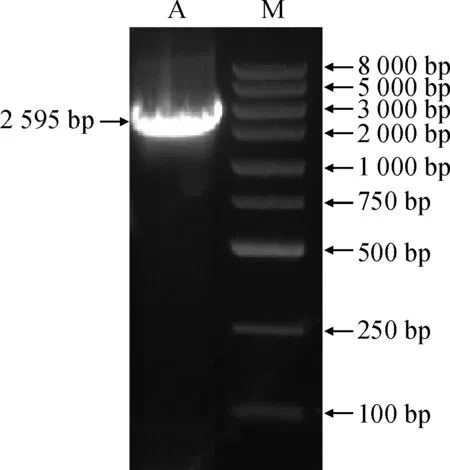
M.DL8000;A.PhTPS5全长验证产物图1 PhTPS5基因的扩增结果M.DL8000;A.Full length product of PhTPS5Fig.1 Amplification results of PhTPS5
根据已经公布的腋花矮牵牛(P.axillaris)基因组序列,设计引物克隆获得PhTPS5 cDNA序列。该序列全长2 595 bp,编码864个氨基酸 (图1)。利用Expasy对PhTPS5蛋白序列进行分析,推测PhTPS5蛋白的分子式C4363H6825N1173O1289S37,该蛋白中相对含量较多的氨基酸是10.0% Leu、9.0% Val、7.8% Ser、6.9% Asp、6.4% Glu;总的带负电荷的残基(Asp+Glu)为115,总的带正电荷的残基(Arg+Lys)为98。
2.2 矮牵牛PhTPS5的序列分析
将PhTPS5与烟草、辣椒、番茄的蛋白序列进行比对,序列相似性分别为94.35%、92.94%和92.71% (图2)。TPS家族蛋白通常含有TPS与TPP结构域。研究表明在大肠杆菌TPS结构域中存在结合葡萄糖-6-磷酸的OtsA Arg9、Trp40、Tyr76、Trp85、Arg300,以及结合UDP的Gly22、Aspl30、Hisl54、Arg262、Asp361、Glu369[6]。将PhTPS5与OtsA进行比对发现:OtsA Arg9对应的氨基酸残基变为缬氨酸 (Val), Gly22变为丝氨酸 (Ser),Arg262变为天冬氨酸(Asp),其他位点没有变化。

CaTPS5. 辣椒(XP_016572806);SlTPS5.番茄(XP_004245918); NaTPS5.烟草(XP_016440934);OtsA.大肠杆菌(WP_105484222)图2 PhTPS5与其他物种的TPS5比对CaTPS5.Capsicum annuum (XP_016572806); SlTPS5.Solanum lycopersicum(XP_004245918);NaTPS5.Nicotiana tabacum(XP_016440934);OtsA.Escherichia coli (WP_105484222)Fig.2 Alignment of PhTPS5 with other TPS5s
2.3 PhTPS5基因的表达分析
利用荧光定量PCR技术,对PhTPS5在不同组织中的表达特性进行分析,结果表明PhTPS5在矮牵牛的根、茎、叶、叶腋、花中均有表达。其表达水平从高到低依次为:根>叶腋>茎>花>叶。根中的表达量约为茎中的5倍,而叶片中的表达量约为茎中的1/35 (图 3)。
2.4 去顶诱导PhTPS5基因的表达
去顶能够引起腋芽的萌发,为研究去顶对PhTPS5基因的调控作用,分别在去顶6和24 h后检测该基因的表达水平,结果(图4)显示:去顶6 h后,PhTPS5的表达水平上升至未去顶的11倍。去顶24 h后,PhTPS5的表达水平显著下降,但仍为未去顶植株中的2倍。生长素能够间接抑制腋芽的萌发,为研究生长素对PhTPS5的调控作用,去顶后迅速于茎截面施加IAA,6 h时PhTPS5表达水平约为完整植株中的2.8倍,显著低于去顶6 h未施加IAA时的表达水平。在24 h时,PhTPS5表达水平下降至完整植株中的1.46倍,仍然低于去顶24 h未施加IAA时的表达水平。
2.5 细胞分裂素促进PhTPS5的表达
细胞分裂素能够通过调控下游基因直接促进腋芽的萌发。为研究细胞分裂素对PhTPS5的调控,对矮牵牛腋芽施加6-BA,分别于6和24 h后对PhTPS5的表达水平进行检测。结果(图5)表明:6-BA施加6 h后,PhTPS1的表达水平上调约8.9倍,而24 h后PhTPS1的表达水平下降为对照的7.3倍。
3 讨 论
TPS途径及其功能研究侧重于植物的干旱、高温、低温、盐等逆境胁迫及花期调控[7-8]。然而,近来研究发现海藻糖前体T6P能够调控植物的分枝发育[9-10]。T6P在植物体内以微量形式存在,其含量通常低于10 nmol/g鲜重,且不能够运输,在各个细胞中均需从头合成[11]。根据目前已有研究,一致认为T6P在调控植物的抗逆、花期、分枝发育等方面均能够作为信号分子起作用[10]。
本研究从矮牵牛中克隆了TPS5的同源基因,该基因编码864个氨基酸,与同为茄科的辣椒、番茄、烟草相似性均在92%以上。组织特异性表达分析显示,PhTPS5在根中表达量最高,叶片中最低,这与苹果中TPS5在花中表达量最高,茎中表达量最低的结果不同[12]。说明不同物种中TPS5的表达特性并不相同。
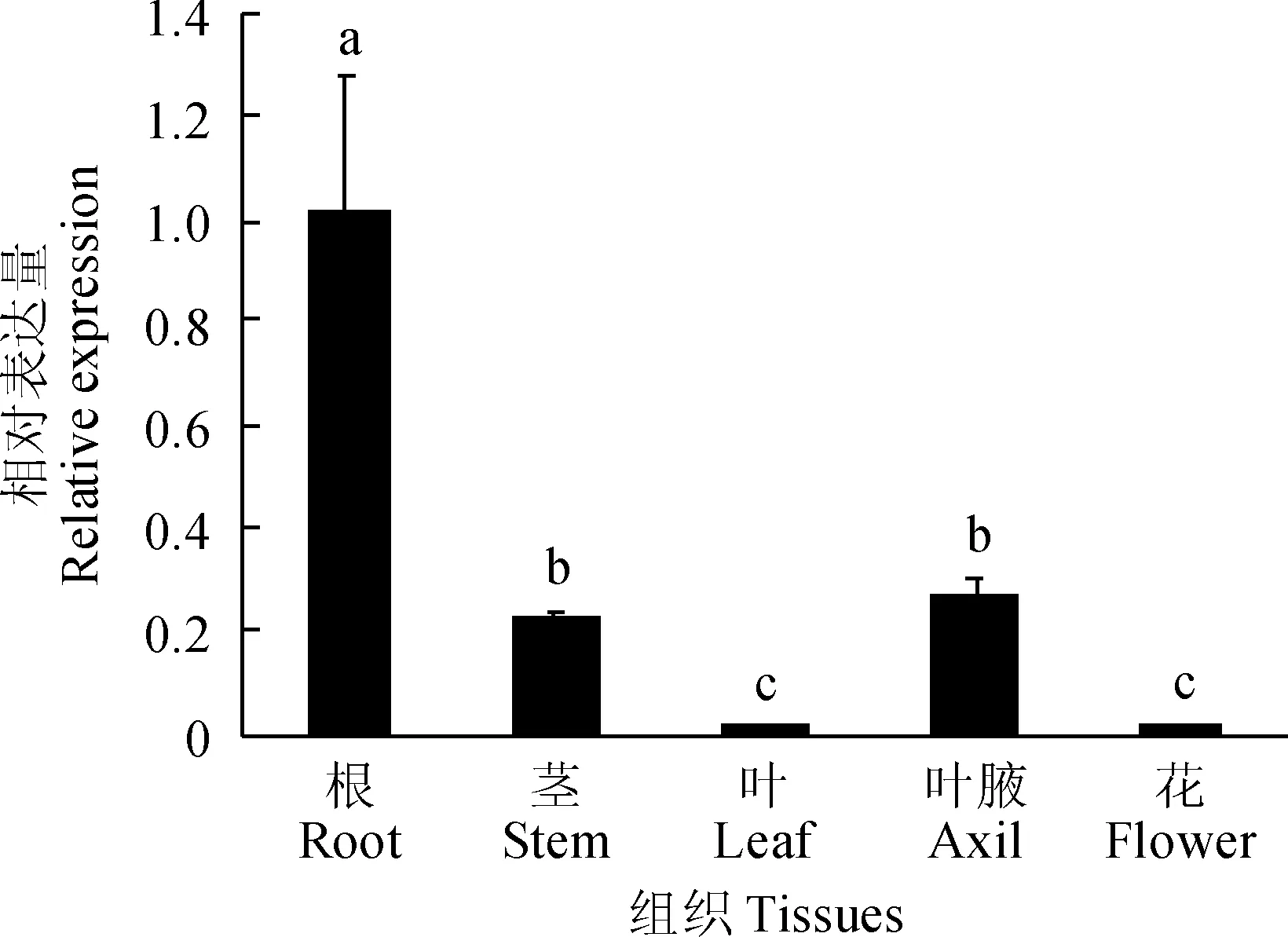
图中不同小写字母表示不同组织在0.05水平存在显著性差异图3 矮牵牛不同组织PhTPS5的相对表达量The different letters in the figure indicated that there were significant differences in different tissues at the 0.05 levelFig.3 The relative expression of PhTPS5 in different tissues of petunia
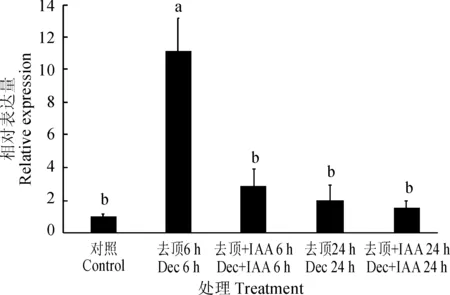
图中小写字母表示不同处理在0.05水平存在显著性差异图4 去顶及生长素影响促进PhTPS5基因的表达The different letters in the figure indicated that there were significant differences in different treatments at the 0.05 levelFig.4 Decapitation and auxin treatment regulated the expression of PhTPS5
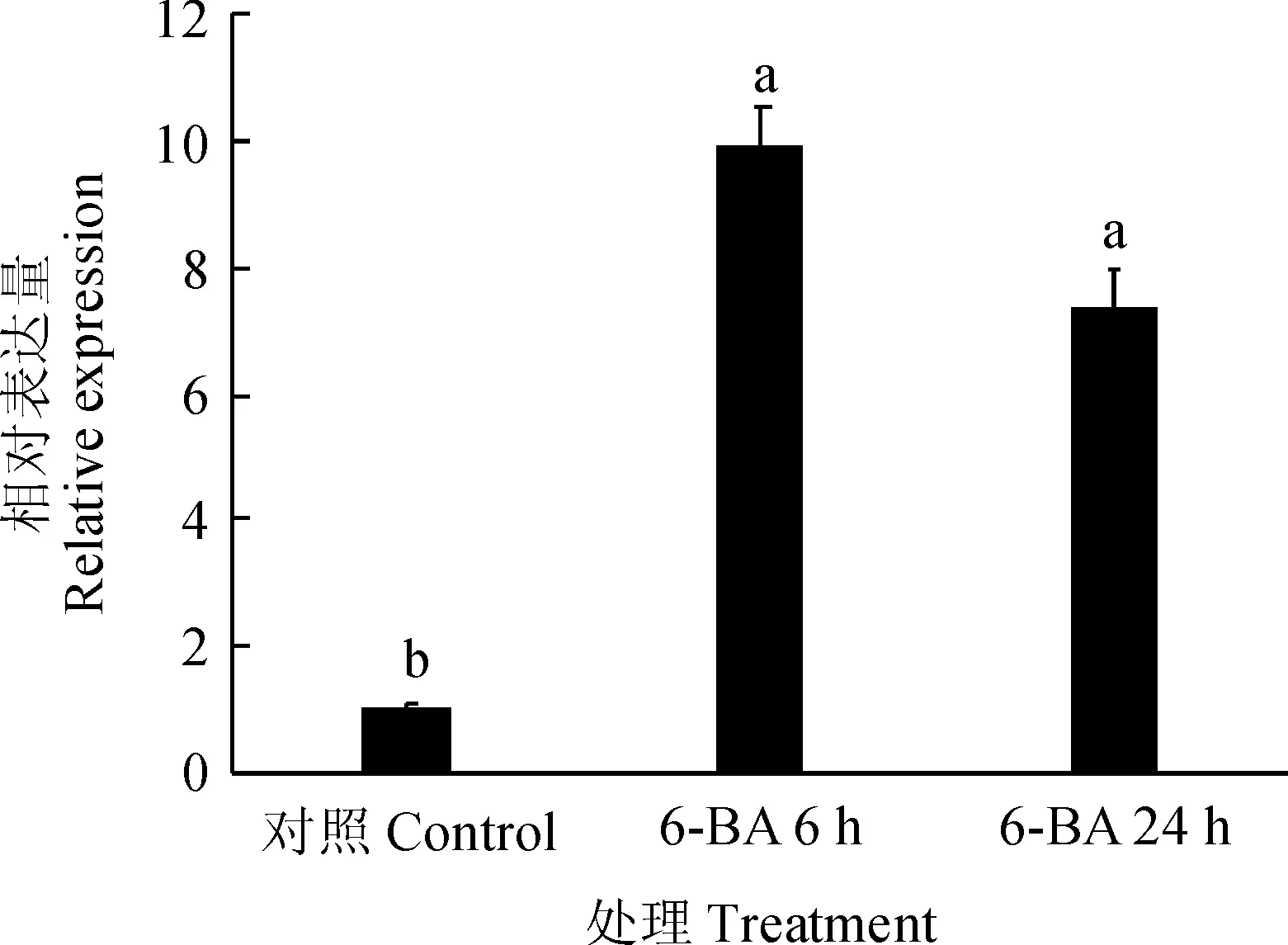
图5 6-BA促进PhTPS5基因的表达Fig.5 6-BA promoted the expression of PhTPS5
研究表明糖分能够快速诱导腋芽的萌发,且去顶后糖分快速地向腋芽集中[2],说明腋芽的萌发需要糖分的积累。此外,研究表明:有的TPS成员虽不具有TPS蛋白的催化活性,但缺失后仍能够引起花序分枝的增多[4], 说明TPS蛋白至少部分通过信号调控途径影响植物的生长发育。因此,矮牵牛去顶6 h后,PhTPS5表达量迅速上调,一方面说明去顶能够诱导局部海藻糖的快速合成以促进腋芽的萌发。另一方面PhTPS5有可能直接作为信号分子起作用,从而激活下游路径。在去顶24 h时,PhTPS5表达水平明显下降,说明PhTPS5可能主要在激活腋芽萌发的阶段起作用,当腋芽进入萌发阶段后,海藻糖合成速度下降。而去顶后立即施加IAA,则明显抑制了PhTPS5表达量的上调,说明生长素能够抑制去顶对下游TPS途径的激活。
细胞分裂素能够直接促进腋芽的萌发。对矮牵牛叶腋部位施加6-BA 6 h后,PhTPS5的表达量迅速上调,说明细胞分裂素能够通过调控PhTPS5的表达来调节局部海藻糖的快速合成,也可能通过调控PhTPS5激活下游路径以促进腋芽的萌发。在24 h时PhTPS5的表达水平逐渐下降,进一步说明PhTPS5可能主要在腋芽萌发的早期阶段起作用。
为进一步确定PhTPS5的调控机理,本研究后续将通过过表达实验分析PhTPS5的转录水平与分枝发育的关系。本研究为阐明TPS途径在矮牵牛分枝发育中的调控机制奠定了理论基础,同时对于改善矮牵牛株型提供了基因资源。
