茶树CsBAP1基因的克隆与非生物胁迫和激素响应分析
2018-11-06王文丽滕瑞敏
王 瑜,王文丽,李 辉,刘 昊,滕瑞敏,庄 静
(南京农业大学 园艺学院,茶叶科学研究所,南京210095)
茶树作为多年生常绿经济作物,在生长周期内会受多种逆境的胁迫,如低温、干旱、盐渍、洪涝以及病虫害等[1]。茶树通过感知外界环境信号,并通过胞内信号转导来调控相关基因的表达变化,从而调节自身的物质代谢和生长发育等来适应或抵御不良环境的影响,激素在植物逆境响应中扮演重要的作用[2]。
BAP1(BON1-associated protein)是一种BON1相关蛋白,属于C2超家族,含有典型的C2结构域,此类蛋白大多是Ca2+依赖性磷脂结合蛋白,定位于细胞质膜上[3]。C2功能域为Ca2+调节功能域,参与蛋白与蛋白互作,GTP酶的激活及蛋白质磷酸化等过程,在细胞信号转导以及细胞膜运动中起重要作用[4-7]。在植物中,胞质内游离Ca2+浓度的变化,包括瞬间增加、持续变化或震荡均能引起细胞内信号的传递,这些过程需要大量Ca2+结合蛋白与下游信号通路相耦合[8-10]。在高等真核生物中,Ca2+作为细胞内重要的第二信使,在响应激素、光、氧化胁迫、干旱、极端温度、病原体侵害等多种外源刺激时发挥重要影响[11-12]。如干旱胁迫能够引起细胞质基质Ca2+浓度的变化,下游信号通路响应Ca2+浓度变化引起一系列细胞信号转导过程,进而诱导胁迫应答基因的表达。
拟南芥(Arabidopsisthaliana)的BAP1是一个含C2结构域的钙依赖磷脂结合小蛋白,在植物体内具有多种功能,低温条件下可诱导植物细胞扩增和细胞分裂[13];同样含有C2保守功能域的BON1/CPN1蛋白能与其互作以共同负调节植物的防御反应[14];过表达AtBAP1可抑制细胞的程序性死亡[15]。VvBAP1参与葡萄抵御低温及盐胁迫的过程,葡萄‘F-242’叶片经低温及NaCl处理后,其表达量均受诱导升高[16]。植物中,BAP1参与植物响应逆境胁迫的过程,目前茶树中CsBAP1基因的功能与作用机制尚不清楚。
本研究选取茶树‘龙井43’为材料,克隆获得茶树CsBAP1基因,并进行了序列比对、理化性质和三级结构等方面的分析。利用荧光定量PCR技术,研究了CsBAP1基因在茶树‘龙井43’的不同组织中以及非生物和激素胁迫下的表达模式,为进一步研究BAP1基因在茶树中的生物学功能提供一定的基础。
1 材料与方法
1.1 实验材料
供试茶树材料为‘龙井43’(Camelliasinensiscv.‘Longjing 43’)两年生扦插盆栽幼苗,来自南京农业大学茶叶科学研究所。取‘龙井43’幼嫩叶片,提取总RNA,反转录成cDNA,作为克隆CsBAP1基因的模板。
对生长良好、大小一致的茶树叶片分别喷施脱落酸(0.1 mmol·L-1ABA)、茉莉酸甲酯(1 mmol·L-1MeJA)、吲哚乙酸(1 mmol·L-1IAA)、赤霉素(1 mmol·L-1GA3)和水杨酸(1 mmol·L-1SA),处理2 h后取样,以未处理的植株作为对照。此外对自然生长状态下的植株进行非生物胁迫处理,高温(38 ℃)、低温(4 ℃)、干旱(200 g·L-1PEG)、高盐(200 mmol·L-1NaCl)分别处理0、2、4、8和24 h后取样。‘龙井43’茶树的花蕾、花、幼叶、成熟叶和老叶作为不同组织基因表达材料。对上述所取得的样品,进行RNA提取和cDNA合成,用于实时荧光定量的模板。
1.2 方 法
1.2.1总RNA提取和cDNA合成茶树材料的总RNA按照Quick RNA Isolation Kit(北京华越洋公司)试剂盒说明书来提取。RNA样品浓度利用Nanodrop ND 1000(上海谱元仪器有限公司)微量紫外分光光度计检测, RNA质量用1.2%凝胶电泳检测。参照Prime Script RT reagent Kit(大连TaKaRa公司)试剂盒说明书将总RNA反转录成cDNA。
1.2.2茶树CsBAP1基因克隆基于本课题组茶树转录组数据[17],设计1对特异引物CsBAP1-QF(5′-ATGGCAACAACATCACGA-3′)和CsBAP1-QR(5′-TCAGTAATACCTAG ACCAAACC-3′)。扩增体系采用:10 μL 2×TaqPlus Master Mix酶、7 μL ddH2O、1 μL模板、CsBAP1-F/R引物各1 μL,共20 μL体系。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共35个循环;72 ℃延伸10 min。回收PCR产物并连接至pMD19-T载体,随即转化到大肠杆菌感受态细胞。抽提质粒后送至南京金斯瑞生物科技有限公司进行测序。
1.2.3生物信息学分析利用DNAMAN 6.0软件完成氨基酸序列的多重比对和亲疏水性分析。利用在线工具包ExPASy-ProtParam(http://web.expasy.org/protparam)和(SMS)(http://www.bio-soft.net/sms)分析氨基酸的组成以及理化性质。选择MEGA 7.0软件进行系统发育树的构建。利用在线软件NetPhos(http://www.cbs.dtu.dk/services/NetPhos)分析磷酸化位点。氨基酸序列折叠无序化分析利用在线网站FoldIndex(https://fold.weizmann.ac.il/fldbin/findex)。蛋白质二级结构预测在SOPMA网站(http://npsa-pbil.ibcp.fr/cgi-bin/npsa)上进行。蛋白质三级结构模型利用Swiss-Model(http://www.Swissmodel.expasy.org)构建。利用Microsoft Excel 2010软件制作完成荧光定量PCR数据分析和图表绘制。
1.2.4茶树CsBAP1基因的表达特性分析按照SYBR PremixExTaq试剂盒(大连TaKaRa公司)的操作说明进行实时荧光定量PCR。CFX96TMreal-time PCR system作为荧光定量PCR平台。CsBAP1检测引物CsBAP1-qrtF(5′-ACTTCGCCGGAGGTTACTTT-3′)和CsBAP1-qrtR(5′-GGA-GACAATCCCACCAGAAA-3′)。选择茶树GAPDH作为内参基因[18],引物分别为CsGAPDH-JF(5′-TTGGCATCGTTGAGGGTCT-3′)和CsGAPDH-JR(5′-CAGTGGGAACACGGAAA-GC-3′),采用2-ΔΔCT方法进行相对定量计算[19]。
2 实验结果
2.1 茶树CsBAP1基因的克隆
选择生长健康、正常、无病虫侵害的‘龙井43’扦插幼苗嫩叶的cDNA作为模板。以CsBAP1-QF和CsBAP1-QR为引物对模板进行PCR扩增,得到扩增片段约500 bp。序列测定分析结果表明,茶树CsBAP1开放阅读框长度为543 bp,共编码180个氨基酸(图1)。
2.2 茶树CsBAP1蛋白氨基酸序列比对
茶树CsBAP1保守域预测(图3,A)结果显示,CsBAP1蛋白在7~127个氨基酸位点之间,含有一个Ca2+依赖性膜结合位点的C2功能结构域,属于C2-SRC2-like亚家族。将茶树CsBAP1同拟南芥(Arabidopsisthaliana)、葡萄(Vitisvinifera)、碧桃(Prunuspersica)等的BAP1氨基酸序列进行多重序列比对,结果(图3,B)显示一致性达50.50%,且上述物种均有C2结构域。
2.3 茶树CsBAP1进化树分析
为了进一步探究茶树CsBAP1蛋白与其他物种的进化关系,对其进行Blastx同源检索与比对,得到不同物种间与其相似程度较高的BAP1蛋白氨基酸序列,选用拟南芥、葡萄、碧桃等共13个物种,与茶树CsBAP1蛋白构建进化树关系图(图2)。结果显示:茶树CsBAP1蛋白与芝麻、葡萄等物种亲缘关系较近,与番木瓜、野生大豆等物种的亲缘关系较远。

图1 茶树CsBAP1核苷酸序列与推测的氨基酸序列Fig.1 The nucleotide and amino acid sequences of CsBAP1 from tea plant
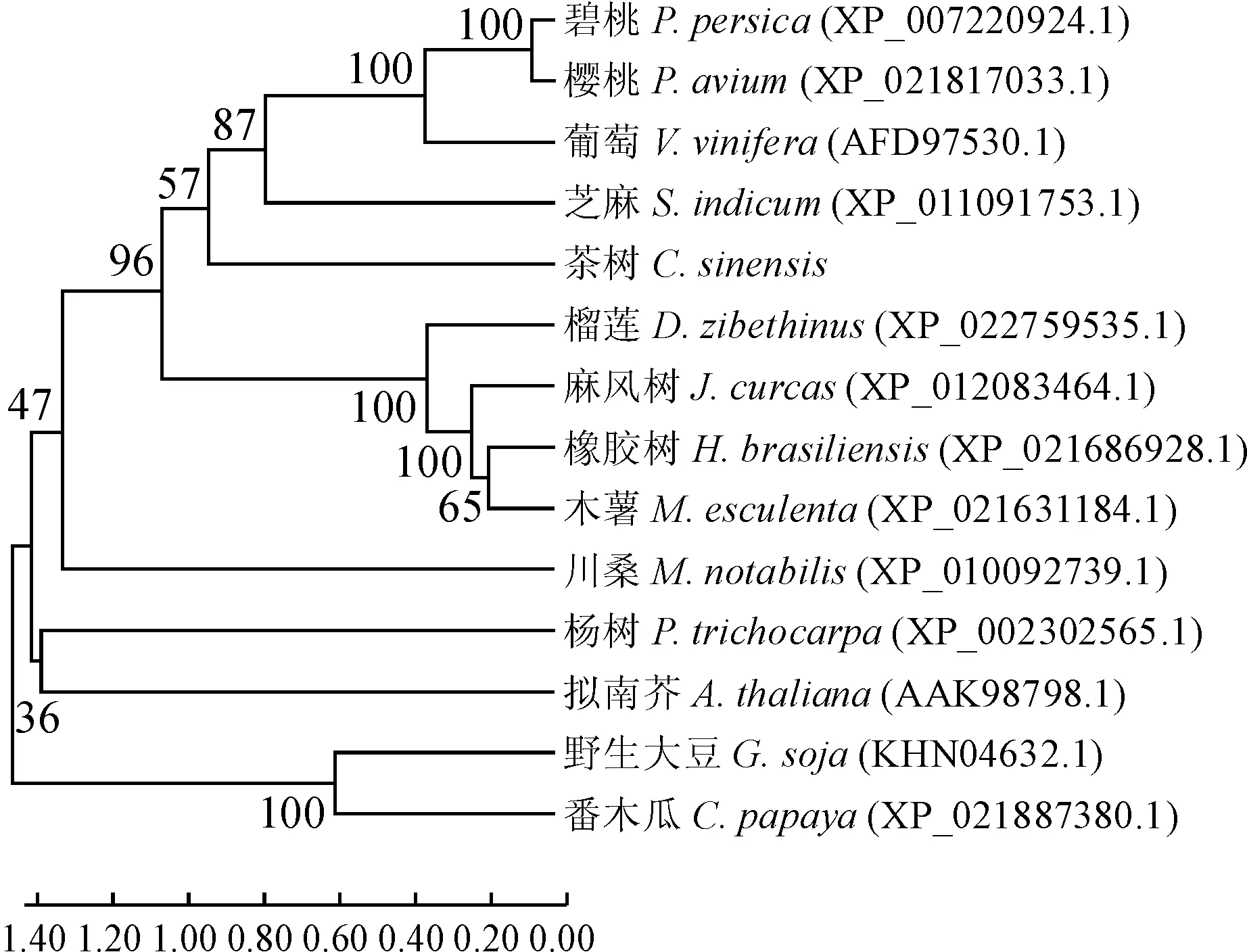
图2 茶树CsBAP1蛋白的进化树分析Fig.2 Phylogenetic tree analysis of tea plant CsBAP1 protein
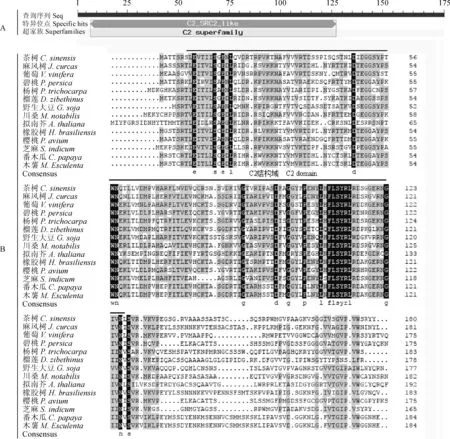
图3 茶树CsBAP1蛋白的保守域(A)与其他物种氨基酸序列的多重比对(B)Fig.3 The conserved domains of CsBAP1 protein (A) and multiple alignment of relative amino acid sequences in C. sinensis and other species (B)
2.4 茶树CsBAP1蛋白氨基酸的理化性质分析
利用ExPASy-ProtParam[20]对CsBAP1蛋白的组成成分和理化性质进行分析(表1)。结果显示上述植物的BAP1蛋白氨基酸残基数在165~192之间。相对分子量为17.77~21.99 kD。理论等电点在8.4~9.7之间。酸性氨基酸的平均含量为17%,碱性氨基酸的平均含量为14%,脂肪族氨基酸明显高于芳香族氨基酸,平均含量分别为21%和8%。各个物种之间的理化性质较为相似。主要平均疏水特性(grand average of hydropathicity)在-0.32左右,表现出明显的亲水性。利用在线软件NetPhos分析对CsBAP1蛋白的磷酸化位点预测显示,在CsBAP1中含有24个丝氨酸(Ser,S)磷酸化位点,9个苏氨酸(Thr,T)磷酸化位点,1个酪氨酸(Tyr,Y)磷酸化位点。
2.5 茶树CsBAP1蛋白推导的氨基酸亲/疏水性及无序化结构分析
CsBAP1基因推导的氨基酸序列亲水性/疏水性分析是借助DNAMAN 6.0软件完成的。结果显示(图4),该蛋白疏水性最强的位点是在第31位的苯丙氨酸(Phe);亲水性最强的位点是117与118位的丝氨酸(Ser)和甘氨酸(Gly)。总平均疏水性为负值,表明CsBAP1蛋白属于亲水性蛋白。利用FoldIndex程序对茶树CsBAP1蛋白氨基酸序列进行折叠的无序化分析。如图5所示,CsBAP1不存在无序化区域。
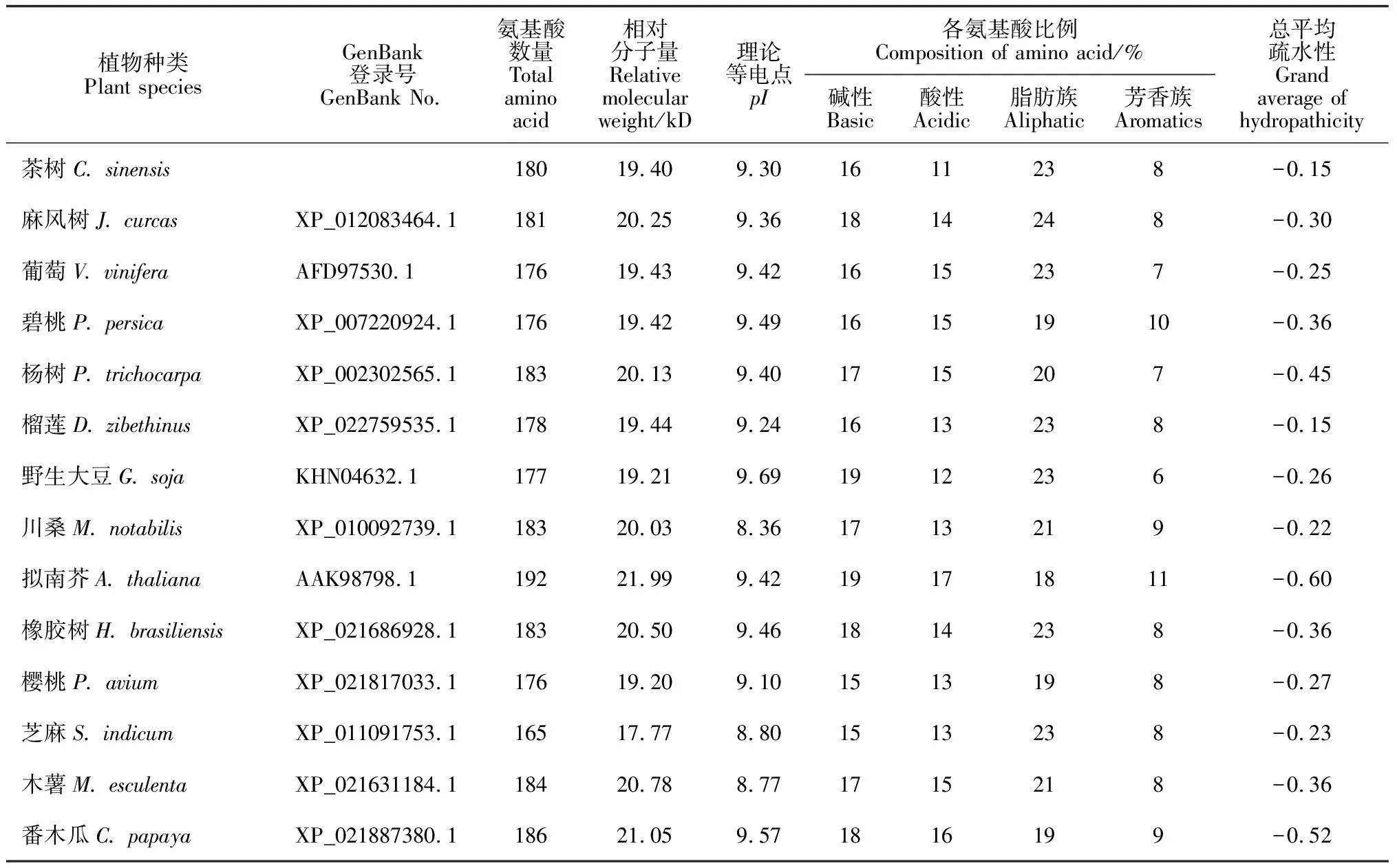
表1 不同植物中BAP1氨基酸组成成分及理化性质分析
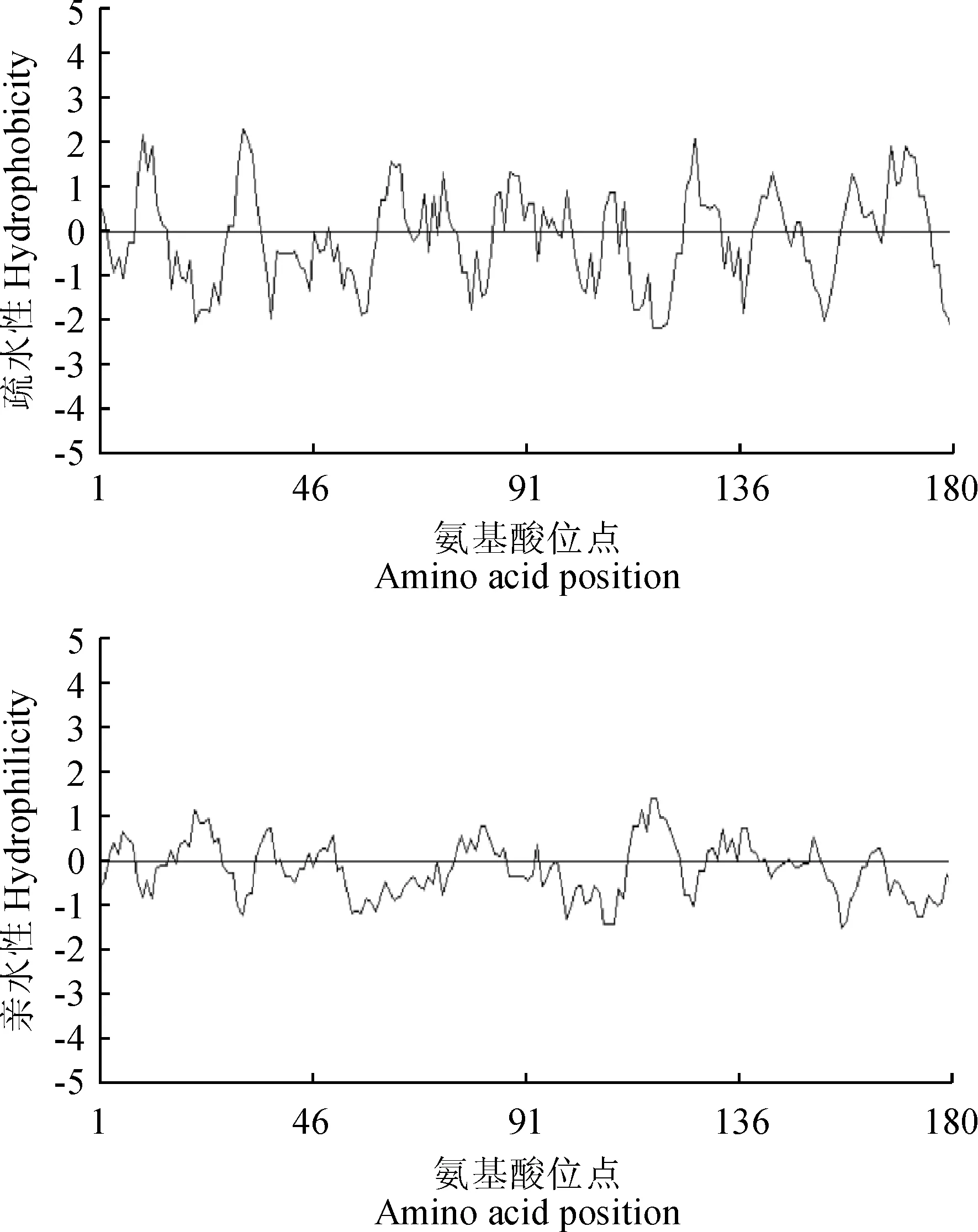
图4 茶树 CsBAP1氨基酸序列的疏水性和亲水性分析Fig.4 Analysis on hydrophobicity and hydrophilicity of amino acid sequence of CsBAP1 in C. sinensis
图5 茶树CsBAP1折叠状态的分析Fig.5 Analysis of the folding state of CsBAP1 in C. sinensis
2.6 茶树CsBAP1蛋白推导的二级结构及三维结构预测分析
为了对CsBAP1蛋白进行进一步的分析,利用SOPMA网站对茶树CsBAP1蛋白的二级结构进行预测和分析。结果显示(图6):CsBAP1含有8.89%的α-螺旋(α-helix),7.78%的β-转角(β-turn),47.78%的随机卷曲(random coil)和35.56%的β-折叠(extended strand)。CsBAP1主要组成部分为随机卷曲和β-折叠。利用Swiss-Model软件预测对CsBAP1三级结构分析,结果如图7,其N端由丙氨酸开始,有一个C2结构域,占全序列的67%。其三维结构中随机卷曲占了蛋白质结构的大部分区域,α-螺旋同β-转角分散其中,结构推测与二级结构吻合。
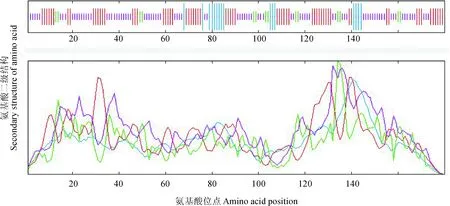
蓝色:α-螺旋;红色:β-折叠;绿色:β-转角;粉色:不规则卷曲图6 茶树CsBAP1二级结构预测Blue: Alpha helix, Red: Extended strand, Green: Beta turn, Pink: Random coilFig.6 The secondary structure of CsBAP1 in C. sinensis
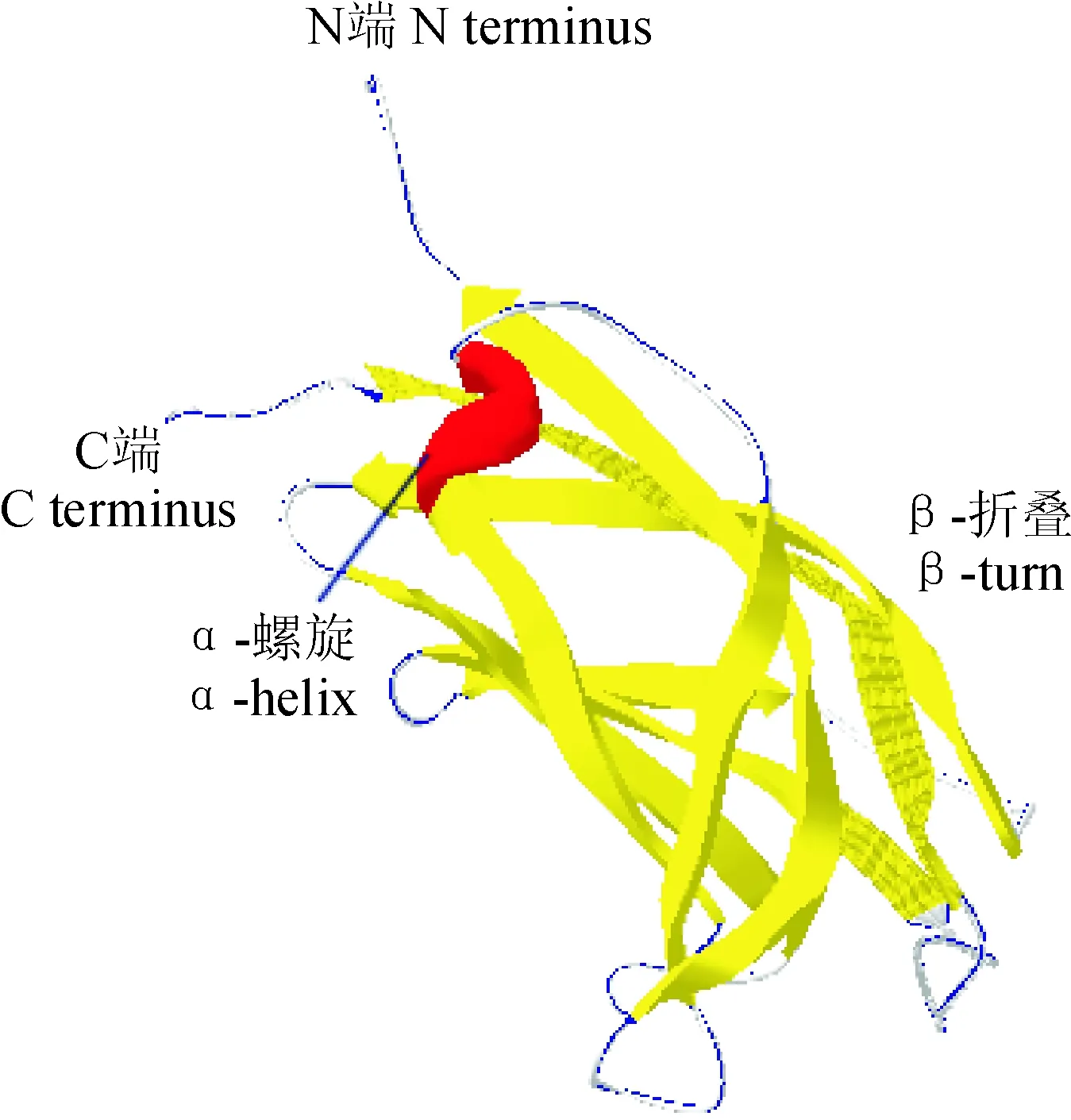
图7 茶树CsBAP1三维结构预测Fig.7 The three-dimension structure of CsBAP1 in C. sinensis
2.7 茶树CsBAP1基因在不同组织中的表达
为分析CsBAP1表达的组织特异性,以茶树‘龙井43’为实验材料,采用实时荧光定量PCR方法检测了CsBAP1基因在不同组织中的表达(图8)。结果表明,CsBAP1基因在茶树不同组织中均有表达,表达量从高到低依次为老叶>花>花蕾>幼叶>成熟叶,其中花和花蕾的表达量较为接近,幼叶和成熟叶的表达量较为接近,老叶的表达量显著高于其他组织的表达量。茶树CsBAP1在老叶中的表达量分别是花、花蕾、幼叶和成熟叶的3.3、3.4、19.3和23.8倍。
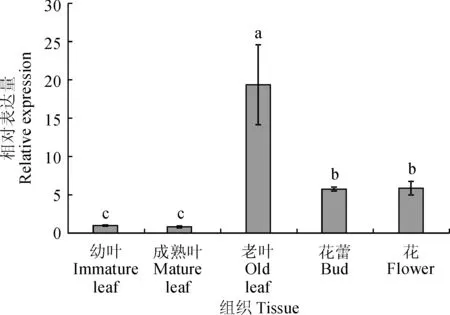
不同小写字母表示不同组织间的差异显著(P<0.05)图8 CsBAP1基因在茶树不同组织中的表达Different letters represent significant differences among different tissues (P<0.05)Fig.8 Expression analysis of CsBAP1 gene in different tissues of C. sinensis
2.8 茶树CsBAP1基因在不同激素处理下的表达情况
为了研究CsBAP1基因在不同激素诱导下的表达情况,分别用SA、GA3、MeJA、ABA和IAA共5种激素处理茶树,处理时间为2 h。结果显示(图9),在不同激素处理下,CsBAP1的表达量与对照相比均表现出了不同程度的下调,表达水平从高到低依次为SA>MeJA>GA3>IAA>ABA。在对照中的表达量分别是SA、MeJA、GA3、IAA和ABA的5.9、14.9、18.9、21.8及26.7倍。结果表明,不同激素处理都会抑制CsBAP1基因的表达。
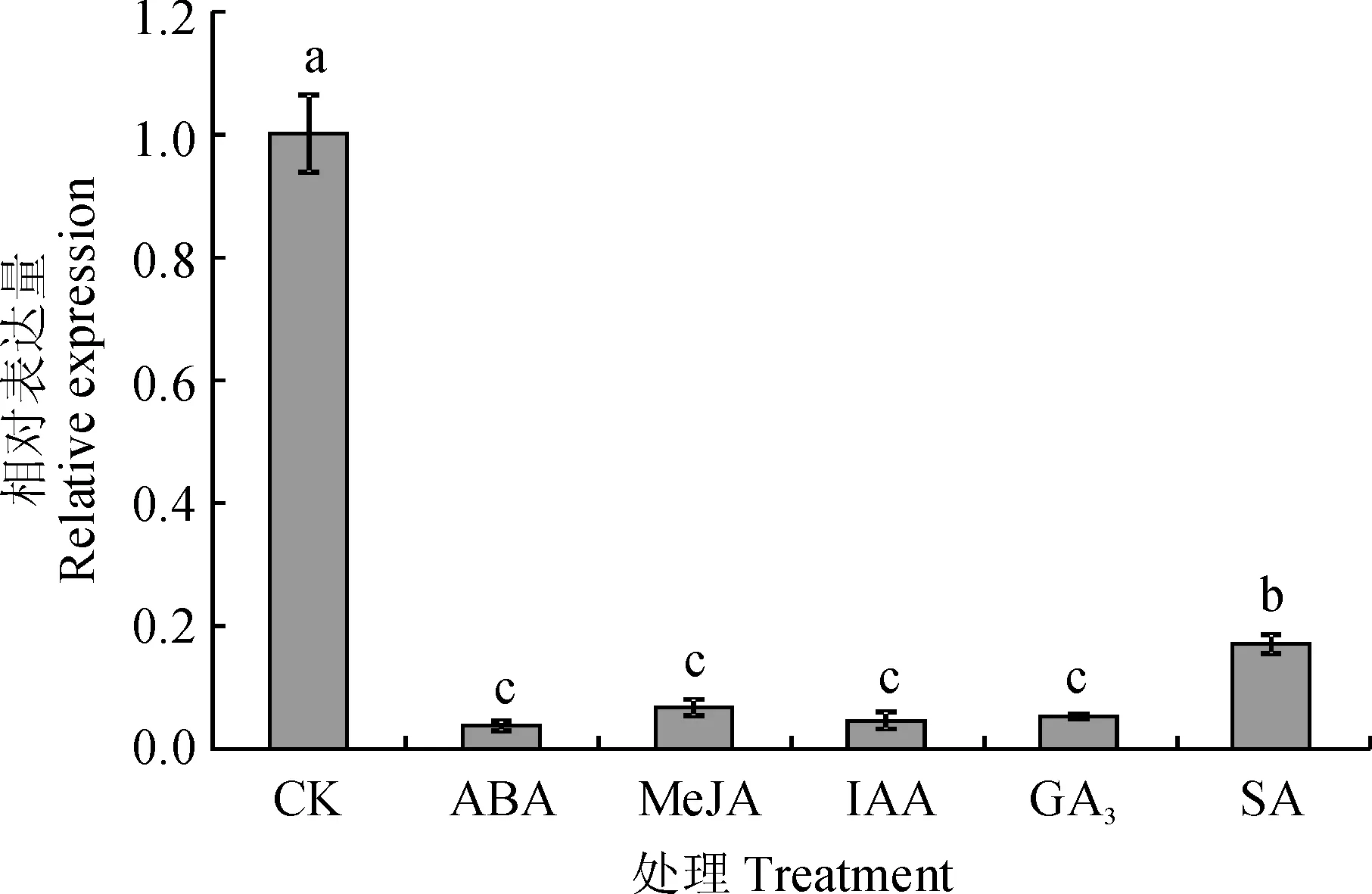
不同小写字母表示不同处理间的差异显著(P<0.05)图9 不同激素处理下CsBAP1基因在茶树中的表达Different letters represent significant differences among different treatments (P<0.05)Fig.9 Expression analysis of CsBAP1 gene under different hormonal treatments of C. sinensis
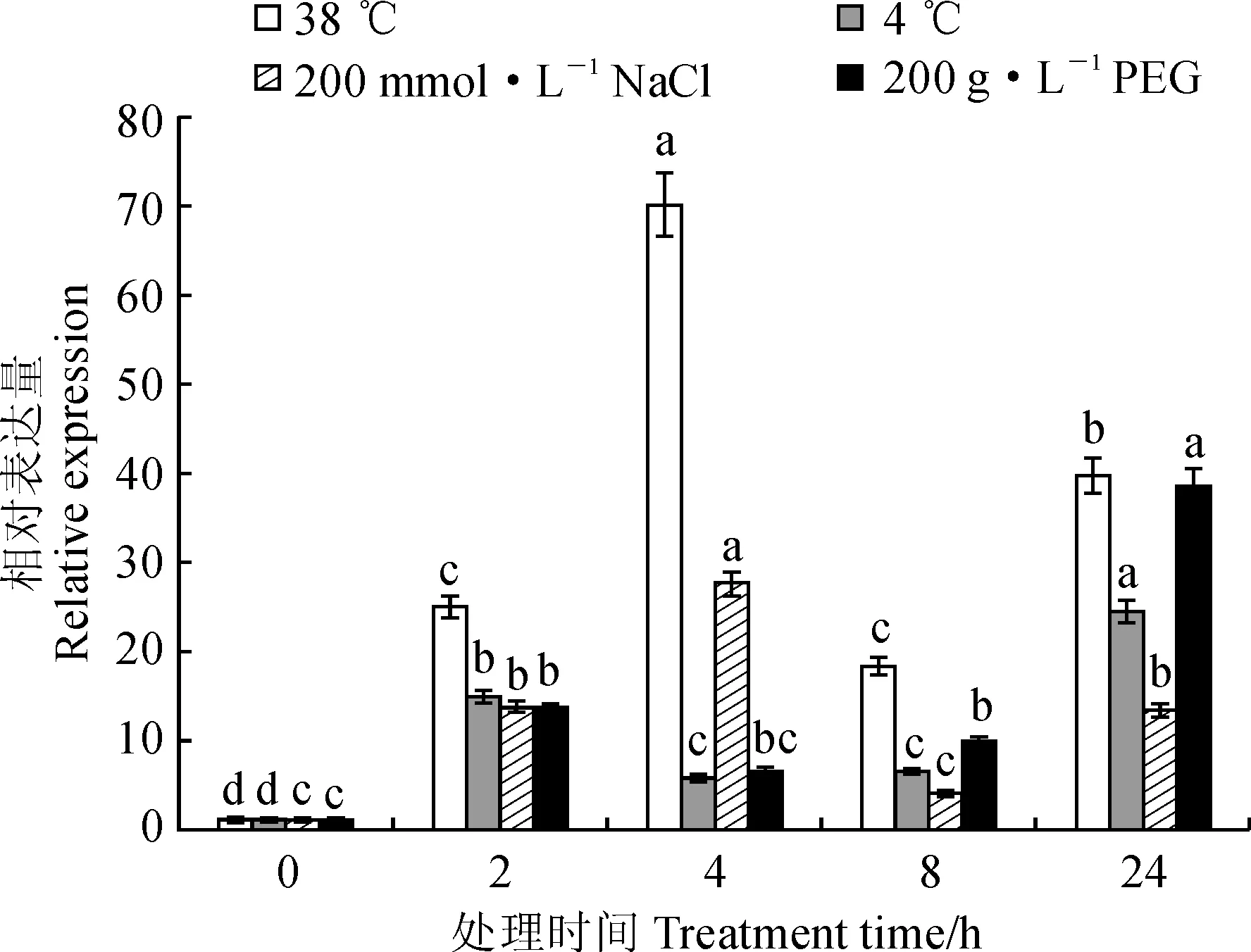
不同小写字母表示同一处理不同时间的差异显著(P<0.05)图10 不同环境因子胁迫下CsBAP1基因在茶树中的表达Different letters represent significant differences among different times with same treatment (P<0.05)Fig.10 Expression analysis of CsBAP1 gene under different stress treatments
2.9 茶树中CsBAP1基因对非生物胁迫的响应特征
茶树在高温(38 ℃)、低温(4 ℃)、高盐(200 mmol·L-1NaCl)和干旱(200 g·L-1PEG)4种逆境胁迫处理下,CsBAP1的表达量较对照均表现出一定程度的上调(图10),基本趋势表现为其表达量在短时间内达到一个峰值,然后逐渐下降,随着时间的延长再重新回升。高温处理下,CsBAP1的表达量在4 h时最高,为对照的68.8倍,处理2、8、24 h时表达量分别为对照的24.4、18.0、39.1倍。低温处理下,2 h时其表达量显著上调,为对照的14.7倍,4和8 h时表达量有所降低,但仍高于对照,24 h时表达量达到最高,为对照的24.0倍。盐处理下,该基因的表达模式与高温较为相似,胁迫处理2、4、8、24 h,茶树叶片中CsBAP1的表达量分别为对照的13.5、27.1、4.0、13.1倍。干旱胁迫下,处理2、4、8 h,CsBAP1的表达量呈稳定的上调趋势,分别为对照的13.3、6.5、9.7倍,处理24 h时达到最大值,为对照的37.9倍。
3 讨 论
本研究从茶树‘龙井43’中克隆了茶树CsBAP1基因的cDNA,其开放阅读框为543 bp,编码180个氨基酸。理化性质分析表明,CsBAP1的序列长度、分子质量及等电点等均与其他物种的BAP1相近;该基因含有一个保守的钙依赖性膜脂结合位点C2结构域,属于C2-SRC2-like亚家族,此亚家族中的很多成员在非生物胁迫和防御应答中起重要作用[21-23]。
基因的表达情况与基因的实际功能密切相关。研究发现,拟南芥的BAP1蛋白在植物体内有多种功能,如负调控植物的防御反应,过表达的BAP1增加了拟南芥对真菌的易感性,抑制植物细胞的程序性死亡[13-15]。CsBAP1在茶树的幼叶、成熟叶、老叶、花和花蕾中均有表达,其中在老叶中的表达量最高,而在幼叶及成熟叶中的表达量较低。在茶树中,CsBAP1基因可能参与调控植物体细胞的衰老甚至死亡的过程。此外,该基因在花和花蕾中的也有较高的表达量,花的发育受多个信号分子的协同调控,钙离子在其中发挥着重要作用[24]。Ca2+是一种重要的第二信使,它能通过外界的多种生物或非生物信息介导细胞内基因表达以及细胞生理反应的调控,表明该基因是以一种Ca2+依赖的方式在植物生长发育过程中发挥作用。
许多研究表明,C2结构域蛋白在调节植物抵抗干旱、高盐、低温、病原菌侵害等生物和非生物胁迫中行使功能。如水稻中的OsERG1a和OsEGG1b在水稻细胞受真菌激发子诱导后,能以Ca2+依赖的方式参与防御反应和膜运转[25];大麦中的HvC2d响应重金属胁迫,并与叶片衰老有关[26];OsGAP1是水稻抗盐和抗细菌性病原菌的一个调控因子[27];水稻OsSMCP1在拟南芥中的过表达可诱导转基因植株抵抗生物和非生物胁迫[28];VrPLC3对辣椒抗盐和抗旱具有正调控作用[29]。为验证CsBAP1基因对茶树耐逆性的作用机制,本实验研究了该基因在高温、低温、NaCl和PEG胁迫下的表达特性,结果表明,CsBAP1在不同胁迫下均受诱导而显著上调表达,进一步说明了CsBAP1基因广泛参与对非生物胁迫的应答并在其中发挥了重要功能。在高、低温,盐害及干旱胁迫下,植物生长因渗透和氧化胁迫而受到严重抑制。在此过程中,其他信号分子(如ROS和Ca2+)作为第二信使在C2结构域蛋白对植物的生物和非生物胁迫反应中也起着重要的调控作用[6-7]。由此可以推断,CsBAP1可能参与调控植物逆境胁迫应答的信号传导。
蛋白质的磷酸化修饰是在细胞信号传递过程中起着重要作用的一种调节方式,丝氨酸、苏氨酸和酪氨酸是蛋白质磷酸化修饰的3种主要的部位[30]。蛋白质磷酸化预测软件分析表明,CsBAP1含有多个丝氨酸/苏氨酸磷酸化位点。胁迫条件尤其是干旱、高低温和盐害会导致胞内Ca2+浓度升高[31],起始一系列蛋白磷酸化级联反应MAPK(mitogen-activated protein kinase),最终激活一些对细胞具有保护作用的蛋白以及一些控制应激调节基因表达的转录因子。这些应激调节基因编码的蛋白往往参与产生一些植物激素,如ABA、茉莉酸和水杨酸等,而这些植物激素能够起始植物体内第二轮的信号转导过程,再次引发植物体内Ca2+水平的变化[10,32-33]。本研究中的CsBAP1基因受ABA、IAA、SA、GA3、MeJA的诱导后,其表达量均受到不同程度的抑制,且与对照相比具有显著差异。CsBAP1基因对低温、高温、高盐、干旱胁迫均有响应,说明了逆境胁迫可导致CsBAP1转录水平的上升。外源激素处理引起植物体内Ca2+震荡,这些激素和Ca2+可能以一种协同作用有效抑制CsBAP1转录水平的增加,从而有助于在逆境胁迫过程中稳定该基因的水平。由于植物激素对植物的作用机理和作用过程复杂,其在茶树中的调控机制仍待进一步研究。
本研究首次在茶树中克隆CsBAP1基因并分析了其在不同组织,不同激素和不同逆境处理下的表达情况,初步推测其在茶树的细胞程序性死亡过程及钙离子信号转导中发挥着重要作用。CsBAP1对茶树生长发育过程中的逆境胁迫响应表达为后续研究该基因参与茶树生长发育提供了理论参考。但其具体的功能以及其可能的作用机制,仍需进一步的验证。
