白菜BcMAF2基因克隆及功能验证
2018-11-06吴小婷邵帅旭任海波侯喜林刘同坤
吴小婷,邵帅旭,任海波,李 林,侯喜林,刘同坤
(南京农业大学 作物遗传与种质创新国家重点实验室,农业部华东地区园艺作物生物学与种质创制重点实验室,南京 210095)
白菜(BrassicacampestrisL. ssp.chinensisMakino)是中国重要的蔬菜作物,在长江中下游地区广泛种植[1],春季栽培白菜往往因为“早期抽薹”而不能获得正常的产品,直接影响产量与品质,给生产带来较大损失[2]。因此培育优良的适宜春季栽培的晚抽薹白菜品种,是解决这一问题的有效途径[3]。
由营养生长阶段向生殖生长阶段转换是高等植物生命活动中的一个重要过程,这个过程一般称为开花,开花受内部遗传和外界环境因素两方面的共同影响[4]。白菜类作物与模式植物拟南芥(Arabidopsisthaliana)同属十字花科(Cruciferae)芸薹属(Brassica),因此拟南芥开花途径的分子机制研究结果对白菜类作物开花方面的研究有较大借鉴意义。近年来利用分子遗传学方法对拟南芥开花突变体进行研究表明开花存在四条主要的途径:光周期途径(photoperiod pathway)、春化途径(vernalization pathway)、赤霉素途径(GA pathway)和自主途径(autonomous pathway)。其中春化途径是指植物通过适当强度的冷处理诱导抑制开花基因的沉默,从而使植物具备开花能力[5]。春化过程中由许多特异性基因按照一定的顺序进行表达来控制,各种基因相互联系相互制约,在拟南芥中春化对开花的促进作用主要是通过春化对FLC(FLOWERINGLOCUSC)表达的抑制来实现的[6]。FLC是一个开花抑制基因,编码一个MADS-box转录调节蛋白。春化过程中低温影响其表达水平,温度对其活性的调控贯穿于植株的整个生长发育过程[7]。
MAF2是调控开花时间的关键基因,对拟南芥开花具有抑制作用[8],MAF2基因编码一个MADS-box蛋白,同时在拟南芥中是MADS-AFFECTINGFLOWERING3~5(MAF3、MAF4和MAF5)组成串联阵列,这些基因与FLC同源[9]。FLC基因在拟南芥中是春化途径的关键抑制因子。研究显示:在拟南芥中,春化路径中的抽薹开花时间是由FLC以及控制FLC表达的FRI(FRIGIDA)等位基因来调控的[10]。FLC基因与MAF2基因在影响开化过程中具有相似性[11]。所以推测BcMAF2基因在影响白菜开花的过程中也是作为抑制开花的关键因子而存在的。
为了研究BcMAF2基因在白菜开花中的功能,本研究利用同源克隆的方法获得了BcMAF2基因片段,克隆这个基因全长cDNA序列,对BcMAF2基因进行了亚细胞定位分析,同时,将BcMAF2导入拟南芥中进行转基因功能验证,确定BcMAF2基因在植物开花过程中的作用。
1 材料和方法
1.1 材 料
不结球白菜晚抽薹品种NHCC004保存于南京农业大学作物遗传与种质创新国家重点实验室,种植在人工气候室中,在22 ℃ 16 h光照,18 ℃ 8 h黑暗条件下培养。取5叶期的叶片作为实验材料,用液氮将取完的样品立即速冻然后贮存于-80 ℃冰箱中待用。
1.2 方 法
1.2.1RNA的提取和cDNA合成取适量叶片在液氮中研磨,根据植物总RNA提取试剂盒(Tiangen,北京)的方法提取总RNA。按照TaKaRa公司PrimeScriptTM RT reagent Kit反转录试剂盒的方法将提取的 RNA反转录为cDNA,按照试剂盒说明书来选择反转录的反应条件及程序。
1.2.2白菜BcMAF2基因全长的克隆从白菜数据库中查找拟南芥MAF2同源序列,并在其上设计1对基因特异引物BcMAF2-F1(5′-ATGGGGAGAAGAAAAGTAGA-3′)和BcMAF2-R1(5′-TTACTTGAGCAGCGGGAGAG-3′)。以不结球白菜NHCC004叶片的cDNA作为模板,总体系20 μL进行扩增。PCR反应体系如下:浓度为2 μg·L-1RNA的cDNA 1.0 μL,10 μmol·L-1上下游引物各1.0 μL,10×LA Taq Buffer 2.0 μL,LA Taq 聚合酶0.5 μL,1 mmol · L-1dNTP 1.0 μL,超纯水13.5 μL。反应程序为:95 ℃预变性 5 min,95 ℃变性30 s,56 ℃退火 30 s,72 ℃延伸90 s,并进行35个循环,循环结束后72 ℃反应10 min,4 ℃保存。1%的琼脂糖凝胶电泳对PCR产物进行检测,切胶并回收条带大小正确的目的片段。16 ℃过夜连接到pMD18-T载体,然后转化至大肠杆菌DH5α,挑取单克隆菌落进行鉴定后,送往南京金斯瑞生物科技有限公司进行测序。
1.2.3序列分析在NCBI数据库中下载不同物种MAF2的基因及氨基酸序列;运用DNAMAN软件对氨基酸序列进行比对;运用MEGA 5软件对系统进化树进行分析。
1.2.4Gateway技术载体构建(1)BcMAF2基因片段的PCR扩增。采用Gateway技术构建BcMAF2载体[12]。首先构建Gateway入门载体,将attB1和attB2位点序列分别加在正向引物和反向引物两端,设计BcMAF2的引物BcMAF2-F2(5′-GGGGACAAGTTTGTACAAAAAAGCAGGCT-TCATGGGGAGAAGAAAAGTAGA-3′)及BcMAF2-R2(5′-GGGGACCACTTTGTACAAGAA-AGCTGGGTCTTACTGCAGCGGGAGAGTTT-3′)。使用Phusion超保真酶进行PCR扩增,其反应程序如下:98 ℃预变性30 s, 98 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,进行30个循环,循环结束后72 ℃反应10 min,4 ℃保存。用1%琼脂糖凝胶电泳检测后将大小正确的PCR产物切胶回收。
(2) BP反应。将切胶回收的PCR产物与入门载体pdonr221进行BP反应。总反应体系5 μL,具体反应体系如下:PCR回收产物2.7 μL,入门载体1.0 μL, 5×BP反应缓冲液1.0 μL,BP酶混合物0.3 μL。瞬时离心后25 ℃反应4 h,反应结束后加入浓度为100 μmol·L-11.0 μL蛋白酶K溶液,37 ℃反应10 min。将反应产物转化至大肠杆菌DH5α,均匀涂布于含50 mg·L-1卡那霉素的LB平板培养基。37 ℃培养12 h后,挑取单克隆用含相同抗生素的LB液体培养基中振荡培养后进行PCR检测,将片段大小正确的克隆送南京金斯瑞生物科技有限公司测序。测序正确的质粒即重组入门载体pdonr221-BcMAF2。
1.2.5BcMAF2亚细胞定位与转基因功能验证载体构建由于入门载体pdonr221和目的载体pEarleyGate101筛选的抗性基因一致,因此先用限制性内切酶MluI在LR反应前对BP反应得到的入门载体进行单酶切,酶切之后将片段大小正确的片段切胶回收,然后与目的载体进行LR反应。总反应体系5 μL,具体反应体系如下:线性化的入门载体pdonr221-BcMAF2 3 μL,目的载体pEarleyGate101 1 μL,LR酶混合物1 μL。瞬时离心后25 ℃反应4 h,反应结束后加入浓度为100 μmol·L-11.0 μL蛋白酶K溶液,37 ℃反应10 min。将反应产物转化至大肠杆菌DH5α,均匀涂布于含50 mg·L-1卡那霉素的LB平板培养基。37 ℃培养12 h后,挑取单克隆用含相同抗生素的LB液体培养基中振荡培养后进行PCR检测,将片段大小正确的克隆送南京金斯瑞生物科技有限公司测序。测序正确的质粒即重组目的载体pEarleyGate101-BcMAF2-YFP-HA。
1.2.6BcMAF2亚细胞定位分析将构建好的重组融合表达载体pEarleyGate101-BcMAF2-YFP-HA利用液氮冻融法转入农杆菌GV3101,均匀涂布于含50 mg·L-1卡那霉素的LB平板培养基,28 ℃培养48 h后,挑取单克隆用含相同抗生素的LB液体培养基中28 ℃,180 r·min-1振荡培养后进行PCR检测。将检测正确的含有融合表达载体的GV3101农杆菌在含卡那霉素的LB液体培养基中28 ℃,200 r·min-1培养20 h,然后取1%体积的菌液到同样的LB液体培养基中28 ℃,200 r·min-1培养至菌液OD600为1.0。在4 000 r·min-1下离心5 min后用最终浓度为10 mmol·L-1MgCl2,10 mmol·L-1MES(调节pH 5.7),150 μmol·L-1乙酰丁香酮的注射缓冲液重悬至OD600为0.8,室温放置5 h后,用1 mL的无针头注射器将含有重组融合表达载体的农杆菌菌液注射至烟草叶片,用H2B-RFP标记细胞核所在位置。注射后的烟草植株置于22 ℃的16 h光照,18 ℃的8 h黑暗的人工气候室中进行培养3 d后。在激光共聚焦显微镜下观察荧光信号,进行BcMAF2蛋白的亚细胞定位分析。
1.2.7BcMAF2基因导入拟南芥将检测正确含有融合表达载体pEarleyGate101-BcMAF2-YFP-HA的农杆菌接种于4 mL 浓度各为50 mg·L-1利福平和卡那霉素的LB液体培养基中,28 ℃,200 r·min-1培养16 h,取1 mL菌液转接到20 mL相同的LB液体培养基中28 ℃,200 r·min-1继续培养12 h至OD600为1.5。5 000 r·min-1下4 ℃离心10 min,弃上清后用渗透缓冲液重悬到OD600为0.8。将拟南芥的花薹浸入菌液中搅动5 s用吸水纸擦干,侵染后的拟南芥植株置于22 ℃ 16 h光照,18 ℃ 8 h黑暗的人工气候室中进行培养。收到种子后进行播种,培育,在种子发芽继续生长3周后喷施0.3%草甘膦溶液进行筛选。约2周后对存活拟南芥进行PCR检测,选出阳性植株即为T0代,收种后继续培育筛选。
1.2.8Westernblot验证从T2代中选取10株生长旺盛的拟南芥植株提取蛋白经10%的SDS-PAGE电泳分离,通过湿转法进行转膜,转完后用1×丽春红染液在脱色摇床上将膜染色5 min,然后用水将膜冲洗2~3次至看到膜上的蛋白。用含有5%脱脂奶粉的封闭液在室温下将膜摇动封闭30 min。将α-HA抗体(Biorad, USA)用含有5%脱脂奶粉封闭液稀释浓度为1∶2 000,室温下孵育2 h后在脱色摇床上用TBST重复洗3次,每次10 min。将膜与底物Pico反应5 min后去尽残液,包好,放入化学发光仪中检测BcMAF2蛋白在拟南芥植株中的表达。
1.2.9开花时间分析选取其中BcMAF2蛋白成功表达的植株收种后进行培养并以野生型拟南芥植株做对照,在每个株系中选取10株生长旺盛的拟南芥植株进行开花时间分析,并分别统计每株拟南芥抽薹时莲座的叶片数,计算平均值,并通过Excel软件制成柱状图进行分析。
2 结果与分析
2.1 BcMAF2的克隆和序列分析
以白菜cDNA为模板,设计全长引物进行扩增,获得了1个与预期大小一致的片段(图1)。序列测定与分析表明,白菜BcMAF2 基因含有1个588 bp开放阅读框(ORF),编码 196 个氨基酸。
2.2 BcMAF2氨基酸同源性与进化树分析
利用 BLASTp 对BcMAF2基因编码的氨基酸同源性进行检索,从NCBI中下载9个其他物种的MAF2蛋白序列,并用DNAMAN软件对所得的序列进行氨基酸序列比对,结果显示(图2),该蛋白与芜菁(Brassicarapa)、欧洲油菜(Brassicanapu)、羽衣甘蓝(Brassicaoleracea)及萝卜(Raphanussativus)相似性高达100%、93%、93%及95%,与黄花亭荠(Arabisalpine)、荠蓝(Camelinasativa)、拟南芥(Arabidopsisthaliana)、天蓝遏蓝菜(Noccaeacaerulescen)及弯曲碎米荠(Cardamineflexuosa)相似性相对较低,分别为75%、74%、71%、74%及63%。同时,利用 MEGA5将白菜BcMAF2蛋白与其他植物的MAF2蛋白进行同源进化分析并构建进化树,结果(图3)表明,白菜BcMAF2蛋白与芜菁,欧洲油菜及羽衣甘蓝为同一分支,并且BcMAF2与芜菁聚为一支,亲缘关系最高。
2.3 白菜BcMAF2蛋白亚细胞定位
将含有pEarleyGate101-BcMAF2-YFP-HA的农杆菌侵染烟草植株48 h后,观察本氏烟叶片中的荧光。结果见图4,在激光共聚焦显微镜下,试验组pEarleyGate101-BcMAF2-YFP-HA在YFP激发光下可以检测到较为明显的黄色荧光信号,红色荧光信号表示本氏烟草植株细胞核位置;2张荧光信号重叠表明BcMAF2蛋白定位于细胞核。
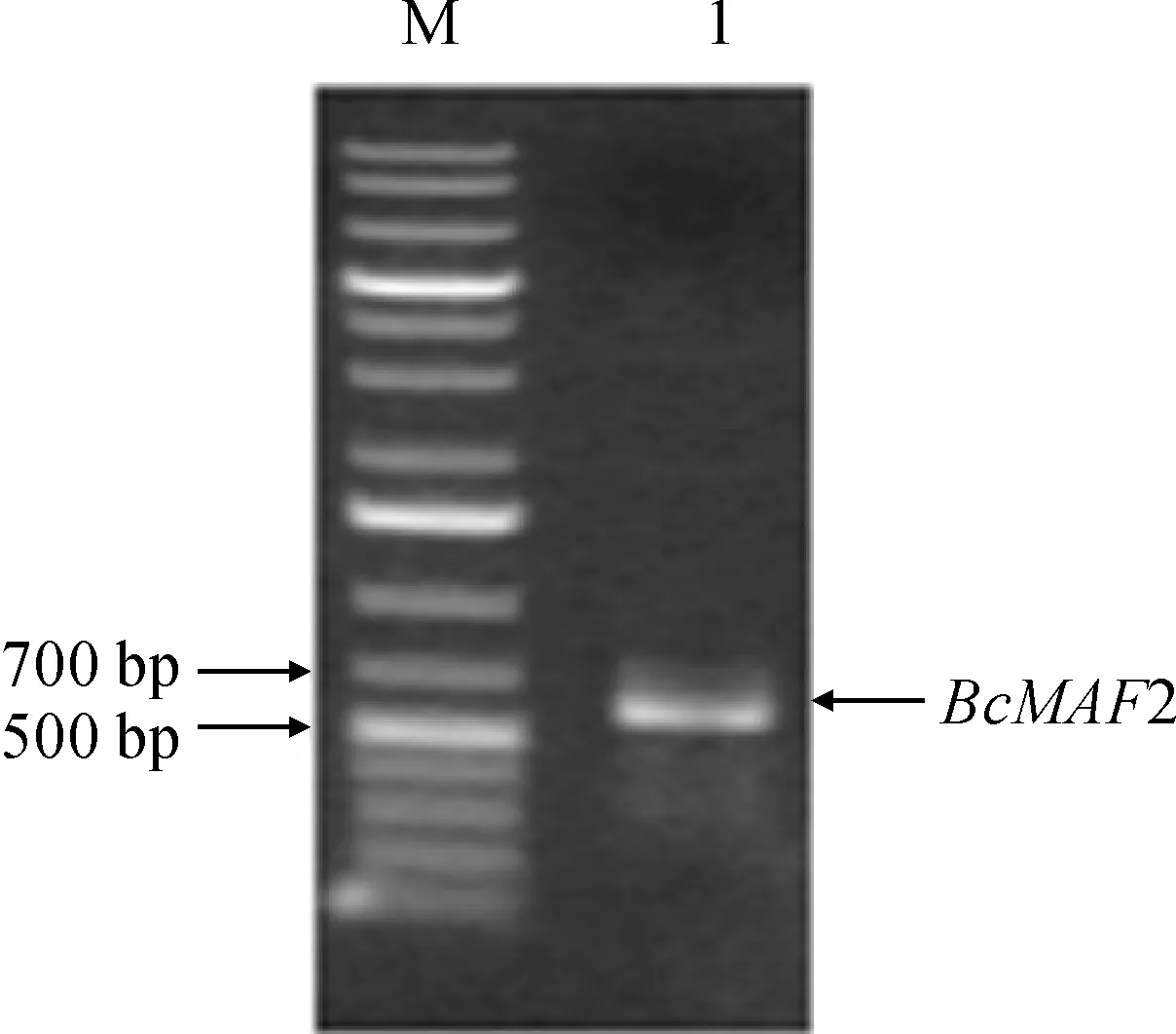
图1 BcMAF2基因PCR扩增产物M.1kb ladder plus M1191 marker;1.BcMAF2Fig.1 PCR amplified product of BcMAF2 gene

图2 白菜与其他物种MAF2同源氨基酸序列比对Fig.2 The alignment of amino acids of MAF2 from Brassica campestris and other plants

图3 白菜MAF2蛋白系统进化树分析Fig.3 Phylogentic tree analysis of MAF2 proteins
2.4 Western blot分析
本实验使用Western blot验证BcMAF2基因是否在拟南芥植株中表达,试验中使用野生型拟南芥作为对照,如图5,A,分别在选取的第1、4、5、8和10株观察到BcMAF2蛋白印迹,表明T2代拟南芥植株中BcMAF2基因在上述5个株系中表达成功。
2.5 开花时间分析
为了重点研究在BcMAF2基因表达量较高背景下的开花时间变化情况,本试验仅收取第8、10株拟南芥种子进行培育并选取野生型拟南芥作对照,每个株系分别选取10株进行统计,以抽薹时的莲座叶数量作为判断开花时间早晚的依据。如图5,B, 野生型拟南芥在长出8~9片莲座叶后抽薹开花,而转基因植株在抽薹时的莲座叶数量是野生型对照的3~4倍,野生型与转基因植株的开花时间具有显著性差异。相对于野生型,转基因植株开花较迟,莲座更加膨大(图5,C)。
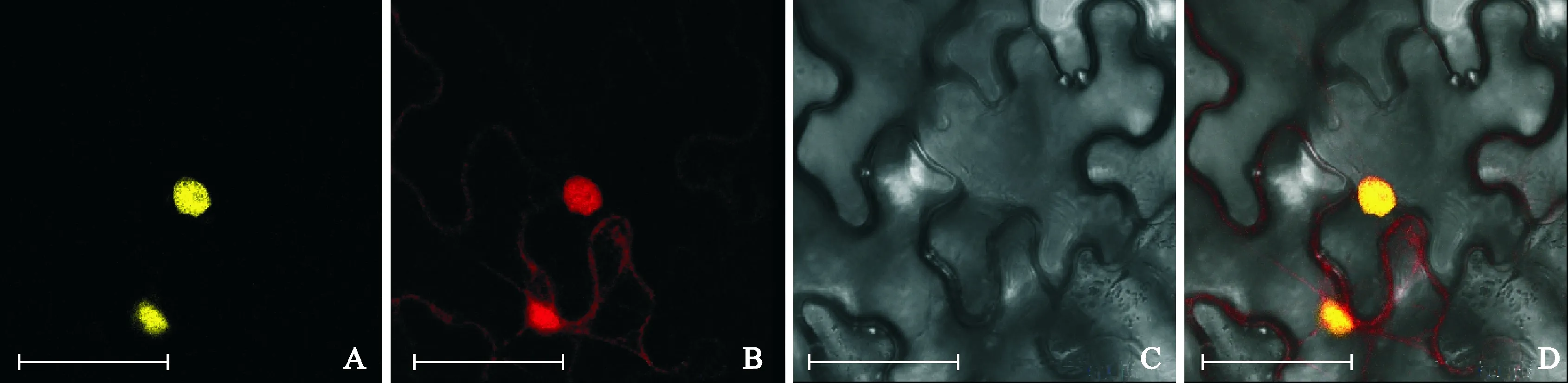
A~D为BcMAF2在烟草中的定位情况。A. 黄色荧光通道;B. 红色荧光通道;C. 明场;D.叠加图; 标尺=50 μm图4 BcMAF2在本氏烟叶片细胞中的定位A-D. Nicotiana tabacum cells were transformed with BcMAF2; A. YFP; B. RFP; C. Bright field; D. Merge; Bar=50 μmFig.4 Subcellular localization of BcMAF2 in leaves of Nicotiana tabacum
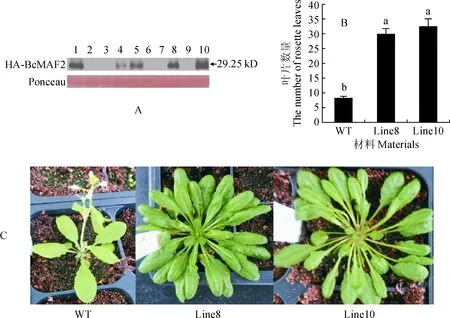
A.Western blot验证; B.拟南芥抽薹时叶片数统计,不同小写字母表示转基因株系与野生型对照抽薹时叶片数量差异显著(P<0.05); C.拟南芥抽薹时野生型植株与转基因植株生长状态对比图5 western blot检测与开花时间分析A.Western blot; B.Statistics of leaf number in Arabidopsis bolting,different normal letters indicate significant difference in rosette leaf number between transgenic plants and wild-type; C.Comparison of growth status between wild-type plants and transgenic plants in Arabidopsis boltingFig.5 Western blot analysis and flowering time analysis
3 讨 论
白菜属十字花科芸薹属[13],绝大多数属于二年生冬性蔬菜作物,具有适应性广、生长期短、高产、营养丰富等特点,是居民生活中消费比例较大的蔬菜品种[14]。白菜的早期抽薹是影响品质发育的一个重要问题,培育耐抽薹白菜品种是解决这一问题的关键途径。春化反应是影响植株抽薹开花的重要途径[15],需多个基因共同参与,相互联系[16]。遗传和分子分析表明位于拟南芥5号染色体的FLC基因在拟南芥中是春化反应的主要决定因子[11,17],然而,flc突变体仍然响应春化的事实表明仍有其他基因参与维持春化反应[18]。MAF2作为FLC基因的旁系同源基因与MAF3、MAF4、MAF5串联排列在拟南芥5号染色体底部,鉴于FLC与MAF2至MAF5的相关性,这些基因可能也参与了春化的调控过程[13]。
FLC与MAF2在植物开花过程中通过抑制FT和SOC等开花促进因子的表达来发挥负调控作用[8],在拟南芥中春化作用会抑制FLC的转录与表达过程,导致提前开花,抑制的程度与低温处理的时间相关,低温处理的时间越长,FLC的表达越弱[19]。MAF2在春化过程中对温度的调控不敏感,其抑制因子的活性在FLC下游发挥作用,可以修正因短暂低温引起的FLC表达水平降低,防止低温引起拟南芥发生春化而提前开花[20]。由此分析并大胆推测MAF2基因在白菜中也是保守的,在白菜中MAF2基因也可能通过修正FLC表达水平的降低,进而解除低温对FLC表达的限制,达到白菜晚抽薹开花的目的。
拟南芥中,FLC的表达水平显示春化反应的分子基础[21],且拟南芥maf2突变体在寒冷环境中早开花与FLC转录水平的下降没有联系,同时35S::MAF2植株在长时间的寒冷环境中伴随着FLC转录水平的降低仍保持晚开花,说明在春化途径中MAF2可以独立调控开花或者在FLC转录因子的下游进行调控[16],表明拟南芥MAF2可以防止在春化过程中因为遭遇短暂的低温导致FLC水平的降低而引起的提前开花,但是目前在白菜中尚未发现MAF2的进一步研究。本实验中为了验证BcMAF2基因的功能,采用同源克隆方法首次从白菜中克隆到MAF2基因,并对其进行了初步分析,BcMAF2编码区为588 bp,编码了196个氨基酸,利用亚细胞定位确定白菜BcMAF2基因位于植物细胞核内,这与该基因发挥转录因子功能、编码蛋白的功能性质有关。将BcMAF2导入拟南芥中,观察到种植在相同环境条件下的转基因拟南芥植株相对于野生型拟南芥更晚开花,转基因拟南芥抽薹时叶片数相对于野生型拟南芥更多。结果表明MAF2确实具有抑制开花的功能,可以用于晚抽薹的白菜品种的研究。
