NaCl胁迫对黄花菜生长和生理特性的影响
2018-11-06韩志平张海霞石福臣
韩志平,张海霞,刘 冲,张 巽,石福臣
(1 山西大同大学 生命科学学院,设施农业技术研发中心,山西大同 037009;2 南开大学 生命科学学院,天津 300071;3 山西大同大学 后勤管理处,山西大同 037009)
黄花菜(HemerocalliscitrinaBar.)又名金针菜、忘忧草,属百合科萱草属多年生草本植物。由于对环境条件的适应性较强、栽培技术相对简单,加上经济效益较高,在中国各地均有栽培[1-2]。山西大同是著名的“黄花之乡”,与甘肃庆阳、湖南祁东、陕西大荔、江苏宿迁、浙江缙云并称为中国六大黄花菜产区[3]。大同黄花菜生长在大同火山群下,地理、气候和土壤条件优越,形成了颜色鲜黄、角长肉厚、脆嫩爽口、营养丰富的优良品质,是山西省名优农产品,也是大同市首个中国地理标志证明商标[4-5]。然而,由于长期以来品种单一、生产经营方式粗放,加上产品加工包装和市场宣传力度不够等,近年来其种植面积、产量和销售市场均受到制约[6]。
大同盆地是山西省最大的盆地,大同市是山西省发展特色农业的重点区域,但也是山西省盐碱地面积最大的地区,拥有全省21%的盐碱土地,严重限制了当地的农业生产及其可持续发展[7]。尽管大同市政府近年来采取了不少措施对盐碱地进行了治理,但效果并不理想。黄花菜具有适应性强、耐旱、耐寒、耐瘠薄等特性,是一种优良的水土保持植物[8]。研究表明,黄花菜具有较强的耐盐性,在盐碱地种植不仅可以获得较高的产量,而且有明显的脱盐改土效果[9]。但黄花菜的耐盐性能够达到何种程度,其抗盐的生理和分子机制如何,至今尚未见报道。因此,本试验以大同黄花菜为材料,采用砂培法,研究了不同浓度NaCl胁迫对黄花菜植株生长和一些生理指标的影响,旨在探究黄花菜的耐盐性,并初步阐明其适应盐胁迫的生理机制,为今后在盐碱地的推广种植和促进大同黄花菜的产业发展提供实验依据。
1 材料和方法
1.1 试验材料
试验于2016年9~10月和2017年5~7月在山西大同大学生命科学实验基地的塑料大棚内进行2次,规律基本一致,本试验为2017年数据。大同黄花菜种苗由大同县紫峰黄花专业合作社提供。
1.2 试验方法
从田间选取长势一致的黄花菜植株移栽到装有砂子蛭石混合基质(按体积比5∶1配比)的塑料盆中,栽培盆上口直径和深度均为25 cm,每盆5株。每2 d浇1次1/2 Hoagland配方营养液,每盆浇500 mL,保持昼温20~30 ℃,夜温15~22 ℃,自然光照。缓苗1周后,浇灌含有不同浓度NaCl的1/2 Hoagland配方营养液进行盐胁迫处理,浇灌溶液用量和频率同缓苗期。试验共设6个处理:以正常营养液为对照,并设50、100、150、200和250 mmol·L-1NaCl等5个盐浓度处理。完全随机设计,每处理重复3次。处理后每5 d于早7:30每重复选3个植株,取由内向外第3层完全展开叶测定生理指标,处理后25 d时取所有植株测定生长指标。
1.3 测定指标及方法
1.3.1生长指标测量植株基部到生长点的长度为株高,以完全展开且叶长超过10 cm为标准统计叶片数,用叶面积仪测定最大叶的叶面积,测量根茎基部到最长根的尖端为根长,统计长度超过1 cm以上的新生根数。植株洗净吸干表面水分后,从根茎基部剪断分为地上部和根系,分别称得鲜质量;在烘箱中105 ℃下杀青30 min后,降温到75 ℃下烘干至恒重,分别称得干质量。
1.3.2生理指标叶片光合色素提取液配制采用沈伟其方法[10],打孔取叶圆片置于乙醇丙酮混合提取液中,暗提取48 h后测定。丙二醛(MDA)含量采用硫代巴比妥酸法[11],抗坏血酸(Vc) 含量测定采用红菲罗啉法[12]。SOD活性测定采用氮蓝四唑(NBT)光化还原法[13],以抑制NBT光化学还原的50%酶量为1个酶活性单位(U);POD活性采用愈创木酚法[13]测定,以每分钟内吸光度OD470变化0.01为1个酶活性单位(U)。脯氨酸含量采用水浴浸提法测定,可溶性糖含量采用蒽铜比色法[14]测定,可溶性蛋白含量采用考马斯亮蓝染色法[15]测定。
1.4 数据处理
试验数据用DPS 7.05软件进行方差分析,用Duncan’s新复极差法进行多重比较,用Excel 2003软件作图。
2 结果与分析
2.1 NaCl胁迫对黄花菜植株生长的影响
2.1.1形态指标表1表明,盐胁迫25 d后,随NaCl处理浓度的提高,黄花菜植株的根长表现先增长后缩短的规律,而其他形态指标均逐渐显著降低。其中,在200和250 mmol·L-1NaCl胁迫下,株高、叶片数、最大叶面积、新生根数分别比CK降低27.49%、47.17%、39.02%、60.16%和37.05%、56.33%、47.82%、77.84%,但各处理均无死苗现象。说明盐胁迫严重抑制了黄花菜植株的形态生长,且NaCl浓度越高,抑制程度越大,但本试验设置的NaCl浓度并未达到黄花菜的致死浓度。
2.1.2生物量和含水量由表2可知,黄花菜植株地上部鲜质量随NaCl浓度提高而逐渐降低,且均与CK差异显著;根系鲜质量则表现出先增加后降低的变化趋势,并在100 mmol·L-1NaCl下达到最大值,但仅250 mmol·L-1浓度处理显著低于CK,其余处理均与CK无显著差异;250 mmol·L-1NaCl胁迫下,地上部和根系鲜质量分别比CK显著降低64.36%和15.40%。同时,随NaCl浓度提高,各处理黄花菜植株地上部和根系干质量均逐渐降低,且与CK差异大多达到显著水平;250 mmol·L-1NaCl胁迫下,地上部和根系干质量分别比CK显著降低65.50%、51.67%。另外,随NaCl浓度提高,各处理黄花菜植株地上部含水量变化幅度较小,与CK均无显著差异;而根系含水量则表现出逐渐增加趋势,且在较低浓度下增加幅度较大,而在150 mmol·L-1浓度以上基本保持稳定,但各处理均显著高于CK。以上结果说明,NaCl胁迫显著抑制了黄花菜地上部的生物量积累,且随胁迫浓度增加抑制程度增大,但盐胁迫可以刺激根系吸收水分,导致低浓度NaCl下根系鲜质量增加而干质量降低。
2.2 NaCl胁迫对黄花菜叶片光合色素含量的影响
随NaCl浓度的提高,黄花菜叶片各光合色素含量在盐胁迫5 d时先增加后降低,而在胁迫10~25 d时均表现出逐渐降低的趋势,且胁迫时间越长处理间差异越大(图1)。其中,盐胁迫5 d时,各光合色素含量均在150 mmol·L-1NaCl下达到最大值,但各处理与CK差异大多不显著;在处理后10 d时,各光合色素含量除50 mmol·L-1NaCl处理外均显著低于CK,而其余处理间差异不显著;250 mmol·L-1NaCl胁迫处理的叶片叶绿素a、叶绿素b和类胡萝卜素含量在盐胁迫后15 d时分别比CK显著降低32.77%、25.98%、28.48%,在处理后20 d时分别显著降低28.12%、22.62%、21.50%,在处理后25 d时分别显著降低30.92%、23.23%、23.03%。说明100 mmol·L-1浓度以下 NaCl胁迫处理对黄花菜叶片光合色素代谢影响不大,150 mmol·L-1浓度以上高盐胁迫则会严重扰乱光合色素的代谢,使其含量显著降低。
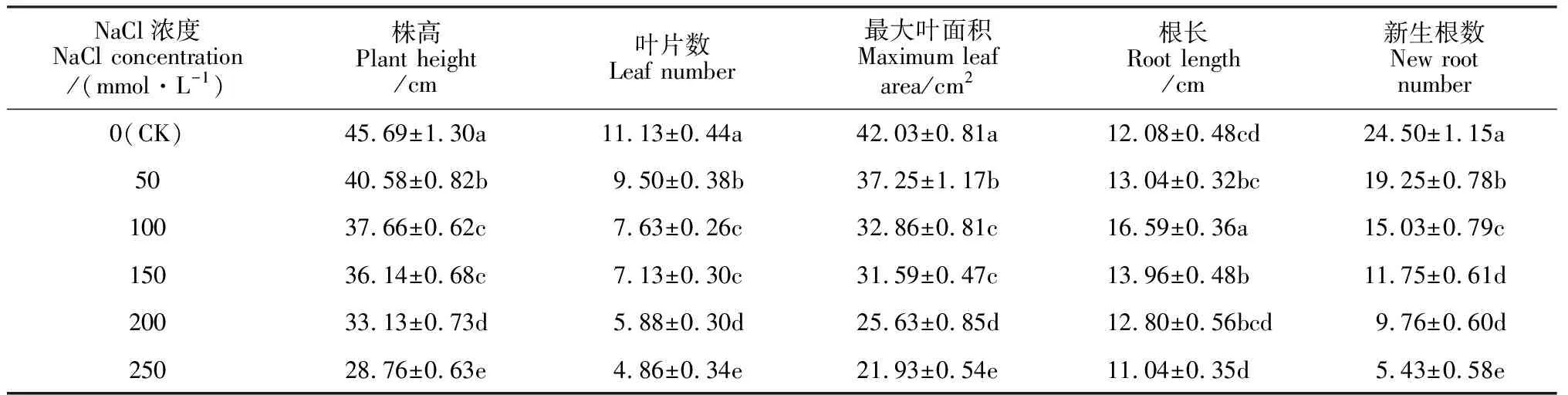
表1 NaCl胁迫下黄花菜植株形态指标的变化
注:同列数据后不同小写字母表示处理间差异达到5%显著水平。下同
Note: The different normal letters after data within same column indicate significant difference among treatments at 5% level. The same as below
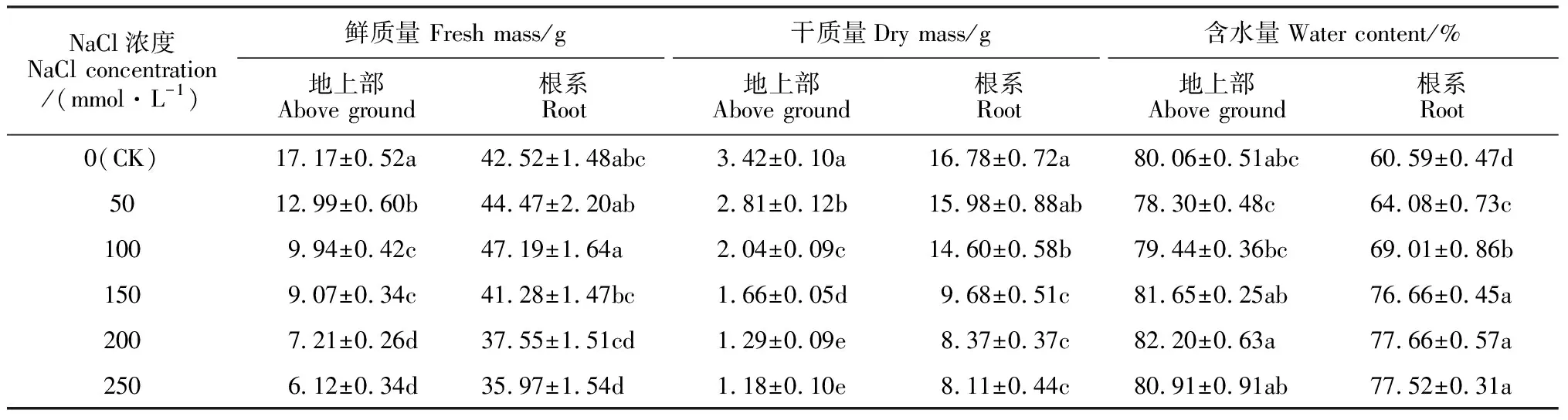
表2 NaCl胁迫下黄花菜植株生物量和含水量的变化
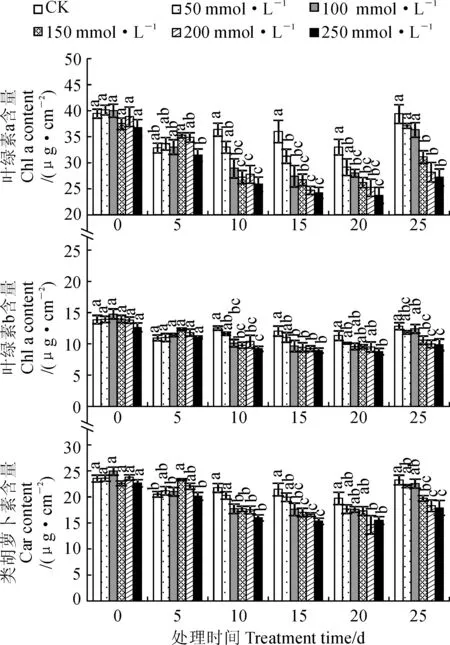
图1 NaCl胁迫下黄花菜叶片光合色素含量的变化Fig.1 The photosynthetic pigment contents in leaves of daylily under NaCl stress
2.3 NaCl胁迫对黄花菜叶片膜脂过氧化、抗氧化酶和抗氧化物质的影响
图2显示,随着NaCl胁迫浓度的增加,黄花菜植株叶片在处理5和10 d时的SOD活性,以及处理25 d时的抗坏血酸含量和POD活性均表现先增加后降低的变化趋势,且抗坏血酸含量在150 mmol·L-1NaCl下达到最大值,SOD和POD活性在200 mmol·L-1NaCl下达到最大值,而其余处理时间黄花菜叶片中MDA含量、抗坏血酸含量及SOD和POD活性均基本呈逐渐增加趋势,且处理20 d后,MDA和抗坏血酸含量的变化幅度明显下降;在相同时间内,各盐胁迫处理的各指标值都不同程度地高于CK;同时,随着处理时间的延长,各盐胁迫处理黄花菜叶片中MDA含量、抗坏血酸含量及SOD活性均在处理15 d时达到最大值,POD活性则在处理25 d时达到最大值。其中,在200和250 mmol·L-1NaCl胁迫下,黄花菜叶片中MDA含量、抗坏血酸含量及SOD活性在处理后15 d时分别比CK显著增加21.86%、22.73%、105.81%和37.28%、25.69%、114.69%,POD活性在处理后25 d时分别比CK显著增加227.71%和175.90%。说明NaCl胁迫造成黄花菜细胞的膜脂过氧化,且胁迫浓度越大膜脂过氧化程度就越重,同时黄花菜植株可通过提高抗坏血酸含量和抗氧化酶活性来清除部分自由基,从而减轻细胞膜的过氧化伤害程度,以维持植株的生理代谢和生长发育。
2.4 NaCl胁迫对黄花菜叶片中渗透调节物质含量的影响
由图3可知,随NaCl浓度提高,各处理时期黄花菜植株叶片脯氨酸含量均逐渐增加,且在150、200和250 mmol·L-1NaCl胁迫下均显著高于CK;随着处理时间的延长,50~200 mmol·L-1NaCl胁迫处理的叶片脯氨酸含量基本呈先增加后降低的趋势,并在处理15 d时达到最大值,而250 mmol·L-1NaCl胁迫处理呈持续增加趋势。其中,200和250 mmol·L-1胁迫处理15 d时脯氨酸含量分别比CK显著增加50.86%和65.18%,处理25 d时分别显著增加68.96%和166.57%。同时,黄花菜叶片可溶性糖含量除50和100 mmol·L-1NaCl处理在5 d时比CK显著增加外,其余浓度及处理时间均随NaCl浓度提高而逐渐降低,且均不同程度低于CK;在200和250 mmol·L-1胁迫下,叶片可溶性糖含量在处理后15、20、25 d时分别比CK显著降低21.23%、16.13%、26.54%和24.14%、22.39%、29.71%。
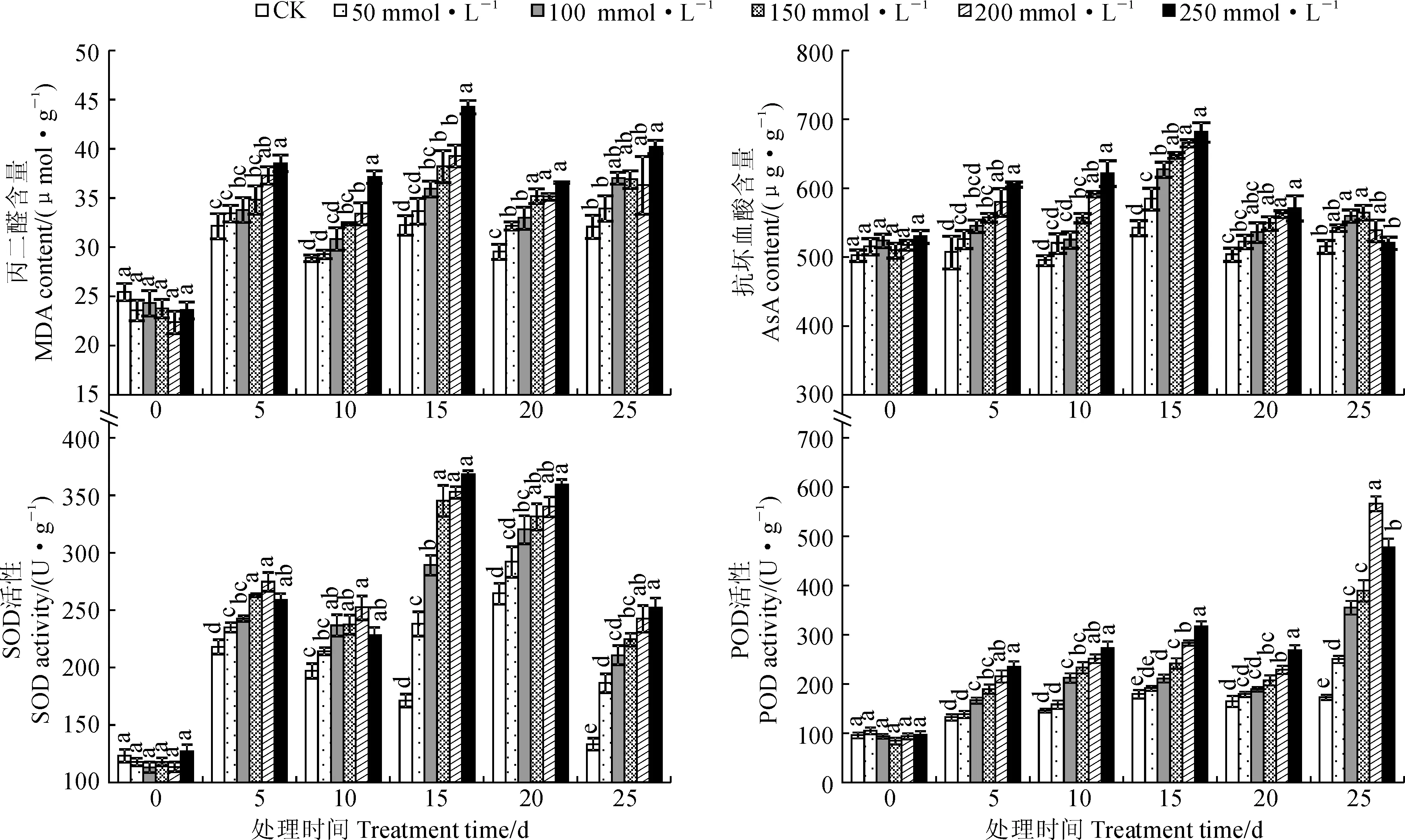
图2 NaCl胁迫下黄花菜叶片中丙二醛、抗坏血酸含量及SOD和POD活性的变化Fig.2 The MDA, AsA contents and SOD and POD activities in leaves of daylily under NaCl stress
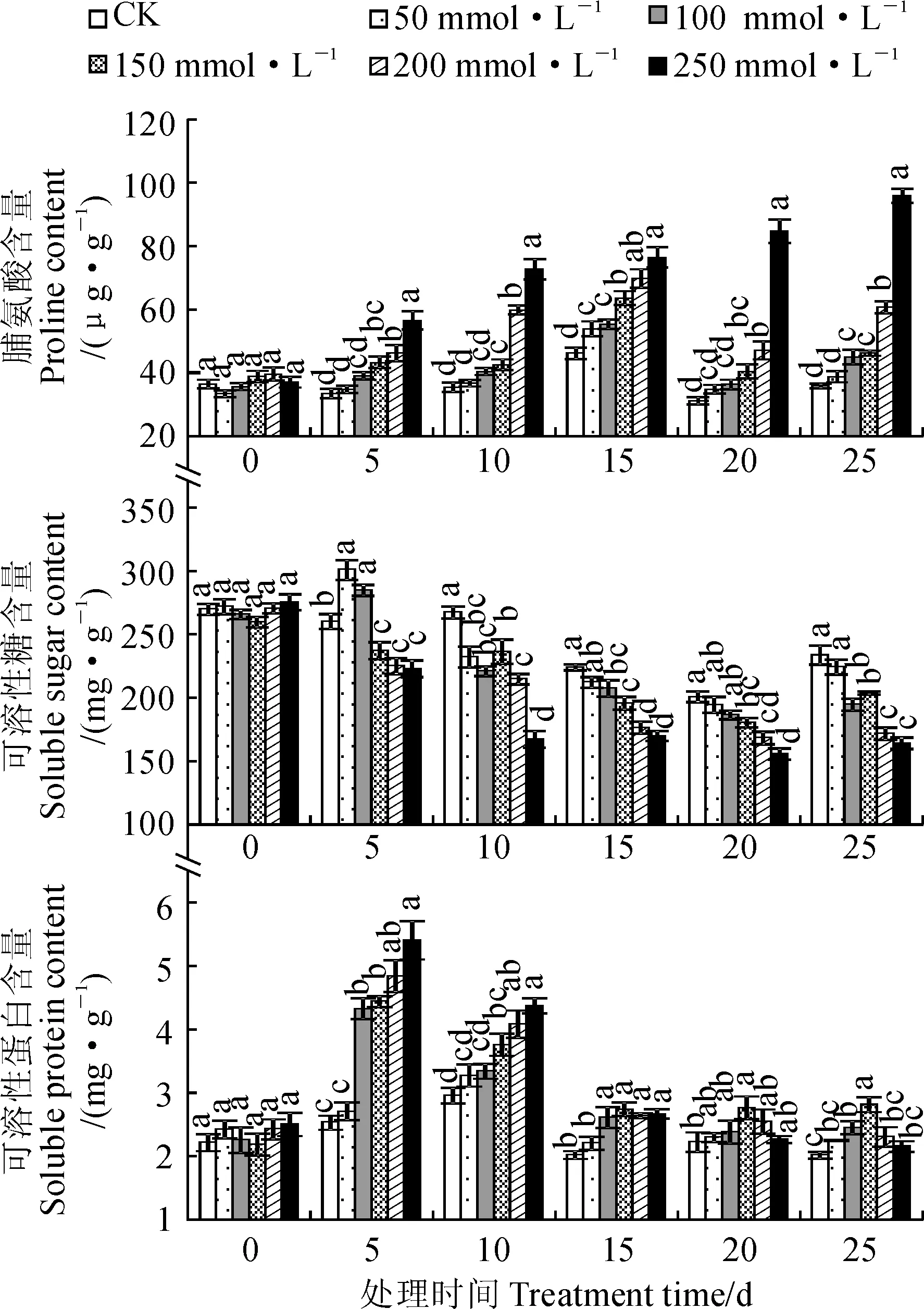
图3 NaCl胁迫下黄花菜叶片中渗透调节物质含量的变化Fig.3 The osmotic substance contents in leaves of daylily under NaCl stress
另外,随NaCl浓度提高,叶片可溶性蛋白含量在处理后5和10 d呈逐渐增加趋势,而在处理15、20、25 d时表现先增加后降低的规律,并均在150 mmol·L-1NaCl下出现最大值;与CK相比较,各浓度胁迫处理可溶性蛋白含量在各时期均不同程度增加,但在5~15 d时100~250 mmol·L-1NaCl处理增幅均达到显著水平,在20 d时仅150 mmol·L-1NaCl处理达到显著水平,在25 d时也仅在100和150 mmol·L-1NaCl处理增幅显著。可见,黄花菜植株通过大量合成、积累脯氨酸和可溶性蛋白而使细胞渗透势降低,增强植株抗盐性,从而适应盐胁迫环境,但较长期高浓度NaCl胁迫下可溶性蛋白积累较少,对渗透调节的贡献很小;同时,可溶性糖含量在盐胁迫下含量降低,说明其在黄花菜抵抗盐胁迫的渗透调节中不起作用。
3 讨 论
植物对环境作出的反应既受基因的控制,又受个体所处的生存条件和生长生理状况的制约[16]。由于碳同化量减少、渗透调节能耗和维持生长能耗增加等原因,多数植物在盐胁迫下生长发育会受到显著抑制[17]。本研究中,黄花菜植株各形态指标和生物量在NaCl胁迫下均明显降低,说明盐胁迫抑制了黄花菜植株的生长,但是与盐敏感植物[18-19]不同,黄花菜能够通过促进根系吸收水分而保持较高的根系生物量,使其植株在250 mmol·L-1NaCl胁迫下仍没有死亡。
叶片光合色素含量直接反映了植物的光合能力[20]。研究发现,许多植物在盐胁迫下光合色素含量降低,是由于叶绿素酶活性提高,促进了叶绿素的降解[21]。但也有盐胁迫下植物光合色素含量增加的报道[22],这可能与植物种类、耐盐性、盐处理方法、浓度及其时间等有关[23]。本研究中,黄花菜叶片光合色素含量在150和200 mmol·L-1NaCl处理5 d时略有增加,在较长期盐胁迫下则随盐浓度提高而降低,但100 mmol·L-1浓度以下NaCl处理的各光合色素含量与CK差异并不显著,说明黄花菜叶片的光合色素代谢在较低浓度盐处理下基本没有受到影响,而高盐胁迫(≥150 mmol·L-1)则会显著抑制其光合色素的合成而促进其降解,导致其含量显著降低。
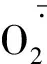
盐胁迫除造成离子毒害、过氧化伤害、 矿质营养缺乏外,还会导致体内水分亏缺,产生渗透胁迫[24, 29]。植物可通过吸收外界Na+、K+、Cl-等无机离子,或在体内合成脯氨酸、可溶性糖、可溶性蛋白、甜菜碱等小分子有机溶质,降低细胞渗透势,调节细胞渗透平衡,减轻体内的水分亏缺[30-31]。本研究中,随NaCl浓度提高,黄花菜叶片脯氨酸含量显著增加,可溶性蛋白含量在处理后10 d内显著增加,在200 mmol·L-1浓度以上NaCl处理15 d后开始降低,且相邻处理间差异也不显著。说明较短期盐胁迫下黄花菜可通过大量积累脯氨酸和可溶性蛋白而提高渗透调节能力,增强对盐胁迫的适应性,但较长期高浓度NaCl胁迫下主要依靠脯氨酸进行渗透调节,可溶性蛋白的渗透调节作用很小。但是,黄花菜叶片可溶性糖含量随NaCl浓度提高而显著降低,这与盐敏感植物的研究结果[17, 31]不同,但与碱茅[32]、冰叶日中花[33]等盐生植物的研究结果一致,可能是黄花菜在抵抗盐胁迫的过程中,作为光合产物和呼吸底物、植物的碳骨架和能量来源[34],可溶性糖运输到库器官或转化为淀粉,加上由于光合减弱而呼吸增强,植株为了维持生理机能而大量消耗[35],使其含量显著降低。这种变化对于黄花菜适应盐胁迫环境有利,但对渗透调节没有贡献,具体原因有待进一步研究。
综上所述,盐胁迫下黄花菜植株的生长被显著降低,但是盐胁迫下根系吸收水分增加,使根系生长所受影响较小。同时,在盐胁迫下,黄花菜能通过促进自身抗氧化物质和有机渗调物质的合成,从而提高了其抗氧化能力和渗透调节能力,一定程度上缓解了盐胁迫对其植株的伤害。但在长时间高盐胁迫下,黄花菜植株的自我调节无法抵抗胁迫造成的伤害,加上碳水化合物大量消耗,使其伤害进一步加重,生长不断受到抑制。本研究证明,黄花菜对NaCl胁迫的耐性较强,植株在250 mmol·L-1的高盐胁迫下仍能存活,其耐盐的生理和分子机制,特别是糖类物质代谢在其中所起的作用。
