不同条件对阪崎克罗诺肠杆菌生物被膜形成的影响
2018-11-06郝旭昇张晓荣郭都郑占文孙怡夏效东石超
郝旭昇,张晓荣,郭都,郑占文,孙怡,夏效东,石超
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
阪崎克罗诺肠杆菌(Cronobacter sakazakii,C.sakazakii)是一种无芽孢、杆状、兼性厌氧、周生鞭毛的革兰氏阴性菌,属于肠杆菌科克罗诺菌属[1]。阪崎克罗诺肠杆菌是近年来备受关注的一种食源性条件致病菌,它能导致新生儿及免疫力低下的成人患有可致命的菌血症、脑膜炎和坏死性小肠结肠炎,致死率高达50%[2,3]。据报道,阪崎克罗诺肠杆菌常从土壤、奶粉、肉类、奶酪、谷物、巧克力工厂和奶粉加工厂等样品及环境中分离得到[4,5],婴幼儿配方乳粉及其相关生产设备被认为是阪崎克罗诺肠杆菌传播、污染的主要途径[6]。
生物被膜是指在细菌与接触表面或细菌本身之间相互作用下,菌体通过增殖、分泌胞外基质而形成的具有一定空间结构的聚集体[7]。生物被膜导致更多致病菌的粘附并造成交叉污染,中国食源性疾病监测网显示,27%的食品污染是由食品生产、加工、储存设备表面的生物被膜所造成[8]。除此之外,生物被膜为致病菌提供了物理屏障,保护其免受消毒剂、热等环境压力的损伤和机体免疫杀伤[9],这使得病原菌致病能力增强,人体感染风险增大。研究显示,阪崎肠杆菌可在多种材料表面粘附并形成生物被膜[10],这使得阪崎克罗诺杆菌易于定植在婴幼儿食品加工设备、婴幼儿食品包装器具、食用器皿、搅拌工具的表面,这增大了它感染婴幼儿的风险[11]。
食源性致病菌在加工接触面形成生物被膜是一个动态演变过程[12],在该过程中诸多因素均会对菌体粘附和生物被膜产生重要影响。许多研究表明,细菌得失电子的能力、表面疏水性能、菌体的聚集性和泳动能力与细菌的粘附和生物被膜的形成相关[13]。除菌体自身特性外,生长温度、营养基质、pH值、NaCl浓度、接触面的材质类型等因素也会影响细菌的粘附和生物被膜形成过程[11,14]。探明影响菌体粘附及生物被膜形成的因素及规律对理解菌体生物被膜的形成过程和控制生物被膜具有重要的意义。
目前关于阪崎克罗诺肠杆菌生物被膜的研究主要集中在评价病原菌生物被膜的形成能力,但对不同条件(生长温度、培养基质、接触材料)对菌体生物被膜的形成及对消毒剂的抗性的影响缺乏探讨。基于目前存在的问题,本研究以阪崎克罗诺肠杆菌为研究对象,以12 ℃、25 ℃和37 ℃为生长温度,以胰蛋白胨大豆肉汤和婴幼儿乳粉肉汤为培养基质,以不锈钢、玻璃、硅胶三种材料为接触材料,探究以上不同条件对菌体粘附和生物被膜形成的影响;同时,借助场发射扫描电镜观测阪崎克罗诺肠杆菌在不同培养温度和材料表面形成生物被膜的空间结构;最后,分析不同条件对菌体耐受三种季胺类消毒剂的影响。本研究旨在发现生长温度、培养基质和接触材料对阪崎克罗诺肠杆菌菌体粘附及生物被膜形成的影响规律,为阪崎克罗诺肠杆菌生物被膜的控制提供理论依据。
1 材料与方法
1.1 菌种、培养基与化学试剂
阪崎克罗诺肠杆菌(C. sakazakii)ATCC 29004购于美国模式培养物集存库(American type culture collection,ATCC)。
二甲基亚砜(色谱纯)、玻璃珠(直径为425-600µm)、苯扎氯铵、双十烷基二甲基氯化铵、吐温80、皂素、无水硫代硫酸钠、L-组氨酸、卵磷脂购于美国sigma试剂公司;丙酮、戊二醛购于国药集团化学试剂有限公司。
1.2 仪器与设备
细菌生化培养箱 SPX-250B,上海南荣实验室设备有限公司;离心机5804R,德国Eppendorf公司;场发射扫描电子显微镜S-4800,日本Hitachi公司。
1.3 方法
1.3.1 菌株活化与菌悬液制备
菌株活化与菌悬液制备参考石超等[15]的方法,将菌体使用磷酸盐缓冲溶液(Phosphate buffer solution,PBS,pH=7.2)清洗并悬浮,调整菌悬液中菌体浓度约为108CFU/mL。最后将菌悬液稀释10000倍,使菌体浓度为104CFU/mL备用。
1.3.2 不同营养基质及温度下稳定期菌体的制备
试验参照 Kim等[11]的方法制备稳定期菌体。首先将婴幼儿配方乳粉与蒸馏水以 1:10(m/V)的比例混合,加热到50至60 ℃下溶解,121 ℃下高压灭菌15 min后制备为婴幼儿乳粉肉汤(Infant formula broth,IFB)。随后分别取一定量 1.3.1中制备的菌悬液接种于其百倍体积的TSB或IFB中,置于12 ℃、25 ℃及37 ℃下培养,在37 ℃下于TSB和IFB中均培养1 d,25 ℃下于TSB和IFB中各培养2 d,12 ℃下于TSB培养6 d,IFB培养8 d,使各处理组下菌体生长达到稳定期(菌悬液浓度约为109CFU/mL)。
1.3.3 阪崎克罗诺肠杆菌的粘附定量检测
试验前须对三种接触材料进行清洗,具体程序如下:将不锈钢(食品级304不锈钢,50 mm×20 mm,4号光洁面)、玻璃(钢化高温高压玻璃,50 mm×20 mm)、硅胶(医用食品级)置于丙酮溶液中超声10 min,使用无菌水漂洗后再用无水乙醇浸泡,随后取出样品用蒸馏水再次洗涤,高压蒸汽灭菌15 min后备用。取1.3.2中菌悬液30 mL于载有不锈钢,玻璃,硅胶的离心管中至恰好浸没接触材料上端,将其于12 ℃、25 ℃及37 ℃下恒温静置,分别于1、2、4、8、12和24 h规定时间内取样,依次用400 mL无菌水漂洗15 s,200 mL无菌水漂洗5 s,随后将样品放入含有3 g玻璃珠及30 mL PBS的离心管中,充分涡旋5 min以使粘附菌体脱落。取涡旋后上清液,使用PBS进行10倍梯度稀释,后将其涂布于TSA平板上,于37 ℃下恒温培养24 h后计算菌体数量,结果以log CFU/cm2表示。
1.3.4 阪崎克罗诺肠杆菌生物被膜形成的定量检测
将1.3.2中制备的菌悬液离心(4000 r/min,15 min,4 ℃)后,去上清,使用PBS洗涤菌体沉淀三次,随后使用一定量PBS悬浮菌体,并调整菌体浓度为107CFU/mL。将不锈钢、玻璃、硅胶置于含有30 mL菌悬液的离心管中,于4 ℃下静置24 h,随后取出样品分别使用400 mL无菌水漂洗15 s、200 mL无菌水漂洗5 s,将洗涤后的样品放入含有30 mL TSB或IFB的离心管中,于12 ℃、25 ℃及37 ℃下恒温静置培养,分别于0、2、4、6、8和10 d规定时间内取样,再次使用前述方法清洗样品,将不锈钢,玻璃,硅胶三种生物被膜形成材料放入含有3 g玻璃珠和30 mL PBS的离心管中,充分涡旋5 min以使粘附菌体脱落。吸取涡旋后的上清液,使用PBS进行10倍梯度稀释后涂布,将TSA平板置于37 ℃下恒温培养24 h,计算菌体数量,结果以log CFU/cm2表示。
1.3.5 场发射扫描电镜观察生物被膜微观结构
参照石超等[15]和王虎虎[16]的方法,利用场发射扫描电镜观察生物被膜微观结构,并略有修改。菌悬液制备参照1.3.2,使用PBS洗涤菌体并调整菌悬液浓度为107CFU/mL。将菌悬液加入分别载有不锈钢、玻璃、硅胶的离心管中,于4 ℃下恒温静置24 h,使用蒸馏水两次漂洗后将样品放入含有 TSB的离心管中,在12 ℃,25 ℃及37 ℃下培养48 h。规定时间下取样漂洗,经 2.5%戊二醛溶液 4 ℃固定过夜后,使用无菌水和PBS依次洗涤,随后使用1%(V/V)锇酸将菌体再次固定 5 h,利用不同浓度梯度(30%、50%、70%、80%、90%和100%)的乙醇进行洗脱,每次处理时间为10 min。最后将处理后的样品镀金,使用场发射扫描电镜(4000×)观察 12 ℃、25 ℃和37 ℃下不锈钢、玻璃、硅胶表面细菌生物被膜的微观结构。
1.3.6 细菌生物被膜对消毒剂抗性的测定
细菌生物被膜对消毒剂抗性的测定参照Abdallah等[17]的方法,并略作修改。首先,菌液制备同1.3.2,取上述菌液离心(4000 r/min,15 min,4 ℃)后,去上清,使用PBS洗涤菌体沉淀三次后,使用一定量PBS悬浮菌体,并调整菌体浓度约107CFU/mL。取上述菌悬液于分别载有不锈钢、玻璃、硅胶的离心管中,4 ℃下静置24 h,使用无菌水漂洗样品两次。随后将其放入含有30 mL TSB的离心管中,分别于12 ℃、25 ℃及37 ℃下恒温培养,48 h后取出样品,使用蒸馏水漂洗两次,分别浸没于三种消毒剂液体(30 mL)中15 min(消毒剂产品见表1),随后取出样品浸没于中和液(L-组氨酸1 g/L,皂素30 g/L,卵磷脂30 g/L,TSB 30 g/L,吐温80 30 g/L,无水硫代硫酸钠5 g/L)中以终止消毒剂作用。将样品置于装有3 g玻璃珠,30 mL PBS的离心管中充分涡旋,吸取菌悬液进行10倍梯度稀释后涂布,将平板置于37 ℃恒温培养箱中,于24 h后取样计算菌体数量,结果以logCFU/cm2表示。
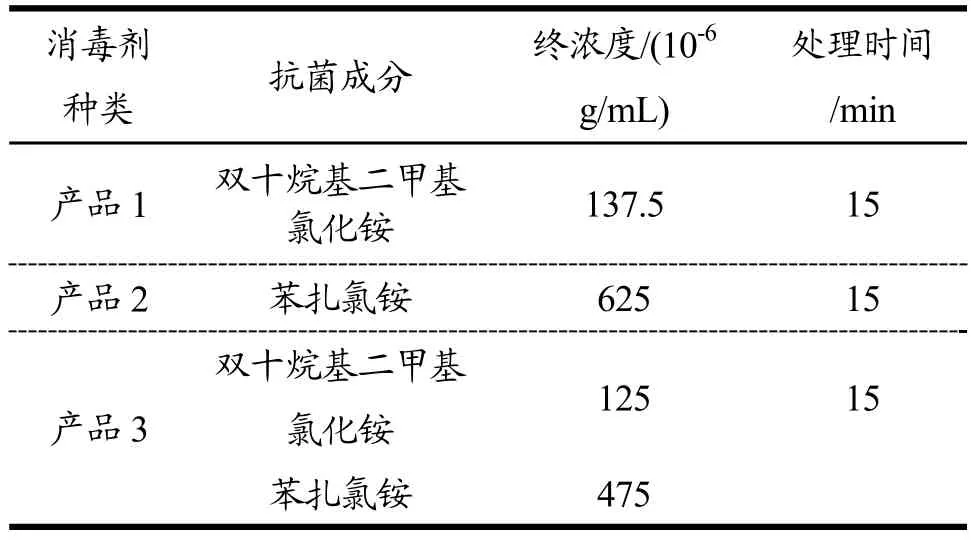
表1 消毒剂产品的种类和特性Table 1 Type and characteristic of disinfectant products
1.4 数据处理
数据表示为平均值±标准差(n=3),同时使用SPSS软件(version 20.0,Inc.,Chicago,IL)进行统计分析,并采用Ducan's ANOVA进行结果间显著性检验,p≤0.05为显著。
2 结果与讨论
2.1 生长温度、培养基质和接触材料对阪崎克罗诺肠杆菌粘附的影响
阪崎克罗诺肠杆菌在12 ℃、25 ℃及37 ℃条件在三种材料表面粘附的定量检测结果如图1所示。结果表明:培养温度对菌体粘附有显著影响。在TSB和IFB两种培养基质中,12 ℃下阪崎克罗诺肠杆菌粘附菌量均明显低于25 ℃及37 ℃。12 ℃下菌体在TSB中1 h粘附菌量约4.5 log CFU/cm2,在IFB中1 h粘附菌量约为3.2 log CFU/cm2,而在25 ℃和37 ℃下阪崎克罗诺肠杆菌的粘附能力接近,起始粘附菌量约5.0 log CFU/cm2。
同时,根据图1我们发现,阪崎克罗诺肠杆菌的粘附菌量受培养基质影响。在 12 ℃条件下,菌体在TSB中的粘附菌量在检测的24 h内高于其在IFB中的粘附菌量。


图1 阪崎克罗诺肠杆菌ATCC 29004在不锈钢、玻璃、硅胶表面的粘附菌量Fig.1 The cell number of C. sakazakii ATCC 29004 attached to the surface of stainless steel, glass and silicone
在25 ℃条件下,菌体在TSB中在三种材料表面的粘附菌量在24 h时相近,约5.2 log CFU/cm2。菌体在IFB中的粘附菌量在三种材料表面存在差异,其中在不锈钢和硅胶表面的粘附菌量约为 6.0 log CFU/cm2,在玻璃表面的粘附菌量约为 5.3 log CFU/cm2。在 37 ℃条件下,菌体在不锈钢和硅胶材料表面在IFB中的粘附菌量均大于在TSB中的粘附菌量。此外,材料表面对于菌体粘附也有一定的影响。由图1c和1f可知,菌体在37 ℃条件下的TSB、IFB中,硅胶表面粘附菌量最大,玻璃的粘附菌量最小。在25 ℃ IFB中(图1d),阪崎克罗诺肠杆菌也表现出在玻璃表面的粘附能力最弱。在其他条件下,菌体在三种材料表面的粘附菌量无明显差异。综上所述,阪崎克罗诺肠杆菌在37 ℃条件下的IFB中,硅胶表面的粘附菌量最大。
2.2 生长温度、培养基质和接触材料对阪崎克罗诺肠杆菌生物被膜形成的影响
阪崎克罗诺肠杆菌生物被膜形成定量检测结果如图2所示。结果表明,温度对阪崎克罗诺肠杆菌生物被膜的形成有显著影响。与25 ℃和37 ℃相比,阪崎克罗诺肠杆菌在12 ℃下的初始粘附菌量最少,且该温度下生物被膜形成最为缓慢,8d后生物被膜形成量趋于稳定。在25 ℃的TSB和IFB中,菌体在三种材料表面的生物被膜形成量在0~2 d快速增加,随后趋于稳定。37 ℃条件下不同介质、不同材料中阪崎克罗诺肠杆菌生物被膜形成量均在第2 d达到最大值,随后呈下降趋势。对比2 d内生物被膜形成量,菌体在25 ℃的TSB中的生物被膜形成能力最强。
同时,由图2可知,阪崎克罗诺肠杆菌生物被膜的形成受培养基质影响。在本研究检测的3个温度条件下,阪崎克罗诺肠杆菌在TSB中生物被膜形成能力强于IFB。此外,除在37 ℃的IFB中,菌体在10 d的成膜量在玻璃表面最小,其他条件下,菌体在三种表面的生物被膜形成量无稳定的变化趋势,最终表现出各材料表面生物被膜在第10 d的形成量几乎相同。


图2 阪崎克罗诺肠杆菌ATCC 29004在不锈钢、玻璃、硅胶表面生物被膜的形成量Fig.2 The cell number of biofilm formed by C. sakazakii ATCC 29004 on the surface of stainless steel, glass and silicone
2.3 生长温度和接触材料对阪崎克罗诺肠杆菌生物被膜微观结构的影响
试验利用场发射扫描电镜观察阪崎克罗诺肠杆菌在不锈钢、玻璃、硅胶表面生物被膜的微观结构,结果如图3所示。

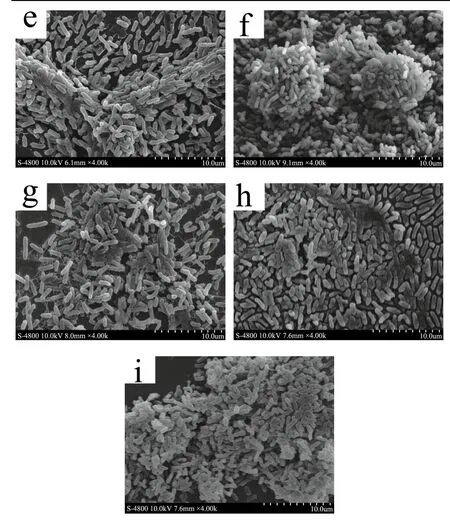
图3 阪崎克罗诺肠杆菌ATCC 29004生物被膜的扫描电镜图Fig.3 Scanning electron microscope images of biofilm formed by C. sakazakii ATCC 29004
由图3a、3b和3c可知,12 ℃时阪崎克罗诺肠杆菌的生物被膜为单层结构,此时尚无细菌聚集体形成,胞外基质较少,生物被膜稀疏呈现薄层,视野中只有少量菌体粘连。此外,在三种表面下生物被膜微观结构有较为明显差别,不锈钢表面菌体最为密集(图3-A1),而玻璃和硅胶表面菌体较为分散。
由图3d、3e和3f可知,25 ℃下阪崎克罗诺肠杆菌在三种接触材料表面均能形成成熟的生物被膜,呈现出明显的三维空间结构,且多个小型聚集体通过菌体连接形成大型细菌聚集体,菌体以多层堆叠形式聚集在一起。同时,成熟生物被膜的微观结构在三种表面有明显的差别:硅胶表面的生物被膜极其致密,菌体“簇拥”形成三维空间结构(图3f);不锈钢表面生物被膜较为致密,菌膜层较厚,菌体以堆叠式形成三维空间结构(图 3d);玻璃表面生物被膜则较为稀疏,胞外基质较少,菌膜层较薄,仍有较多的细菌以单层、散体的形式存在(图3e)。
由图3g、3h和3i可知,37 ℃下阪崎克罗诺肠杆菌在三种表面以平铺堆叠式形成三维结构。硅胶和玻璃表面生物被膜较为致密,胞外基质较多,其中硅胶表面生物被膜的空间结构更加明显(图3i)。
2.4 生长温度和接触材料对阪崎克罗诺肠杆菌生物被膜对消毒剂抗性的影响
阪崎克罗诺肠杆菌的生物被膜对三种市售消毒剂的抵抗能力检测结果如表2所示。由结果可发现,阪崎克罗诺肠杆菌生物被膜对消毒剂的抵抗能力受菌体生长温度和接触表面类型的影响,且与消毒剂类型有关。不锈钢、玻璃表面阪崎克罗诺肠杆菌生物被膜对三种消毒剂的抵抗能力随生物被膜形成温度升高而增强,而硅胶表面生物被膜对消毒剂的抵抗能力表现出25 ℃最强,37 ℃次之,12 ℃最差。
三种消毒剂对阪崎肠杆菌生物被膜的杀菌作用表现有异,但随温度升高呈现相同的变化规律。由表 2可知,消毒剂产品1处理效果最差,其作用15 min后检出残余菌量最高达 54.7%;在三种消毒剂中产品 3表现出最强的杀菌作用,处理15 min后最大活菌量仅为5.1%。消毒剂产品3对阪崎肠杆菌生物被膜的去除能力强于产品1和产品2,说明双十烷基二甲基氯化铵和苯扎氯铵对生物被膜的清除具有结合作用。
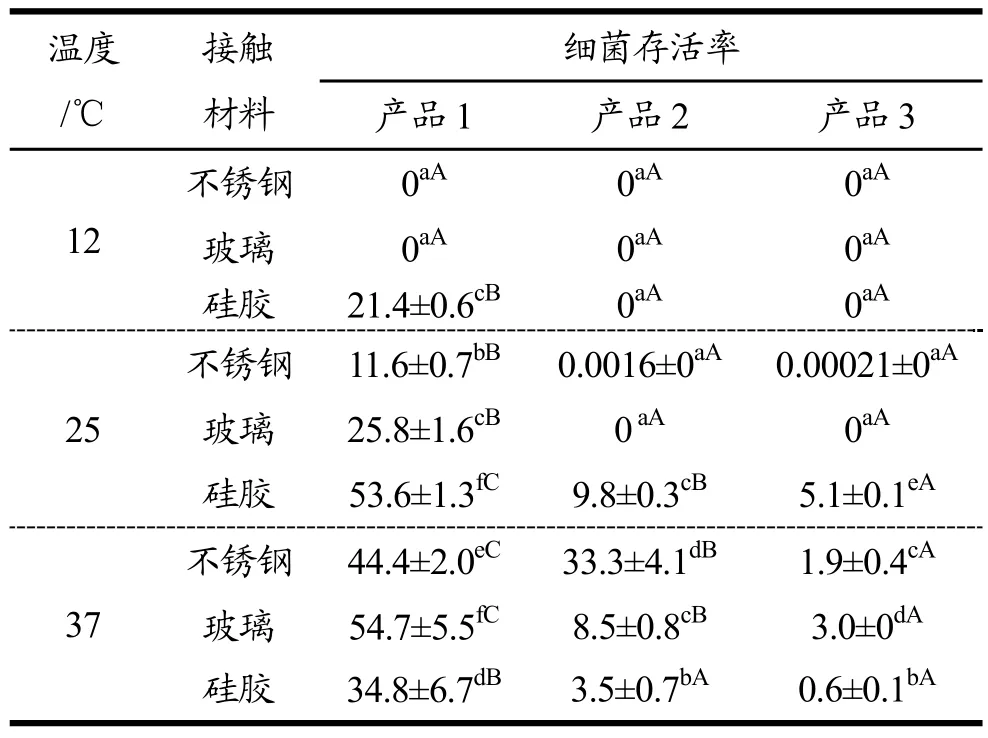
表2 生长温度对阪崎肠杆菌生物膜抗消毒剂产品的影响Table 2 Effect of growth temperature on the resistance of C.sakazakii biofilms to disinfectant products
3 讨论
本研究选取实验室培养介质 TSB和复原婴幼儿乳粉肉汤IFB为菌体培养基质,以37 ℃(阪崎克罗诺肠杆菌适宜生长的温度)、25 ℃(室温)和12 ℃(欧洲议会和理事会于 2004年制定的食品卫生规则条例中食品工业操作环境温度)为菌体培养温度,以乳粉加工设备、奶瓶、婴幼儿鼻饲管等器具常用的三种材料(不锈钢、玻璃和硅胶)为本研究接触材料,探究不同因素对阪崎克罗诺肠杆菌菌体粘附和生物被膜形成的影响。
为深入探究不同培养条件对菌体的粘附能力的影响,本研究使用经过不同条件(TSB、IFB;12 ℃、25 ℃、37 ℃)培养后的阪崎克罗诺肠杆菌进行粘附实验,这使得菌体后续粘附过程环境与前期培养条件一致,从而能够完整反映培养条件对菌体粘附的影响。本研究使用进入稳定期初期的菌体(菌悬液浓度约为109CFU/mL)进行粘附试验,以避免经过不同条件培养后的菌体数量及生理状态的差异从而进行更加准确的比较。结果表明12 ℃下阪崎克罗诺肠杆菌粘附菌量低于25 ℃及37 ℃的粘附菌量,且12 ℃下生物被膜形成量也明显低于25 ℃及37 ℃,其中,菌体在25 ℃的TSB介质中的成膜量高于其在37 ℃的成膜量。类似的,Han等[18]发现副溶血弧菌在15~37 ℃的生物被膜形成量高于 4~10 ℃,并且菌体在不锈钢表面的成膜量在30 ℃最高,研究证明当培养温度从4 ℃升高至30 ℃时,菌体胞外蛋白酶活力增强,与生物被膜相关的群体感应信号分子AI-2产量增高,但在37 ℃时酶活力减弱,AI-2产量降低。Speranza等[19]检测了沙门氏菌在20、30和40 ℃在蛋白胨水(1.0~2.5 g/L)中生物被膜的形成能力,结果表明,温度对沙门氏菌生物被膜形成能力影响较大,菌体在30 ℃的成膜量高于40 ℃,20 ℃的成膜量最低。研究者推测是由于菌毛和纤维素是沙门氏菌形成生物被膜的重要基质组分,agfD启动子受到环境的影响因而影响菌毛形成,菌毛合成的温度是 28 ℃使得菌体在 30 ℃成膜量最高。Bonsaglia等[14]检测了单增李斯特菌在脑心浸液肉汤中不锈钢表面的成膜能力,结果表明,在研究检测的三个温度(4 ℃、20 ℃和35 ℃)中,当温度为25 ℃时菌体粘附能力最强。研究者认为是菌体鞭毛的合成影响了单增李斯特菌的菌体粘附。37 ℃条件下MogR抑制鞭毛相关基因的转录,因此菌体无鞭毛,且不能运动,但在30 ℃条件时,MogR被抑制从而使鞭毛基因转录。鞭毛在生物被膜形成的过程中具有重要的作用,其能够促进菌体的粘附和生物被膜的成熟。研究结果表明,纤维素和鞭毛有助于阪崎克罗诺肠杆菌生物被膜的形成,但是菌毛与其生物被膜形成没有相关性[20]。此外,阪崎克罗诺肠杆菌胞外聚合物能够维持生物被膜的三维结构和生命周期,研究表明,在0~30 ℃范围内,阪崎克罗诺肠杆菌在27 ℃时胞外多糖合成量最大。
由本研究结果发现,阪崎克罗诺肠杆菌在37 ℃条件下,在两种培养基质中均出现了在培养的第二天生物被膜形成量最大,随后生物被膜量逐步减少(图2-C1和图2-C2)。本研究结果与Bonsaglia等[14]研究结果相似,单增李斯特菌在35 ℃环境培养48 h后,生物被膜量降低。Jo等[21]发现阪崎克罗诺肠杆菌分离在硅胶、聚碳酸酯、不锈钢材料表面形成的生物被膜在24 h达到最大值,在随后检测的144 h内生物被膜量逐步降低。以上结果可能是由于在培养一定时间后,生物被膜的形成进入了主动分散阶段。随着生物被膜的成熟,生物被膜结构愈发复杂和庞大,但这使得营养物质难以进入到生物被膜内部,致使生物被膜从内部开始消散,同时外部的部分细菌聚集体或者单个菌体也开始从生物被膜上脱落、散播,脱落后的菌体成为浮游菌体后开始新一轮的生物被膜形成过程[22]。
食品加工接触面材质类型也是影响菌体粘附数量和生物被膜形成的关键因素之一,本研究结果发现,阪崎克罗诺肠杆菌在25 ℃环境的IFB中,37 ℃的TSB和IFB中,其在玻璃表面粘附菌量最低,硅胶表面粘附菌量最高,但在其他条件,三种材料表面粘附菌量没有明显差异(图2)。玻璃、不锈钢材料具有亲水性而硅胶材料具有疏水性,菌体在不同材料表面的粘附与材料的表面特性有关。我们的研究结果与Kim等[11]研究结果类似,他们发现四株阪崎肠杆菌菌株在硅胶表面的粘附菌体高于在不锈钢表面的粘附菌体。De Oliveira等[23]研究结果表明沙门氏菌在不锈钢和玻璃表面的生物被膜形成量低于在 PVC材料表面的生物被膜量。但也有研究表明菌体在亲水材料表面生物被膜的形成量高于疏水材料[14,24]。
本研究结果表明,菌体在TSB中生物被膜的形成量高于在IFB中(图2)。TSB中的主要营养成分包括胰酪蛋白胨、大豆蛋白胨、氯化钠、葡萄糖以及磷酸盐,用来制备IFB的婴儿配方乳粉含脱脂牛奶、玉米糖浆、乳糖、大豆油、浓缩乳清蛋白等营养物质。已有研究表明,NaCl和葡萄糖可以促进细菌生物被膜的形成[25]。同时,我们推测,在TSB和IFB两种介质中生物被膜形成量的不同也归因于培养基质的营养物质、pH值和溶液黏度等,TSB相比IFB更利于阪崎克罗诺肠杆菌生物被膜的形成。
本研究结果表明,阪崎克罗诺肠杆菌生物被膜对消毒剂的抵抗能力与菌体培养温度有关,相较于12 ℃,25 ℃和37 ℃条件下形成的生物被膜对消毒剂的抗性更强(表2),Abdallah等[17]研究结果表明,随培养温度升高,铜绿假单胞菌和金黄色葡萄球菌形成的生物被膜对季胺类消毒剂的耐受能力增强。根据本文中场发射扫描电镜观测结果,我们猜测生物被膜对消毒剂的抵抗能力取决于生物被膜的厚度和紧密度,25 ℃和37 ℃条件下形成的生物被膜较12 ℃时更加立体且致密,从而增强了生物被膜对消毒剂的抵抗能力。并且,由图2可知,37 ℃条件下菌体在生物被膜形成第二天时,三种材料表面生物被膜量基本一致,但经过消毒剂处理后,三种材料表面生物被膜量产生了差异。这说明,生物被膜对消毒剂的抵抗能力也与接触材料相关,除此之外,消毒剂的种类也与生物被膜对消毒剂的抵抗能力有关。
4 结论
阪崎克罗诺肠杆菌对非生物表面的粘附和生物被膜的形成受生长温度、培养基质和表面材料的影响。12 ℃下阪崎克罗诺肠杆菌粘附和生物被膜形成能力最弱,25 ℃和37 ℃生物被膜形成周期较快,菌体在TSB中生物被膜形成量高于其在IFB中;场发射扫描电镜观测生物被膜微观结构结果表明,生长温度和表面类型对菌体生物被膜的结构有显著影响,25 ℃和37 ℃下阪崎克罗诺肠杆菌均能形成成熟的生物被膜,具有立体且致密的结构,12 ℃时菌体生物被膜为单层结构;生物被膜对消毒剂的抗性受培养温度、表面类型和消毒剂种类的影响,12 ℃阪崎克罗诺肠杆菌生物被膜对消毒剂的抵抗能力最弱,不锈钢、玻璃表面的生物被膜对消毒剂的抗性随温度升高而增强,硅胶表面生物被膜在 25 ℃下对消毒剂的抗性最强。本研究为理解阪崎克罗诺肠杆菌生物被膜形成因素提供实验依据,有望为更新、制定婴幼儿配方乳粉加工、流通环节微生物安全标准提供参考,为乳粉加工、冲调等器具材料的选择提供理论依据。
