昆仑雪菊原花青素对四氯化碳致小鼠肝损伤的保护作用
2018-11-06翟红月敬思群柴文杰赵正梅
翟红月,敬思群,柴文杰,赵正梅
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830046)
(2.韶关学院英东食品科学与工程学院,广东韶关 512005)
雪菊(Coreopsis tinctoria),学名双色金鸡菊,通常又称“清三高花”[1]。新疆昆仑雪菊生长在海拔3000米以上的昆仑山北麓一带,含有多种对人体有益的活性成分。新疆维吾尔族民间以雪菊制作茶饮,长期饮用可治疗腹泻、高血脂、肠胃不适、燥热、高血压等疾病[2,3]。肝脏为人体内最复杂的代谢器官,也被视为身体的重要屏障器官。肝脏疾病在我国发病范围较广、发病率较高,给人们的健康造成严重危害,产生极大经济负担[4]。肝细胞损伤是各型肝病的病理基础,治疗与纠正肝细胞损伤是各型肝病治疗的主要措施之一[5,6]。此外,线粒体功能障碍可引起各种肝衰竭、肝损伤、脂肪肝等肝脏病变[7,8]。近年来,中西医结合治疗肝脏疾病的经验日益丰富,尤其是植物活性成分运用较为广泛[9,10],例如葡萄籽原花青素可能通过促进小鼠肝细胞增殖、抑制肝组织细胞凋亡和自噬,对小鼠肝损伤起到保护作用[11];莲房原花青素对大鼠肝损伤具有一定的保护作用,其机制可能与其抗氧化作用有关[12],昆仑雪菊原花青素的保肝作用鲜有深入研究。
昆仑雪菊原花青素(Kunlun Chrysanthemum Proanthocyanidins, KCPC)是雪菊的次生代谢产物(超声辅助法提取率为13.29%[13])。原花青素是由不同数量的黄烷-3-醇或黄烷-3,4-二醇聚合而成的聚合物的总称[14],有很强的稳定性和抗氧化性[15,16],能较好的清除氧游离基[17]、抑制肿瘤[18],提高免疫力和防御紫外线辐射[19],是一种良好的天然抗氧化剂[20,21]。前期实验对昆仑雪菊的三种活性成分(原花青素、多糖及总黄酮,实验室自制)进行了保肝作用研究,通过检测小鼠血清中AST、ALT水平,发现昆仑雪菊多糖及总黄酮不能显著降低小鼠体内转氨酶活性,无明显的肝保护作用,而昆仑雪菊原花青素(高剂量组)有显著性保护作用[22],因此本研究以此为基础,拟采用CCl4诱导的小鼠急性肝损伤为模型,进一步深入探讨昆仑雪菊原花青素对肝损伤的保护作用及其可能的机制,为研发治疗肝脏疾病的新药奠定基础。
1 材料与方法
1.1 材料与试剂
昆仑雪菊由新疆和田沙漠玫瑰有限责任公司提供,经新疆大学阿不都拉·阿巴斯教授鉴定为两色金鸡菊Coreopsis basalis的干燥花蕾;昆仑雪菊原花青素,实验室自制(昆仑雪菊原花青素含量为26.58 mg/g,经 AB-8大孔树脂纯化后纯度为(63.76±0.34)%;HPLC-MS分离检测出14个组分,后通过HPLC分析得表儿茶素和原花青素 B2含量分别为 12.19%、0.91%,尚未发表);ALT、AST试剂盒、GSH-Px、SOD、MDA、SDH试剂盒均购自南京建成生物工程研究所;CCl4购自天峰试剂有限公司;橄榄油,市售。
1.2 仪器与设备
V-1100D型可见分光光度计,上海美谱达仪器有限公司;迈瑞 BS-120全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;FZ102-SIM真空冷冻干燥设备,德国西门子公司;KQ-400KDE型高功率数控超声波清洗器,昆山市超声仪器有限公司;Anke TDL-5-A离心机,上海安亭科学仪器厂。
1.3 实验动物
昆明种雄性小白鼠,购买于新疆医学实验动物中心(合格证号:NO.650007000,使用许可证编号:SYXK(新)2011-0001)。
1.4 试验方法
1.4.1 CC14诱导肝损伤小鼠分组及处理方式
昆明种雄性小白鼠60只,4周龄,按体重随机分为6组,分别为正常组、模型组、阳性药物组(联苯双酯,300 mg/kg)、KCPC低(200 mg/kg)、中(400 mg/kg)、高剂量(800 mg/kg)给药组(剂量设置根据前期预实验结果及相关参考文献[22,23])。适应性喂养3 d后称重。每天一次受试组分别灌胃相应剂量,正常组、模型组给予蒸馏水,连续给药15 d。15 d灌胃给药后2 h,模型组及各给药组均腹腔注射0.1% CCl(4用橄榄油稀释)10 mL/kg,而正常组注射不含CCl4的橄榄油10 mL/kg,禁食,18 h后取血,3000 r/min离心10 min制备血清。处死小鼠后取肝脏、胸腺、脾脏器官,称其重量,分别计算肝脏、胸腺和脾脏指数。
肝脏指数=肝脏湿质量(g)/小鼠体质量(g)×100%。
胸腺指数=胸腺湿质量(g)/小鼠体质量(g)×100%。
脾脏指数=脾脏湿质量(g)/小鼠体质量(g)×100%。
1.4.2 肝损伤生化指标的检测
血清中的 ALT,AST水平和肝组织中 SOD,GSH-Px活性和MDA 的含量均按试剂盒说明书操作。
1.4.3 KCPC对线粒体肿胀的影响及SDH含量的影响
小鼠肝线粒体的提取参考王建华的方法[24]。取小鼠肝脏组织冰浴下以0.32 M蔗糖制成10%匀浆,将其在1500 r/min,4 ℃下离心10 min,取上清液,沉淀颗粒重悬浮于 10 mL的 1 mM的 EDTA和 10 mM Tris-HCl(pH 7.1)分离缓冲液中在相同条件下进行离心。合并两次上清液,再以17000 r/min离心20 min。沉淀再次加入分离缓冲液洗涤离心后(7000 r/min,15 min),即为线粒体沉淀物。
将上述制备的线粒体加入 3.0 mL生理盐水制成肝线粒体悬浮液,取0.4 mL KCPC溶液(0.5 mg/mL),于肝线粒体悬浮液中,再加入0.5 nmol/L的硫酸亚铁溶液0.4 mL和0.5 nmol/L的Vit.C溶液0.4 mL,迅速混匀激发反应,反应体系放入 37 ℃水浴锅中保温。空白组用生理盐水替代硫酸亚铁和 Vit.C溶液,对照组生理盐水替代样品溶液。在520 nm处测定不同反应时间后的吸光值,线粒体膜受氧化损伤而发生肿胀,吸光值下降。按照试剂盒说明检测SDH含量,在600 nm处测定其吸光值,计算SDH活力。
1.4.4 肝组织病理组织学观察
选取小块肝右叶未有机械损伤处的组织,固定在预先配好的10%甲醛中,石蜡包埋切片,观察肝组织病理变化。
1.4.5 结果统计
2 结果与讨论
2.1 KCPC对CCl4致小鼠肝损伤肝脏、脾脏、胸腺指数的影响
由表1可知,与正常组相比,模型组小鼠肝脏重量上升,肝脏指数极显著增加(p<0.01),说明肝脏可能出现损伤,导致在一定程度上病变肿大;与模型组相比,KCPC高剂量组小鼠肝脏指数显著降低(p<0.05),为模型组的 90.55%。胸腺为体内重要免疫器官是T淋巴细胞发育、分化的主要场所。脾脏为机体的淋巴器官,含淋巴细胞和巨噬细胞,在免疫系统中起重要作用。因此,胸腺和脾脏指数可作为免疫反应功能变化的参考指标[25]。由结果可知,模型组小鼠的脾脏指数相比正常组显著升高(p<0.05),说明CCl4激发了小鼠机体的免疫反应,且KCPC各剂量组的胸腺和脾脏指数相比模型组均有所降低,但无显著性差异(p>0.05)。
2.2 小鼠血清中各项生化指标的变化
ALT、AST主要分布在肝脏中,当小鼠机体受到CCl4诱导时,大量自由基产生,如三氯甲烷自由基(CCI3·)[26]等,引起膜的脂质过氧化,从而改变肝细胞膜的通透性,导致细胞质内的ALT和AST大量外泄进入血清,在一定程度上可以反应肝细胞的受损程度[27]。各组小鼠血清中ALT、AST活性检测结果见图1。
表1 KCPC对CCl4致肝损伤小鼠肝脏指数的影响Table 1 Influence of liver coefficient of CCl4-induced liver injury in mice of KCPC (±s,n=10)
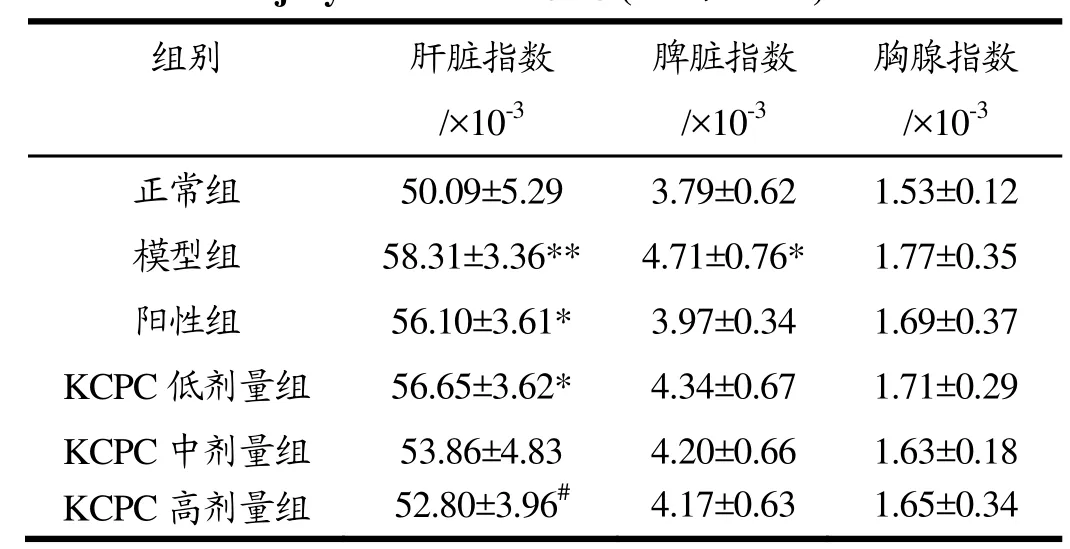
表1 KCPC对CCl4致肝损伤小鼠肝脏指数的影响Table 1 Influence of liver coefficient of CCl4-induced liver injury in mice of KCPC (±s,n=10)
注:与正常对照组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05。
组别 肝脏指数/×10-3脾脏指数/×10-3胸腺指数/×10-3正常组 50.09±5.29 3.79±0.62 1.53±0.12模型组 58.31±3.36** 4.71±0.76* 1.77±0.35阳性组 56.10±3.61* 3.97±0.34 1.69±0.37 KCPC 低剂量组 56.65±3.62* 4.34±0.67 1.71±0.29 KCPC 中剂量组 53.86±4.83 4.20±0.66 1.63±0.18 KCPC 高剂量组 52.80±3.96# 4.17±0.63 1.65±0.34

图1 KCPC对CCl4致肝损伤小鼠血清转氨酶ALT、AST的影响Fig.1 Influence of serum transaminases ALT and AST of CCl4-induced liver injury in mice of KCPC (±s,n=10)
与正常组相比,模型组血清中ALT、AST显著上升(p<0.01),表明肝细胞受到一定程度的损伤,造模成功;与模型组相比,KCPC中、高剂量组小鼠血清中ALT、AST活性极显著降低(p<0.01),其中KCPC高剂量组(800 mg/kg)ALT、AST活性分别比模型组降低了 82.46%和 69.41%,强于阳性药物联苯双酯(29.15%、8.80%)。
2.3 小鼠肝脏中各项生化指标的变化

图2 KCPC对CCl4致肝损伤小鼠肝组织SOD(图a)、GSH-Px活性(图b)和MDA含量(图c)的影响Fig.2 Influence of SOD (a), GSH-Px activity (b), and MDA level(c) of CCl4-induced liver injury in mice liver tissue of KCPC(±s,n=10)
MDA是脂质过氧化最重要的产物之一,为评价脂质过氧化程度的重要指标[28];SOD和GSH-Px是机体内重要的抗氧化物酶,能够评价机体清除氧自由基的能力。各组小鼠肝脏中SOD、GSH-Px活性及MDA含量结果见图 2。与模型组相比,KCPC中、高剂量组肝组织SOD、GSH-Px活性显著增加,MDA含量显著下降(p<0.01),其中KCPC高剂量组小鼠肝组织SOD、GSH-Px活性分别比模型组增加了 101.08%和92.13%,MDA含量降低了45.16%。各指标呈现一定的剂量依赖关系,随着剂量的增大,抗氧化酶活性相应增加,由结果可知,KCPC各剂量组能够提高机体抗氧化酶的活性,加速体内清除自由基的能力,降低脂质过氧化发生,对肝损伤起到保护作用,这与邹金发[29]等人研究原花青素对大鼠化学性肝损伤的保护作用一致,肝组织SOD活性显著升高(p<0.01),MDA含量显著下降(p<0.01),表明原花青素在大鼠体内很好的发挥了抗氧化作用,清除了自由基,保护细胞免受损伤。
2.4 KCPC对线粒体肿胀的影响及SDH活性影响
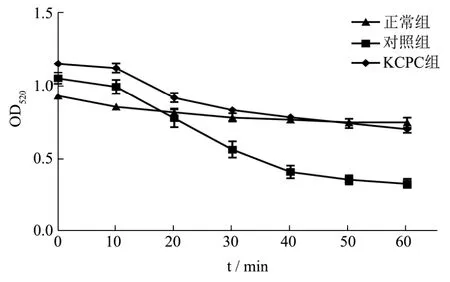
图3 KCPC对线粒体肿胀度的影响Fig.3 Effect of KCPC on mitochondrial swelling

图4 KCPC对CCl4致肝损伤小鼠肝脏线粒体SDH活力的影响Fig.4 Influence of SDH activity CCl4-induced liver injury in mice liver tissue of KCPC (±s,n=10)
线粒体是细胞内能量代谢的主要场所,是多类药物的细胞内靶点,其结构和功能正常对维持生物体的正常活动有重要的意义。采用Fe2+-Vc体系可引起线粒体的膜构造改变,使其丧失屏障功能,内外离子交换发生障碍。线粒体肿胀发生后,线料体悬液的浑浊度下降,使得其在520 nm处吸光值下降[30]。由图3可以看出,正常组曲线趋于平缓,KCPC组相比对照组变化幅度较小。当Fe2+-Vc作用10~40 min时,对照组的线粒体肿胀逐渐加重,悬液浑浊度下降,吸光值明显降低,反应60 min时,KCPC组与正常组没有显著差异(OD值分别为0.747±0.034和0.702±0.024),说明 KCPC具有抑制线粒体肿胀的能力,可能是KCPC减轻了自由基导致的线粒体氧化损伤,恢复了ATP酶活性[31]。
SDH是一种线粒体内膜结合的酶,参与氧化磷酸化和电子转移的过程,为线粒体的有氧呼吸链提供电子,是线粒体进行三羧酸循环过程中的关键酶,因此SDH为线粒体的标志性酶,其活性反应线粒体功能的强弱[32]。
由图4可知,与正常组相比,模型组肝脏线粒体SDH活性显著降低(p<0.01);与模型组相比,KCPC中、高剂量组分别使SDH活性增加22.15%和53.76%(p<0.05或p<0.01)。随着KCPC剂量的增加,对肝脏线粒体的保护作用越大。
2.5 肝组织病理观察结果


图5 不同组小鼠肝细胞HE染色组织形态学观察Fig.5 Morphology of liver cells from different groups
将固定好的肝脏组织进行石蜡包埋,切片,苏木精-伊红(HE)染色,结果如图 5所示。正常组肝细胞索排列整齐,有完整的肝小叶结构,细胞核大小正常,无炎性细胞浸润(见图 5a,5b)。模型组肝组织有多处坏死,肝细胞疏松、肿胀,细胞形态不规则,可见明显的点状和灶状坏死,变性肝细胞弥漫性肿大,胞浆空泡明显,广泛脂肪变性,其中以肝小叶中央区最为严重,坏死处肝小叶结构明显破坏,中央静脉及肝血窦充血水肿(见图 5c,5d)。KCPC低剂量组和阳性对照组肝脏组织损伤有所减少,表现为点状和灶状坏死的肝细胞减少,炎性细胞减少(见图5e,5f;5g,5h);KCPC中、高剂量组绝大部分肝组织结构正常,炎性细胞浸润明显减少,肝窦恢复正常,肝索呈放射状排列,说明其对小鼠肝细胞的保护效果较为明显(见图 5i,5j;5k,5l)。
3 结论
本研究通过建立CCl4诱导的小鼠肝损伤模型,发现 KCPC对肝损伤具有一定的保护作用,且随着KCPC剂量的增加,对肝组织的保护作用越明显,KCPC高剂量组强于阳性对照联苯双酯。KCPC能够显著降低血清中 ALT、AST的含量(p<0.01),使肝脏中MDA含量显著下降(p<0.01),抗氧化酶GSH-Px和SOD活力显著升高(p<0.01),此外,KCPC能够抑制线粒体肿胀,显著增加 SDH的活性(p<0.01),减轻肝细胞线粒体的损伤。因此,推测KCPC可能通过提高抗氧化物酶的活性,从而减少氧化应激发挥对肝细胞的保护作用。
